- 2021-05-19 发布 |
- 37.5 KB |
- 24页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
新教材高中化学第三章自然界中的元素第四节第2课时溴与海水提溴课件鲁科版必修1
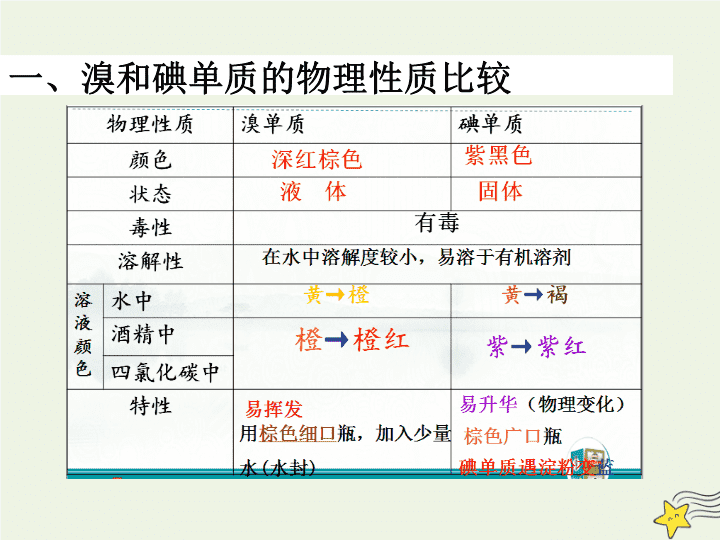
第 4 节 海水中的元素 学习目标 1. 认识氯、溴、碘单质的氧化性强弱比较,以及溴单质和溴的化合物的主要用途。 2. .通过对氯、溴、碘单质的氧化性和氧化性强弱比较的活动探究,学会应用氧化还原原理设计实验探究物质氧化性或还原性相对强弱的方法。 第 1 课时 海水中的元素 镁与海水提镁 地球上 99% 的溴元素以 Br - 的形式存在于海水中。 溴元素又被称为 “海洋元素” 一、溴和碘单质的物理性质比较 氯、溴、碘的原子结构 Cl Br I 最外层最子数相同 性质相似 —都有氧化性 三、溴和海水提溴 2 、化学性质 ①与金属反应 Fe+ Cl 2 ==== 点燃 ②与非金属反应( H 2 ) ③与水反应 Cl 2 + H 2 O ==== ④与碱的反应 Cl 2 + NaOH ==== Cl 2 + H 2 ====== 光照或点燃 ⑤ 与 SO 2 的反应 SO 2 + Cl 2 + H 2 O = 2 、化学性质 ①与金属反应 2Fe+3Cl 2 ====2FeCl 3 点燃 ②与非金属反应( H 2 ) ③与水反应 Cl 2 +H 2 O ====HCl+HClO ④与碱的反应 Cl 2 +2NaOH ==== NaCl+NaClO+H 2 O Cl 2 +H 2 ====== 2HCl 光照或点燃 ⑤ 与 SO 2 的反应 SO 2 + Cl 2 + 2 H 2 O = H 2 SO 4 + 2HCl 2Fe+3Br 2 ====2FeBr 3 Br 2 +H 2 ====== 2HBr 加热 Br 2 +2NaOH ==== NaBr+NaBrO+H 2 O Br 2 +H 2 O ====HBr+HBrO SO 2 + Br 2 + 2 H 2 O = H 2 SO 4 + 2HBr ①与金属反应 2Fe+3Br 2 ====2FeBr 3 2Fe+3Cl 2 ====2FeCl 3 点燃 Fe+l 2 ==== Fel 2 △ 低价态金属碘化物 2 、化学性质 ( X 表示 Cl 、 Br 、 I ) ②与非金属反应( H 2 ) X 2 +H 2 ====== 2HX 一定条件 ③与水反应 X 2 +H 2 O ====HX+HXO ④与碱的反应 X 2 +2NaOH ==== NaX+NaXO+H 2 O 溴和碘的溶解性 溴水 CCl 4 振荡 CCl 4 层 水层 碘水 振荡 CCl 4 水层 CCl 4 层 溴在水中溶解度不大,如何来提取溴呢? 萃取 装置: 注意: 原则:1、萃取剂与原溶剂互不相溶 2、溶质在萃取剂中溶解度较大 分液时,下层液体从下口放出,上层液体要从上口倒出 利用某种物质(溶质)在 互不相溶 的溶剂里 溶解度 的不同,用一种溶剂把它从 溶解度较小的溶剂 转移到 溶解度较大的溶剂 中的方法。 溴( Br 2 ) 水和四氯化碳 四氯化碳 水 已知溴在酒精中的溶解度大于溴在水中的溶解度,加入酒精能否实现溴和水的分离? 不可以,酒精与水互溶 氯、溴和碘单质的 氧化性 强弱比较 试剂: 氯水,溴水、碘水、 NaCl 溶液、 NaBr 溶液、 KI 溶液 实验方案: 【 活动 · 探究 】 知识支持 氧化性:氧化剂 > 氧化产物 还原性:还原剂 > 还原产物 氧化剂 + 还原剂 ———— 氧化产物 + 还原产物 实 验 方 案 设计实验方案: 向 NaCl 溶液中分别加入溴水 向 NaCl 溶液中分别加入碘水 向 NaBr 溶液中分别加入氯水 向 NaBr 溶液中分别加入碘水 向 KI 溶液中分别加入氯水 向 KI 溶液中分别加入溴水 再滴加四氯化碳溶液 水层 CCl 4 层 加 CCl 4 溶液 振荡 NaBr 溶液 氯水 氧化性 : Cl 2 >Br 2 2NaBr+Cl 2 ====2NaCl+Br 2 还原性: Br - > Cl - Cl 2 、 Br 2 、 I 2 氧化性强弱比较 Cl 2 、 Br 2 氧化性强弱比较 CCl 4 溶液 振荡 KI 溶液 溴水 氧化性 : Br 2 >I 2 还原性: I - > Br - 2KI+Br 2 ==== 2KBr+I 2 水层 CCl 4 层 Br 2 、 I 2 氧化性强弱比较 CCl 4 溶液 振荡 KI 溶液 氯水 氧化性 : Cl 2 >I 2 还原性: I - > Cl - 水层 CCl 4 层 2KI+Cl 2 ====2KCl+I 2 氧化性 : Cl 2 >Br 2 >I 2 还原性: I - > Br - > Cl - Cl 2 、 I 2 氧化性强弱比较 实验项目 实验操作方法 实验现象 离子方程式 氯置换溴 ① 氯水 滴入 NaBr 溶液,振荡 ②加 CCl 4 振荡 氯置换碘 ① 氯水 滴入 KI 溶液,振荡 ②加 CCl 4 振荡 溴置换碘 ① 溴水 滴入 KI 溶液,振荡 ② 加 CCl 4 振荡 结论 ① 无色变橙色②上层无色,下层橙红色 ① 无色变褐色②上层无色,下层深紫色 ① 无色变褐色②上层无色,下层深紫色 Br 2 + 2 KI =2 KBr + I 2 单质的氧化性: Br 2 >I 2 Cl 2 + 2 KI =2 KCl + I 2 单质的氧化性: Cl 2 > I 2 Cl 2 + 2NaBr =2NaCl + Br 2 单质的氧化性: Cl 2 > Br 2 氯、溴、碘单质的氧化性 Cl 2 >Br 2 >I 2 海水 晒盐 NaCl 苦卤 通入 Cl 2 溴的水溶液 鼓入热空气或水蒸气 溴 利用 Br 2 的易挥发的性质 2Br - +Cl 2 ====Br 2 +2Cl - 3 、海水提溴 ( 浓缩、氧化、提取 ) 地球上 99% 的溴元素以 Br - 的形式存在于海水中,根据以上三种单质的氧化性强弱,我们可以用什么物质从海水中提取溴单质呢 ? 【 迁移 · 应用 】 NaCl 溶液 AgNO 3 溶液和稀 HNO 3 白色沉淀 4 、 Cl - 、 Br - 、 I - 离子的检验方案 NaCl+AgNO 3 ==NaNO 3 +AgCl↓ (白色) (1) 、 Cl - 离子的检验 Cl - +Ag + ==AgCl↓ (白色) KBr 溶液 稀 HNO 3 +AgNO 3 溶液 ( 淡黄色沉淀 ) KI 溶液 稀 HNO 3 +AgNO 3 溶液 ( 黄色沉淀) (2) 、 Br - 、 I - 的检验 KI+AgNO 3 ==KNO 3 +AgI↓( 黄色 ) NaBr+AgNO 3 ==NaNO 3 +AgBr↓( 淡黄色 ) Br - +Ag + ==AgBr↓ I - +Ag + ==AgI↓ 卤化银的制取及卤离子的检验 NaCl + AgNO 3 = NaNO 3 +AgCl NaBr+ AgNO 3 = NaNO 3 +AgBr KI + AgNO 3 = KNO 3 + AgI ( 白色) (浅黄色) (黄色) AgCl AgBr AgI 均不溶于稀硝酸中 硝酸银溶液和 稀硝酸,可作为检验氯离子、 溴离子及碘离子的试剂。 思考 : 如何鉴别 NaCl 、 NaBr 、 KI 三瓶无色溶液? 方法一:分别滴加 AgNO 3 溶液和稀硝酸 ,产生 白色 沉淀的为 NaCl 溶液,产生 淡黄色 沉淀的为 NaBr 溶液,产生 黄色 沉淀的为 KI 溶液。 方法二:分别滴加 氯水 ,再加入少量 四氯化碳 ,振荡,下层 无色 的为 NaCl 、下层为 橙红色 的为 NaBr ,下层为 紫红色 的为 KI 溶液。 溴的用途 工业: 大量用来制造燃料的抗爆剂;见光 容易分解的 AgBr 常被用作感光材料。 农业:常使用含溴的杀虫剂 医药方面:红药水的主要成分是含溴和汞的有机化合物 , 溴化钠和溴化钾长被用做镇静剂 。 卤化银的性质及用途 溴化银用于制照相的感光片 碘化银可用于人工降雨 2 AgBr 2Ag + Br 2 光照 2 AgI 2Ag + I 2 光照 感光性 用途:查看更多