- 2021-05-19 发布 |
- 37.5 KB |
- 12页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学二轮复习考前保温训练2含解析
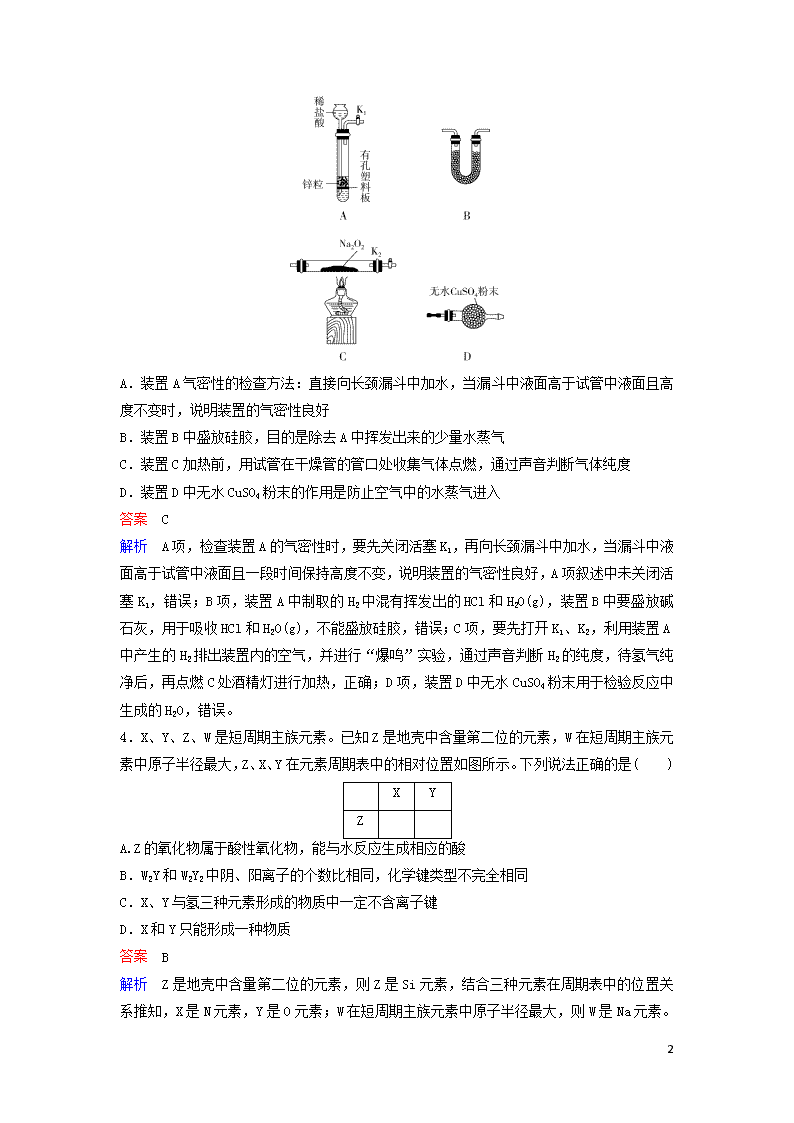
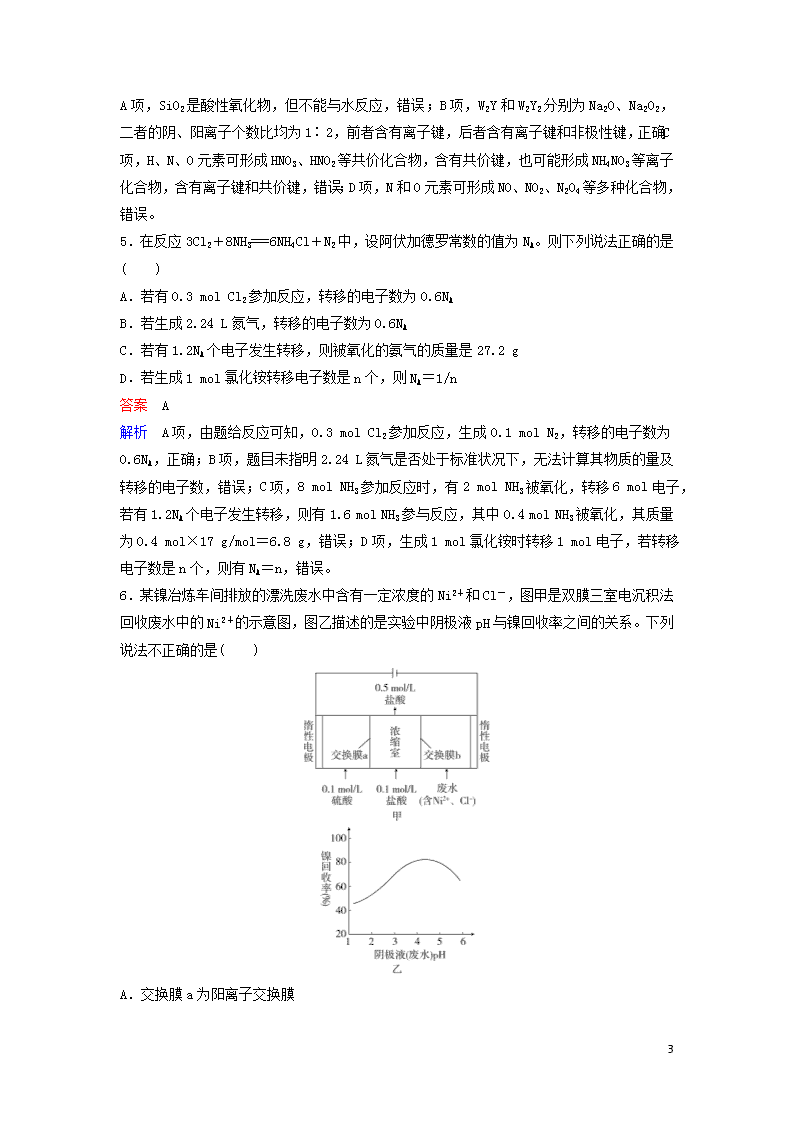
考前保温训练7+4(2) 1.化学与社会、生活密切相关。对下列现象或事实的解释正确的是( ) 选项 现象或事实 解释 A 用浸有KMnO4溶液的硅藻土作水果保鲜剂 酸性KMnO4溶液能氧化水果释放的催熟剂乙烯 B 用氢氟酸蚀刻玻璃 SiO2是碱性氧化物,能溶于酸 C 过氧化钠作呼吸面具中的供氧剂 过氧化钠是强氧化剂,能氧化二氧化碳 D Al(OH)3用作塑料的阻燃剂 Al(OH)3受热熔化放出大量的热 答案 A 解析 A项,乙烯对水果具有催熟作用,酸性KMnO4溶液能氧化成熟水果释放出的乙烯生成CO2,故对水果有保鲜作用,正确;B项,SiO2是酸性氧化物,除氢氟酸外,不能溶于其他的酸,错误;C项,Na2O2与CO2发生的反应为2Na2O2+2CO2===2Na2CO3+O2,Na2O2既是氧化剂又是还原剂,CO2并未被氧化,错误;D项,Al(OH)3用作塑料的阻燃剂,是利用Al(OH)3在熔化、分解时吸收热量,且生成的Al2O3性质较稳定,错误。 2.双环己烷()又称联环己烷、环己基环己烷,是一种具有广泛应用前景的有机物。下列关于该化合物的说法错误的是( ) A.与互为同分异构体 B.一氯代物和二氯代物均超过3种 C.所有碳原子均处于同一平面内 D.生成1 mol C12H26至少需要2 mol H2 答案 C 解析 A项,双环己烷的分子式为C12H22,与该有机物的分子式相同,结构不同,二者互为同分异构体,正确;B项,双环己烷分子结构对称,含有4种不同氢原子,则其一氯代物有4种;二氯代物中2个Cl原子在同一碳原子上有3种结构,2个Cl原子在不同碳原子上有多种结构,正确;C项,双环己烷分子中碳原子均为饱和碳原子(即形成4个单键),故所有碳原子不可能共平面,错误;D项,双环己烷的分子式为C12H22,理论上与2 mol H2反应生成1 mol C12H26,正确。 3.某同学结合所学知识探究Na2O2和H2能否反应,下列操作及分析中正确的是( ) 12 A.装置A气密性的检查方法:直接向长颈漏斗中加水,当漏斗中液面高于试管中液面且高度不变时,说明装置的气密性良好 B.装置B中盛放硅胶,目的是除去A中挥发出来的少量水蒸气 C.装置C加热前,用试管在干燥管的管口处收集气体点燃,通过声音判断气体纯度 D.装置D中无水CuSO4粉末的作用是防止空气中的水蒸气进入 答案 C 解析 A项,检查装置A的气密性时,要先关闭活塞K1,再向长颈漏斗中加水,当漏斗中液面高于试管中液面且一段时间保持高度不变,说明装置的气密性良好,A项叙述中未关闭活塞K1,错误;B项,装置A中制取的H2中混有挥发出的HCl和H2O(g),装置B中要盛放碱石灰,用于吸收HCl和H2O(g),不能盛放硅胶,错误;C项,要先打开K1、K2,利用装置A中产生的H2排出装置内的空气,并进行“爆鸣”实验,通过声音判断H2的纯度,待氢气纯净后,再点燃C处酒精灯进行加热,正确;D项,装置D中无水CuSO4粉末用于检验反应中生成的H2O,错误。 4.X、Y、Z、W是短周期主族元素。已知Z是地壳中含量第二位的元素,W在短周期主族元素中原子半径最大,Z、X、Y在元素周期表中的相对位置如图所示。下列说法正确的是( ) X Y Z A.Z的氧化物属于酸性氧化物,能与水反应生成相应的酸 B.W2Y和W2Y2中阴、阳离子的个数比相同,化学键类型不完全相同 C.X、Y与氢三种元素形成的物质中一定不含离子键 D.X和Y只能形成一种物质 答案 B 解析 Z是地壳中含量第二位的元素,则Z是Si元素,结合三种元素在周期表中的位置关系推知,X是N元素,Y是O元素;W在短周期主族元素中原子半径最大,则 12 W是Na元素。A项,SiO2是酸性氧化物,但不能与水反应,错误;B项,W2Y和W2Y2分别为Na2O、Na2O2,二者的阴、阳离子个数比均为1∶2,前者含有离子键,后者含有离子键和非极性键,正确;C项,H、N、O元素可形成HNO3、HNO2等共价化合物,含有共价键,也可能形成NH4NO3等离子化合物,含有离子键和共价键,错误;D项,N和O元素可形成NO、NO2、N2O4等多种化合物,错误。 5.在反应3Cl2+8NH3===6NH4Cl+N2中,设阿伏加德罗常数的值为NA。则下列说法正确的是( ) A.若有0.3 mol Cl2参加反应,转移的电子数为0.6NA B.若生成2.24 L氮气,转移的电子数为0.6NA C.若有1.2NA个电子发生转移,则被氧化的氨气的质量是27.2 g D.若生成1 mol氯化铵转移电子数是n个,则NA=1/n 答案 A 解析 A项,由题给反应可知,0.3 mol Cl2参加反应,生成0.1 mol N2,转移的电子数为0.6NA,正确;B项,题目未指明2.24 L氮气是否处于标准状况下,无法计算其物质的量及转移的电子数,错误;C项,8 mol NH3参加反应时,有2 mol NH3被氧化,转移6 mol电子,若有1.2NA个电子发生转移,则有1.6 mol NH3参与反应,其中0.4 mol NH3被氧化,其质量为0.4 mol×17 g/mol=6.8 g,错误;D项,生成1 mol氯化铵时转移1 mol电子,若转移电子数是n个,则有NA=n,错误。 6.某镍冶炼车间排放的漂洗废水中含有一定浓度的Ni2+和Cl-,图甲是双膜三室电沉积法回收废水中的Ni2+的示意图,图乙描述的是实验中阴极液pH与镍回收率之间的关系。下列说法不正确的是( ) A.交换膜a为阳离子交换膜 12 B.阳极反应式为2H2O-4e-===O2↑+4H+ C.阴极液pH=1时,镍的回收率低主要是有较多的H2生成 D.浓缩室得到1 L 0.5 mol/L的盐酸时,阴极回收得到11.8 g镍 答案 D 解析 A项,阳极区域是稀硫酸,电极反应式为2H2O-4e-===4H++O2↑,H+透过交换膜a进入浓缩室,则交换膜a是阳离子交换膜,正确;B项,由A项分析可知,阳极反应式为2H2O-4e-===4H++O2↑,正确;C项,阴极上发生还原反应,当阴极液pH=1时溶液呈强酸性,H+在阴极上发生还原反应生成H2,导致镍的回收率降低,正确;D项,浓缩室得到1 L 0.5 mol/L盐酸,相当于生成了0.4 mol HCl,则转移电子为0.4 mol,阴极上生成镍和氢气,故阴极回收的镍质量小于11.8 g,错误。 7.某温度下,向10 mL 0.1 mol·L-1 CuCl2溶液中滴加0.1 mol·L-1的Na2S溶液,滴加过程中,溶液中-lgc(Cu2+)与Na2S溶液体积(V)的关系如下图所示,已知:lg2=0.3,Ksp(ZnS)=3×10-25。下列有关说法不正确的是( ) A.a、b、c三点中,水的电离程度最大的为b点 B.Na2S溶液中存在关系式:2[c(S2-)+c(HS-)+c(H2S)]=c(Na+) C.该温度下Ksp(CuS)=4×10-36 D.向100 mL Zn2+、Cu2+浓度均为1×10-5 mol·L-1的混合溶液中逐滴加入1×10-4 mol·L-1的Na2S溶液,Cu2+先沉淀 答案 A 解析 A项,Na2S中S2-发生水解而促进水的电离,b点CuCl2溶液与Na2S恰好完全反应生成CuS沉淀和NaCl,c点Na2S溶液过量,故c点溶液中水的电离程度最大,错误;B项,Na2S溶液中,据物料守恒可得关系式:2[c(S2-)+c(HS-)+c(H2S)]=c(Na+),正确;C项,图中b点-lgc(Cu2+)=17.7,则有c(Cu2+)=10-17.7 mol·L-1,故该温度下Ksp(CuS)=c(Cu2+)·c(S2-)=(10-17.7 mol·L-1)2=10-35.4=4×10-36,正确;D项,由于Ksp(CuS)=4×10-36查看更多
- 当前文档收益归属上传用户
- 下载本文档