- 2021-02-26 发布 |
- 37.5 KB |
- 6页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
广西专用2020版高考化学二轮复习专题能力训练10化学实验设计与评价含解析
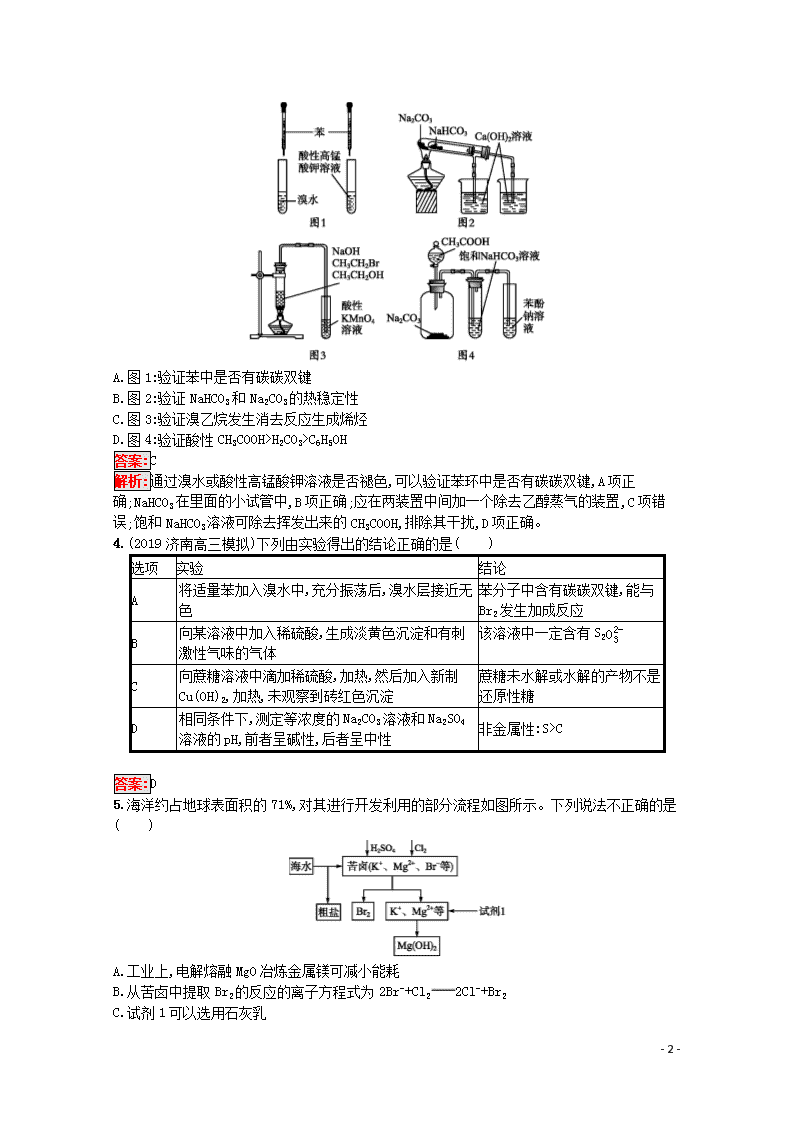
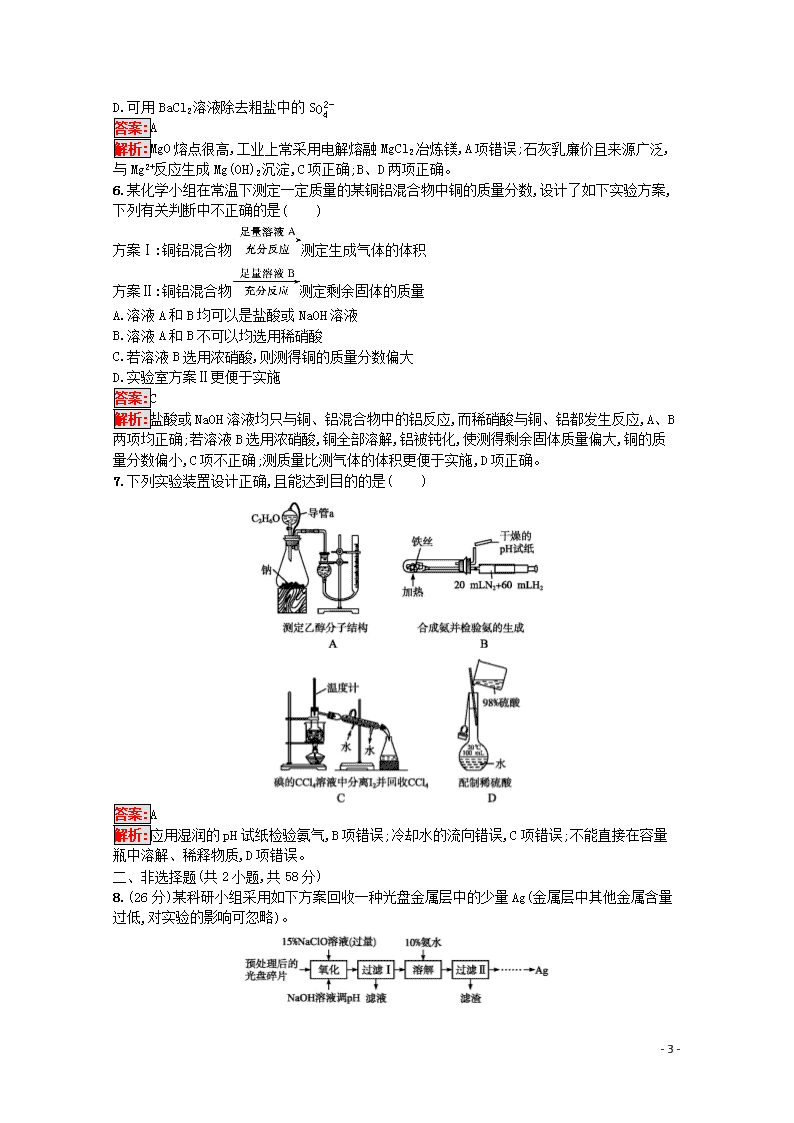
专题能力训练10 化学实验设计与评价 (时间:45分钟 满分:100分) 一、选择题(共7小题,每小题6分,共42分。每小题只有1个选项符合题意) 1.用下列实验方案不能达到实验目的的是( ) A.图A装置——Cu与稀硝酸制取NO B.图B装置——检验乙炔的还原性 C.图C装置——实验室制取溴苯 D.图D装置——实验室分离CO和CO2 答案:B 2.以下实验设计能达到实验目的的是( ) 选项 实验目的 实验设计 A 除去NaHCO3固体中的Na2CO3 将固体加热至恒重 B 制备无水AlCl3 蒸发Al与稀盐酸反应后的溶液 C 重结晶提纯苯甲酸 将粗品水溶、过滤、蒸发、结晶 D 鉴别NaBr和KI溶液 分别加新制氯水后,用CCl4萃取 答案:D 解析:NaHCO3受热易分解,而Na2CO3受热不易分解,故A项错;AlCl3易水解,故蒸发Al与稀盐酸反应后的溶液得不到AlCl3而是得到Al(OH)3,B项错;苯甲酸常温下微溶于水,故提纯苯甲酸时,应将粗品在加热条件下溶于水,趁热过滤,冷却结晶,C项错;氯水与NaBr和KI反应分别生成Br2、I2,两者都易溶于CCl4,分别在CCl4层中显橙红色、紫红色,D项正确。 3.下列实验方案设计不合理的是( ) - 6 - A.图1:验证苯中是否有碳碳双键 B.图2:验证NaHCO3和Na2CO3的热稳定性 C.图3:验证溴乙烷发生消去反应生成烯烃 D.图4:验证酸性CH3COOH>H2CO3>C6H5OH 答案:C 解析:通过溴水或酸性高锰酸钾溶液是否褪色,可以验证苯环中是否有碳碳双键,A项正确;NaHCO3在里面的小试管中,B项正确;应在两装置中间加一个除去乙醇蒸气的装置,C项错误;饱和NaHCO3溶液可除去挥发出来的CH3COOH,排除其干扰,D项正确。 4.(2019济南高三模拟)下列由实验得出的结论正确的是( ) 选项 实验 结论 A 将适量苯加入溴水中,充分振荡后,溴水层接近无色 苯分子中含有碳碳双键,能与Br2发生加成反应 B 向某溶液中加入稀硫酸,生成淡黄色沉淀和有刺激性气味的气体 该溶液中一定含有S2O32- C 向蔗糖溶液中滴加稀硫酸,加热,然后加入新制Cu(OH)2,加热,未观察到砖红色沉淀 蔗糖未水解或水解的产物不是还原性糖 D 相同条件下,测定等浓度的Na2CO3溶液和Na2SO4溶液的pH,前者呈碱性,后者呈中性 非金属性:S>C 答案:D 5.海洋约占地球表面积的71%,对其进行开发利用的部分流程如图所示。下列说法不正确的是( ) A.工业上,电解熔融MgO冶炼金属镁可减小能耗 B.从苦卤中提取Br2的反应的离子方程式为2Br-+Cl22Cl-+Br2 C.试剂1可以选用石灰乳 - 6 - D.可用BaCl2溶液除去粗盐中的SO42- 答案:A 解析:MgO熔点很高,工业上常采用电解熔融MgCl2冶炼镁,A项错误;石灰乳廉价且来源广泛,与Mg2+反应生成Mg(OH)2沉淀,C项正确;B、D两项正确。 6.某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案,下列有关判断中不正确的是( ) 方案Ⅰ:铜铝混合物测定生成气体的体积 方案Ⅱ:铜铝混合物测定剩余固体的质量 A.溶液A和B均可以是盐酸或NaOH溶液 B.溶液A和B不可以均选用稀硝酸 C.若溶液B选用浓硝酸,则测得铜的质量分数偏大 D.实验室方案Ⅱ更便于实施 答案:C 解析:盐酸或NaOH溶液均只与铜、铝混合物中的铝反应,而稀硝酸与铜、铝都发生反应,A、B两项均正确;若溶液B选用浓硝酸,铜全部溶解,铝被钝化,使测得剩余固体质量偏大,铜的质量分数偏小,C项不正确;测质量比测气体的体积更便于实施,D项正确。 7.下列实验装置设计正确,且能达到目的的是( ) 答案:A 解析:应用湿润的pH试纸检验氨气,B项错误;冷却水的流向错误,C项错误;不能直接在容量瓶中溶解、稀释物质,D项错误。 二、非选择题(共2小题,共58分) 8.(26分)某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含量过低,对实验的影响可忽略)。 - 6 - 已知:①NaClO溶液在受热或酸性条件下易分解,如:3NaClO2NaCl+NaClO3 ②AgCl可溶于氨水:AgCl+2NH3·H2OAg(NH3)2++Cl-+2H2O ③常温时N2H4·H2O(水合肼)在碱性条件下能还原Ag(NH3)2+: 4Ag(NH3)2++N2H4·H2O4Ag↓+N2↑+4NH4++4NH3↑+H2O (1)“氧化”阶段需在80 ℃条件下进行,适宜的加热方式为 。 (2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为 。HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是 。 (3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并 。 (4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3·H2O反应外(该条件下NaClO3与NH3·H2O不反应),还因为 。 (5)请设计从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案: (实验中须使用的试剂有:2 mol·L-1水合肼溶液,1 mol·L-1 H2SO4)。 答案:(1)水浴加热 (2)4Ag+4NaClO+2H2O4AgCl+4NaOH+O2↑ 会释放出氮氧化物(或NO、NO2),造成环境污染 (3)将洗涤后的滤液合并入过滤Ⅱ的滤液中 (4)未过滤掉的溶液会稀释加入的氨水,且其中含有一定浓度的Cl-,不利于AgCl与氨水反应 (5)向滤液中滴加2 mol·L-1水合肼溶液,搅拌使其充分反应,同时用1 mol·L-1 H2SO4溶液吸收反应中放出的NH3,待溶液中无气泡产生,停止滴加,静置,过滤、洗涤,干燥 解析:(1)在80 ℃条件下加热,可采用水浴,受热均匀,且温度易控。 (2)反应物为NaClO、Ag和水,产物为AgCl、NaOH和O2,依据得失电子守恒将方程式配平,在该反应中Ag为还原剂,NaClO既作氧化剂又作还原剂;HNO3在氧化Ag时,自身被还原为氮的氧化物,污染环境。 (4)氧化后的溶液中含有大量的Cl-,AgCl与氨水的反应原理为AgCl+2NH3·H2OAg(NH3)2++Cl-+2H2O。较多Cl-的存在,使该平衡逆向移动,不利于AgCl沉淀的溶解,同时由于溶液的存在会对加入的氨水起到稀释作用。 (5)过滤Ⅱ后的滤液中含有Ag(NH3)2+,依据已知③可知加入2 mol·L-1水合肼溶液,即可生成Ag沉淀,同时生成NH3和N2,用1 mol·L-1 H2SO4溶液吸收NH3防止污染环境,待溶液中无气泡产生,停止滴加水合肼溶液,静置,然后过滤、洗涤,干燥即可得到金属银。 9.(32分)水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg·L-1。我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5 mg·L-1。某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO。 Ⅰ.测定原理: - 6 - 碱性条件下,O2将Mn2+氧化为MnO(OH)2:①2Mn2++O2+4OH-2MnO(OH)2↓。酸性条件下,MnO(OH)2将I-氧化为I2:②MnO(OH)2+I-+H+Mn2++I2+H2O(未配平),用Na2S2O3标准溶液滴定生成的I2:③2S2O32-+I2S4O62-+2I- Ⅱ.测定步骤: a.安装装置,检验气密性,充N2排尽空气后,停止充N2。 b.向烧瓶中加入200 mL水样。 c.向烧瓶中依次迅速加入1 mL MnSO4无氧溶液(过量)、2 mL碱性KI无氧溶液(过量),开启搅拌器,至反应①完全。 d.搅拌并向烧瓶中加入2 mL H2SO4无氧溶液,至反应②完全,溶液为中性或弱酸性。 e.从烧瓶中取出40.00 mL溶液,以淀粉作指示剂,用0.010 00 mol·L-1 Na2S2O3溶液进行滴定,记录数据。 f.…… g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。 回答下列问题: (1)配制以上无氧溶液时,除去所用溶剂水中氧的简单操作为 。 (2)在橡胶塞处加入水样及有关试剂应选择的仪器是 。 ①滴定管 ②注射器 ③量筒 (3)搅拌的作用是 。 (4)配平反应②的方程式,其化学计量数依次为 。 (5)步骤f为 。 (6)步骤e中达到滴定终点的标志为 。若某次滴定消耗Na2S2O3溶液4.50 mL,水样的DO= mg·L-1(保留一位小数)。作为饮用水源,此次测得DO是否达标: (填“是”或“否”)。 (7)步骤d中加入H2SO4溶液反应后,若溶液pH过低,滴定时会产生明显的误差。写出产生此误差的原因(用离子方程式表示,至少写出2个) 。 答案:(1)将溶剂水煮沸后冷却 (2)② (3)使溶液混合均匀,快速完成反应 (4)1,2,4,1,1,3 (5)重复步骤e的操作2~3次 (6)溶液蓝色褪去(半分钟内不变色) 9.0 是 (7)2H++S2O32-S↓+SO2↑+H2O SO2+I2+2H2O4H++SO42-+2I- 4H++4I-+O22I2+2H2O(任写其中2个) 解析:(1)气体在水中的溶解度随着温度升高而减小,煮沸溶剂水可以除去溶剂水中的氧。 (3)搅拌会使溶液充分混合,加快反应物的反应速率。 (4)根据得失电子守恒可配平反应②中的离子方程式: MnO(OH)2+2I-+4H+Mn2++I2+3H2O (5)对定量实验一般要进行多次,因此步骤f应为重复步骤e的操作2~3次,以便减小实验误差。 (6)烧瓶中碘单质使淀粉变为蓝色,加入Na2S2O3溶液将I2还原为I-,因此当蓝色消失且半分钟不变色时,表明I2已反应完,达到滴定终点。 - 6 - 4.5 mL溶液中含有Na2S2O3:n(Na2S2O3)=0.010 00 mol·L-1×0.004 5 L=4.5×10-5 mol,结合反应①②③,可得关系式:O2~2MnO(OH)2~2I2~4S2O32-,则n(O2)=14n(Na2S2O3)= 1.125×10-5 mol。 该河水的DO=1 00040×1.125×10-5×32 g·L-1=9×10-3 g·L-1=9.0 mg·L-1>5 mg·L-1,说明达标。 (7)若溶液pH过低,Na2S2O3在酸性条件下会分解产生SO2,SO2又能与I2反应;同时在酸性条件下,I-又易被空气中的O2氧化。 - 6 -查看更多