- 2021-05-12 发布 |
- 37.5 KB |
- 38页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
浙江省2021高考化学一轮复习专题三专项突破4化学工艺流程题的分析课件
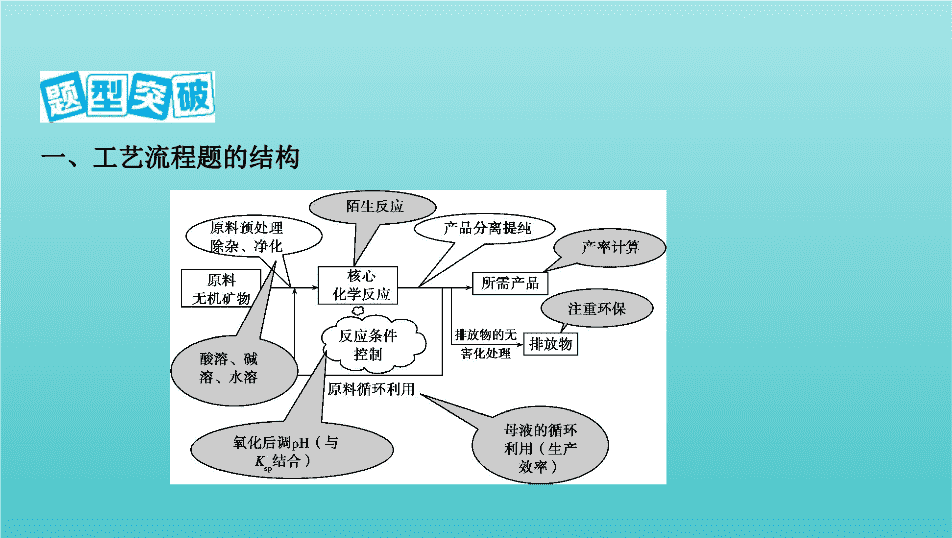
专项突破4 化学工艺流程题的分析 一、工艺流程题的结构 二、工艺流程题分类突破 题型一 物质制备类化工流程题 1.核心反应——陌生方程式的书写 关注箭头的指向:箭头指入→反应物,箭头指出→生成物。 (1)氧化还原反应:熟练应用氧化还原反应的规律判断产物和配平。 (2)非氧化还原反应:结合物质性质和实际反应判断产物。 2.原料的预处理 (1)溶解:通常用酸溶。如用稀硫酸、盐酸等。 (2)灼烧、焙烧、煅烧:改变物质结构,使一些物质能溶解,并使一些杂质 高温下氧化、分解。 水浸 与水接触反应或溶解 浸出 固体加水(酸)溶解得到离子 酸浸 在酸性溶液中反应,使可溶性金属离子进入溶液,不溶物通过过滤除去 浸出率 固体溶解后,金属被浸出的百分率 3.常用的控制反应条件的方法 (1)调节溶液的pH。常用于使某些金属离子形成氢氧化物沉淀。调节pH所 需的物质一般应满足两点: ①能与H + 反应,使溶液pH增大; ②不引入新杂质。 例如:若要除去Cu 2+ 中混有的Fe 3+ ,可加入CuO、CuCO 3 、Cu(OH) 2 、Cu 2 (OH) 2 CO 3 等物质来调节溶液的pH,不可加入NaOH溶液、氨水等。 (2)控制温度。根据需要升温或降温,改变反应速率或使平衡向需要的方向移 动。 (3)趁热过滤。防止某物质降温时析出。 (4)冰水洗涤。洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损 耗。 题型二 提纯类化工流程题 1.明确常用的提纯方法 (1)水溶法:除去可溶性杂质。 (2)酸溶法:除去碱性杂质。 (3)碱溶法:除去酸性杂质。 (4)氧化剂或还原剂法:除去还原性或氧化性杂质。 (5)加热灼烧法:除去受热易分解或易挥发的杂质。 (6)调节溶液的pH法:如除去酸性溶液中的Fe 3+ 等。 2.明确常用的分离方法 (1)过滤:分离难溶物和易溶物,根据特殊需要采用趁热过滤或者抽滤等方 法。 (2)萃取和分液:利用溶质在互不相溶的溶剂里的溶解度不同分离物质,如用 四氯化碳或苯萃取溴水中的溴单质。 (3)蒸发结晶:提取溶解度随温度变化不大的溶质,如NaCl。 (4)冷却结晶:提取溶解度随温度变化较大的溶质、易水解的溶质或结晶水合 物,如KNO 3 、FeCl 3 、CuCl 2 、CuSO 4 ·5H 2 O、FeSO 4 ·7H 2 O等。 (5)蒸馏或分馏:分离沸点不同且互溶的液体混合物,如分离乙醇和甘油。 (6)冷却法:利用气体液化的特点分离气体,如合成氨工业采用冷却法分离混 合气体中的氨气。 1.(2019河南八市重点高中联考)三氧化铬(CrO 3 )又叫铬酸酐,是一种暗红色固 体,溶于水会生成铬酸(H 2 CrO 4 ),200 ℃以上会部分分解生成氧化铬(Cr 2 O 3 )。 Ⅰ.下图是用铬铁矿(主要成分是FeCr 2 O 4 ,含Al 2 O 3 、SiO 2 等杂质)生产CrO 3 的传 统工艺流程,请回答相关问题。 (1)操作1的名称是 ,沉淀X的成分是 (填化学式)。 (2)高温煅烧时FeCr 2 O 4 参与反应的化学方程式是 。 Ⅱ.某工厂采用了一种新的生产CrO 3 的工艺流程,与传统工艺流程的主要区别 如下图所示(中间过程省略)。 (3)液相转化过程发生反应的化学方程式是 。 (4)新工艺与传统工艺相比有多种优点:可得到价值更高的副产品KNO 3 ; ;从绿色化学角度考虑新工艺存在的缺点是 。 答案 (1)溶解、过滤 Al(OH) 3 、H 2 SiO 3 (2)4FeCr 2 O 4 +8Na 2 CO 3 +7O 2 2Fe 2 O 3 +8Na 2 CrO 4 +8CO 2 (3)K 2 Cr 2 O 7 +2HNO 3 (浓) 2KNO 3 +2CrO 3 +H 2 O (4)能耗较低、产品纯度更高 硝酸挥发或分解会产生污染 解析 (1)铬铁矿与纯碱、空气高温煅烧后的固体通过操作1后得到固体和 溶液,故操作1的名称是溶解、过滤;通过调节pH,使溶液中的偏铝酸根离子和 硅酸根离子转化成沉淀,故沉淀X的成分是Al(OH) 3 、H 2 SiO 3 。 (2)高温煅烧时FeCr 2 O 4 与纯碱、空气反应生成Fe 2 O 3 、Na 2 CrO 4 和CO 2 ,反应的 化学方程式是4FeCr 2 O 4 +8Na 2 CO 3 +7O 2 2Fe 2 O 3 +8Na 2 CrO 4 +8CO 2 。 (3)液相转化过程中K 2 Cr 2 O 7 与硝酸反应生成KNO 3 、CrO 3 和H 2 O,发生反应的 化学方程式是K 2 Cr 2 O 7 +2HNO 3 (浓) 2KNO 3 +2CrO 3 +H 2 O。 (4)新工艺最后一步需要温度是90 ℃,传统工艺是高温,因此新工艺能耗较低; CrO 3 200 ℃以上会部分分解生成Cr 2 O 3 ,因此新工艺所得CrO 3 纯度更高;从绿 色化学角度考虑新工艺存在的缺点是硝酸挥发或分解会产生污染。 2.(2019陕西西北工业大学附中适应性训练)某工业废水中含有CN - 和Cr 2 等 离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理: 回答下列问题: (1)步骤②中,CN - 被ClO - 氧化为CNO - 的离子方程式为 。 (2)步骤③的反应为S 2 +Cr 2 +H + S +Cr 3+ +H 2 O(未配平),则每反应0.1 mol Cr 2 时,消耗S 2 mol。 (3)含Cr 3+ 的废水可以加入熟石灰进一步处理,目的是 。 (4)在25 ℃下,将 a mol·L -1 的NaCN溶液与0.01 mol·L -1 的盐酸等体积混合,反应 后测得溶液pH=7,则 a 0.01(填“>”“<”或“=”);用含 a 的代数式表示 HCN的电离常数 K a = 。 答案 (1)CN - +ClO - CNO - +Cl - (2)0.075 (3)调节废水pH,使其转化成Cr (OH) 3 沉淀除去 (4)> (100 a -1) × 10 -7 解析 (1)碱性条件下,CN - 与NaClO发生氧化还原反应生成CNO - 、Cl - ,离子反 应为CN - +ClO - CNO - +Cl - 。 (2)步骤③的反应为S 2 +Cr 2 +H + S +Cr 3+ +H 2 O,S 2 中S元素的化合 价由+2价升高到+6价生成S ,Cr 2 中Cr元素的化合价由+6价降低到+3价 生成Cr 3+ ,根据得失电子守恒,S 2 和Cr 2 的物质的量之比为3∶4,则每反应 0.1 mol Cr 2 时,消耗S 2 为0.075 mol。 (3)含Cr 3+ 废水有毒,调节废水pH,使其转化成Cr(OH) 3 沉淀除去。 (4)由于反应后测得溶液pH=7,当 a =0.01时,恰好反应,生成了HCN溶液,显酸 性,则氰化钠应该多些,故 a >0.01;由电荷守恒 c (Na + )+ c (H + )= c (OH - )+ c (CN - )+ c (Cl - )及pH=7,可知 c (H + )= c (OH - )=10 -7 mol·L -1 , c (CN - )= c (Na + )- c (Cl - )= a /2 mol·L -1 -0. 01/2 mol·L -1 ,再根据物料守恒: c (CN - )+ c (HCN)= c (Na + )= a /2 mol·L -1 ; K a = = =(100 a -1) × 10 -7 。 3.(2019广东深圳中学适应性考试)铬是一种银白色金属,化学性质稳定,在化 合物中常见+2、+3和+6价等价态。工业上以铬铁矿(主要成分为FeO·Cr 2 O 3 , 含有Al 2 O 3 、SiO 2 等杂质)为主要原料生产金属铬和重铬酸钠晶体Na 2 Cr 2 O 7 ·2H 2 O(已知Na 2 Cr 2 O 7 是一种强氧化剂),其主要工艺流程如下: 查阅资料得知:常温下,NaBiO 3 不溶于水,有强氧化性,在碱性条件下,能将Cr 3+ 转化为Cr 。 回答下列问题: (1)工业上常采用热还原法制备金属铬,写出以Cr 2 O 3 为原料,利用铝热反应制 取金属铬的化学方程式: 。 (2)酸化滤液D时,不选用盐酸的原因是 。 (3)固体E的主要成分是Na 2 SO 4 ,根据下图分析操作a为 、 、洗涤、干燥。 (4)已知含+6价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定 量的Cr 2 。 含Cr 2 的废水 含Cr 3+ 的废水 Cr(OH) 3 沉淀 ①Cr(OH) 3 的化学性质与Al(OH) 3 相似。在上述生产过程中加入NaOH溶液时 要控制溶液的pH不能过高,是因为 (用离子 方程式表示)。 ②用下列溶液代替上述流程中的Na 2 S 2 O 3 溶液,其中最佳的是 (填选 项序号)。 A.FeSO 4 溶液 B.浓硫酸 C.酸性KMnO 4 溶液 D.Na 2 SO 3 溶液 ③上述流程中,每消耗0.1 mol Na 2 S 2 O 3 转移0.8 mol e - ,则加入Na 2 S 2 O 3 溶液时发 生反应的离子方程式为 。 (5)某工厂废水中含1.00 × 10 -3 mol/L的Cr 2 ,某研究性学习小组为了变废为 宝,处理废水得到磁性材料Cr 0.5 Fe 1.5 FeO 4 (Cr元素的化合价为+3,Fe元素的化合 价依次为+3、+2)。欲使1 L该废水中的Cr 2 完全转化为Cr 0.5 Fe 1.5 FeO 4 。理论 上需要加入 g FeSO 4 ·7H 2 O。(已知FeSO 4 ·7H 2 O的摩尔质量为278 g/ mol) 答案 (1)Cr 2 O 3 +2Al Al 2 O 3 +2Cr (2)Cr 2 会氧化Cl - 生成氯气,造成污染 (3)蒸发结晶 趁热过滤 (4)①Cr(OH) 3 +OH - Cr +2H 2 O ②D ③3 S 2 +4Cr 2 +26H + 8Cr 3+ +6S +13H 2 O (5)2.78 解析 (1)利用铝热反应制取金属铬的化学方程式:Cr 2 O 3 +2Al Al 2 O 3 +2 Cr。 (2)酸化滤液D时,不选用盐酸的原因是Na 2 Cr 2 O 7 是一种强氧化剂,Cr 2 会氧化 Cl - 生成氯气,造成污染。 (3)Na 2 Cr 2 O 7 和Na 2 SO 4 的溶解度随温度变化情况存在明显差异,故可利用结晶 的方法进行分离,实际操作为蒸发结晶、趁热过滤。 (4)①Cr(OH) 3 的化学性质与Al(OH) 3 相似,也能溶解在NaOH溶液中,因此加入 NaOH溶液时要控制溶液的pH不能过高,过高说明NaOH明显过量,会溶解Cr (OH) 3 生成NaCrO 2 。 ②Na 2 S 2 O 3 的作用是还原剂,同时氧化产物为Na 2 SO 4 ,没有引入新的杂质,可用 Na 2 SO 3 代替。 ③每消耗0.1 mol Na 2 S 2 O 3 转移0.8 mol e - ,说明其氧化产物全部为Na 2 SO 4 ,此时 发生反应的离子方程式为3S 2 +4Cr 2 +26H + 8Cr 3+ +6S +13H 2 O。 (5)根据Cr 0.5 Fe 1.5 FeO 4 中,Cr∶Fe=0.5∶2.5=1∶5,有 n (FeSO 4 ·7H 2 O)=1.00 × 10 -3 mol/L × 1 L × 2 × 5=10 -2 mol,故其质量为2.78 g。 4.(2019江苏苏锡常镇四市二模)以软锰矿(主要成分为MnO 2 )和硫锰矿(主要 成分为MnS)为原料制备硫酸锰晶体的工艺流程如下: (1)滤渣中存在一种非金属单质,则酸浸过程中的化学方程式为 。 (2)实验常用氧化还原法测定MnSO 4 ·H 2 O晶体的纯度,原理如下: 2Mn 2+ +N +4P +2H + 2[Mn(PO 4 ) 2 ] 3- +N +H 2 O N +N N 2 ↑+2H 2 O [Mn(PO 4 ) 2 ] 3- +Fe 2+ Mn 2+ +[Fe(PO 4 ) 2 ] 3- 称取MnSO 4 ·H 2 O样品1.000 0 g,溶于适量水中,以磷酸作配位剂,加入过量硝酸 铵,在220~240 ℃下充分反应。然后以苯基代邻氨基苯甲酸作指示剂,用0.100 0 mol·L -1 硫酸亚铁铵标准溶液滴定生成的[Mn(PO 4 ) 2 ] 3- 至终点。重复操作3次, 记录数据如下表: 滴定次数 0.100 0 mol·L -1 (NH 4 ) 2 Fe(SO 4 ) 2 标准溶液读数/mL 滴定前 滴定后 1 0.10 20.20 2 1.32 21.32 3 1.05 20.95 已知:Fe 2+ +N +2H + Fe 3+ +NO↑+H 2 O。 ①测定过程中,硝酸铵的作用是 和 。 ②若滴定过程中硫酸亚铁铵标准溶液不是新配制的,所测定的MnSO 4 ·H 2 O晶 体的纯度将会 (填“偏高”“偏低”或“不变”)。 ③计算样品中MnSO 4 ·H 2 O的质量分数(写出计算过程)。 答案 (1)MnO 2 +MnS+2H 2 SO 4 2MnSO 4 +S+2H 2 O (2)①将试样中的二价锰氧化成三价锰 与产生的亚硝酸根反应,消除对滴定 的影响 ②偏高 ③消耗(NH 4 ) 2 Fe(SO 4 ) 2 标准溶液的平均体积为20.00 mL。 2MnSO 4 ·H 2 O~2[Mn(PO 4 ) 2 ] 3- ~2Fe 2+ n (MnSO 4 ·H 2 O)= n (Fe 2+ )=20.00 mL × 10 -3 L·mL -1 × 0.100 0 mol·L -1 =2 × 10 -3 mol 样品中MnSO 4 ·H 2 O的质量分数为 × 100%=33.8% 解析 (1)根据流程图分析,MnO 2 和MnS在稀硫酸中反应生成一种非金属单 质,同时产生MnSO 4 ,则“酸浸”时反应的化学方程式为MnO 2 +MnS+2H 2 SO 4 2MnSO 4 +S+2H 2 O。 (2)①由原理:2Mn 2+ +N +4P +2H + 2[Mn(PO 4 ) 2 ] 3- +N +H 2 O、N +N N 2 ↑+2H 2 O可推测,硝酸铵的作用是将试样中的二价锰氧化成三价锰和 与产生的亚硝酸根反应,消除对滴定的影响。 ②若滴定过程中硫酸亚铁铵标准溶液不是新配制的,部分Fe 2+ 被氧化为Fe 3+ ,滴 定时消耗的标准溶液偏多,故所测定的MnSO 4 ·H 2 O晶体的纯度将会偏高。 5.软锰矿的主要成分为MnO 2 ,还含有Fe 2 O 3 、MgO、Al 2 O 3 、CaO、SiO 2 等杂 质,工业上用软锰矿制取MnSO 4 ·H 2 O的流程如下: 已知:①部分金属阳离子完全沉淀时的pH如下表。 金属阳离子 Fe 3+ Al 3+ Mn 2+ Mg 2+ 完全沉淀时的pH 3.2 5.2 10.4 12.4 ②温度高于27 ℃时,MnSO 4 晶体的溶解度随温度的升高而逐渐降低。 (1)“浸出”过程中MnO 2 转化为Mn 2+ 的离子方程式为 。 (2)第1步除杂中加入H 2 O 2 的目的是 。 (3)第1步除杂中形成滤渣1的主要成分为 (填化学式), 调pH至5~6所加的试剂,可选择 (填以下试剂的序号字母)。 a.CaO b.MgO c.Al 2 O 3 d.氨水 (4)第2步除杂,主要是将Ca 2+ 、Mg 2+ 转化为相应氟化物沉淀除去,写出MnF 2 除 去Mg 2+ 的离子方程式: 。 (5)采用“趁热过滤”操作的原因是 。 (6)取少量MnSO 4 ·H 2 O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是 (用离子方程式表示)。 答案 (1)MnO 2 +SO 2 S +Mn 2+ (2)将Fe 2+ 氧化为Fe 3+ (3)Al(OH) 3 、Fe(OH) 3 ab (4)MnF 2 +Mg 2+ Mn 2+ +MgF 2 (5)减少MnSO 4 ·H 2 O在水中的溶解,得到更多产品 (6)Mn 2+ +2H 2 O Mn(OH) 2 +2H + 解析 (1)“浸出”过程中MnO 2 与SO 2 发生氧化还原反应,离子方程式为MnO 2 +SO 2 S +Mn 2+ 。 (2)第1步除杂中加入H 2 O 2 的目的是将溶液中的Fe 2+ 氧化为Fe 3+ ,以便于形成Fe (OH) 3 沉淀,过滤将沉淀除去。 (3)第1步除杂时调节溶液的pH在5~6,可以使溶液中的Al 3+ 、Fe 3+ 分别形成Al (OH) 3 、Fe(OH) 3 沉淀,所以形成滤渣1的主要成分为Al(OH) 3 、Fe(OH) 3 ;在调 pH至5~6时,为了不引入新的杂质离子,所加的试剂应该可以与酸发生反应,可 选择含有Ca 2+ 、Mg 2+ 的化合物CaO、MgO,a、b正确。 (4)第2步除杂,主要是将Ca 2+ 、Mg 2+ 转化为相应氟化物沉淀除去,MnF 2 除去Mg 2 + 的离子方程式是MnF 2 +Mg 2+ Mn 2+ +MgF 2 。 (5)由已知②温度高于27 ℃时,MnSO 4 晶体的溶解度随温度的升高而逐渐降低 可知,采用“趁热过滤”操作可以减少MnSO 4 ·H 2 O在水中的溶解,得到更多产 品。 (6)MnSO 4 是强酸弱碱盐,Mn 2+ 发生水解反应。查看更多