河南省南阳市2020-2021高二化学上学期期中试题(Word版附答案)
2020~2021 年度河南省南阳地区高二期中适应性摸底考试
化学
考生注意:
1.本试卷分第 I 卷(选择题)和第 II 卷(非选择题)两部分,共 100 分。考试时间 90 分钟。
2.请将各题答案填写在答题卡上。
3.本试卷主要考试内容:鲁科版选修 4 第一章至第二章第二节。
4.可能用到的相对原子质量:H 1 C 12 O 16 Ag 108
第 I 卷(选择题 共 48 分)
一、选择题(本题包括 16 小题,每小题 3 分,共 48 分,每小题只有一个选项符合题意)
1.能源是人类文明发展和进步的基础,化学与能源紧密相关,下列说法不正确的是
A.石油、沼气和潮汐能都是不可再生能源
B.煤、石油、太阳能都属于一次能源
C.“玉兔二号”月球车的帆板太阳能电池材料是硅
D.普及电动汽车有助于减缓城市汽车尾气污染
2.下列有关物质的工业制备方法中,错误的是
A.制备硅:用焦炭还原二氧化硅得到粗硅,再精制得到高纯硅
B.制备钠:以海水为原料制得 NaCl,再电解 NaCl 溶液得到钠
C.制备铁:以焦炭和铁矿石为原料,用 CO 还原铁矿石得到铁
D.制备镁:以海水为原料,经一系列过程制得氯化镁,电解熔融氯化镁得到镁
3.用简易量热计测定中和反应的反应热的实验中,下列叙述错误的是
A.向量热计中加入盐酸,盖上杯盖,搅拌后的温度即为初始温度
B.实验中选用不同的酸和碱时,只要操作正确,测得的反应热一定相同
C.向量热计中加入碱液时,碱液的温度应与酸液的温度相同
D.两溶液混合后,轻轻搅动溶液,准确读取混合溶液的最高温度
4.下列关于原电池的叙述正确的是
A.原电池放电时,外电路中电流的方向是从正极到负极
B.原电池是将化学能全部转化为电能的装置
C.在原电池中,电子流出的一极是负极,该电极被还原
D.构成原电池的正极和负极必须是两种不同的金属
5.向一恒容密闭容器中加入一定量的 Fe(s)和 CO2(g),发生反应 Fe(s)+CO2(g) FeO(s)+
CO(g),700℃时,K=1;900℃时,K=1.5。下列说法正确的是
A.该反应为放热反应
B.该反应的化学平衡常数表达式为 K=
2
c FeO c CO
c Fe c CO
C.700℃时通入 CO2,平衡向正反应方向移动,K 值增大
D.从 700℃到 900℃,容器中 CO(g)的平衡浓度增加了 20%
6.铅蓄电池的两极分别为 Pb、PbO2,电解质溶液为 30% H2SO4 溶液,放电时的电池反应为 Pb
+PbO2+2H2SO4=2PbSO4+2H2O,下列关于放电时的说法正确的是
A.Pb 电极质量减小 B.PbO2 电极质量减小
C.H+向 Pb 电极移动 D.电解质溶液的 pH 不断增大
7.H2 和 Cl2 在光照下发生反应释放出大量的热量。在反应过程中,断裂 1 mol H2(g)中的化学键
消耗的能量为 Q1 kJ,断裂 1 mol Cl2(g)中的化学键消耗的能量为 Q2 kJ,形成 1 mol HCl(g)中的
化学键释放的能量为 Q3 kJ。下列关系式中正确的是
A.Q1+Q2<2Q3 B.Q1+Q2>2Q3 C.Q1+Q2
0
9.完全燃烧 m g 液态乙醇得到液态水时放出的热量为 a kJ,经测定 m g 液态乙醇与足量的 Na
反应时可生成 1.0 g H2,则液态乙醇完全燃烧的热化学方程式为
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-2a kJ·mol-1
B.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=+a kJ·mol-1
C.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-a kJ·mol-1
D.C2H5OH(l)+O2(g)=2CO2(g)+3H2O(l) △H=+2a kJ·mol-1
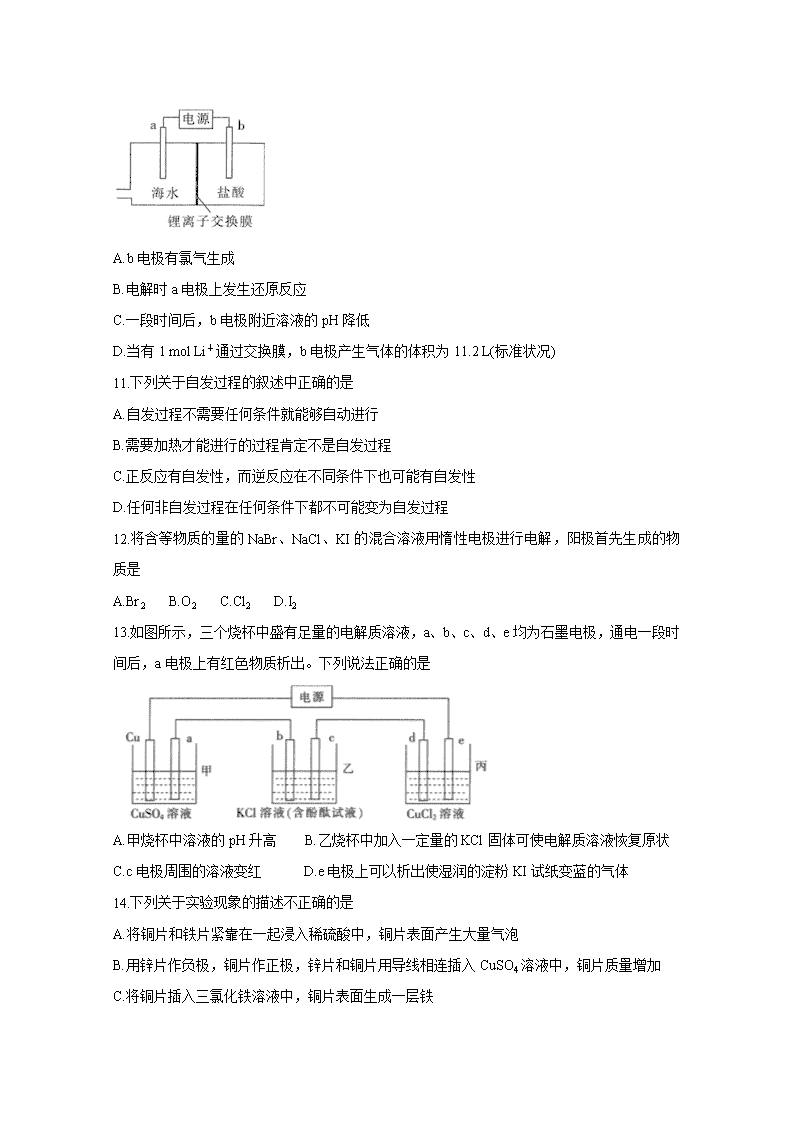
10.海水是一个巨大的资源宝库,科研人员利用电解原理富集海水中的锂离子,其原理如图所
示(a、b 均为惰性电极),下列有关说法正确的是
A.b 电极有氯气生成
B.电解时 a 电极上发生还原反应
C.一段时间后,b 电极附近溶液的 pH 降低
D.当有 1 mol Li+通过交换膜,b 电极产生气体的体积为 11.2 L(标准状况)
11.下列关于自发过程的叙述中正确的是
A.自发过程不需要任何条件就能够自动进行
B.需要加热才能进行的过程肯定不是自发过程
C.正反应有自发性,而逆反应在不同条件下也可能有自发性
D.任何非自发过程在任何条件下都不可能变为自发过程
12.将含等物质的量的 NaBr、NaCl、KI 的混合溶液用惰性电极进行电解,阳极首先生成的物
质是
A.Br2 B.O2 C.Cl2 D.I2
13.如图所示,三个烧杯中盛有足量的电解质溶液,a、b、c、d、e 均为石墨电极,通电一段时
间后,a 电极上有红色物质析出。下列说法正确的是
A.甲烧杯中溶液的 pH 升高 B.乙烧杯中加入一定量的 KCl 固体可使电解质溶液恢复原状
C.c 电极周围的溶液变红 D.e 电极上可以析出使湿润的淀粉 KI 试纸变蓝的气体
14.下列关于实验现象的描述不正确的是
A.将铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面产生大量气泡
B.用锌片作负极,铜片作正极,锌片和铜片用导线相连插入 CuSO4 溶液中,铜片质量增加
C.将铜片插入三氯化铁溶液中,铜片表面生成一层铁
D.将锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,产生气泡的速率加快
15.下列事实不能用平衡移动原理解释的是
A.新制的氯水放置一段时间,溶液的颜色会变浅
B.密闭容器中发生反应 H2(g)+I2(g) 2HI(g),达到平衡后,增大压强,气体颜色变深
C.恒容容器中发生反应 CO(g)+NO2(g) CO2(g)+NO(g) △H<<0,达到平衡后,升高温度,
气体颜色变深
D.增大压强,有利于 SO2(g)与 O2(g)反应生成 SO3(g)
16.如图所示,将金属 M 连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。下列有关说法
正确的是
A.阴极的电极反应式为 Fe-2e-=Fe2+
B.金属 M 可以是 Cu
C.钢铁设施表面因积累大量电子而被保护
D.钢铁设施在河水中的腐蚀速率比在海水中的快
第 II 卷(非选择题 共 52 分)
二、非选择题(本题包括 5 小题,共 52 分)
17.(10 分)中和热、反应热都是表示化学反应伴随的能量变化。
(1)已知:①2CO(g)+2NO(g)=N2(g)+2CO2(g) △H1=-747.0 kJ·mol-1
②N2(g)+O2(g)=2NO(g) △H2=+180.0 kJ·mol-1
则 CO(g)+ 1
2
O2(g)=CO2(g) △H3= 。
(2)已知:H2(g)+ 1
2
O2(g)=H2O(l) △H=-285.8 kJ·mol-1,等质量的下列物质分别完全燃烧,
放出热量最多的是 (填标号)。
A.液态 H2 B.气态 H2 C.液态 CO D.气态 CO
(3)已知:通常条件下,强酸、强碱的稀溶液中和生成 1 molH2O(l)放出的热量为中和热。稀溶
液中 1 mol H2SO4(l)和足量 NaOH 恰好反应时放出 Q kJ 热量,则其中和热△H= kJ·mol-1,
2 mol 醋酸和足量 NaOH 恰好反应时放出的热量为 Q1 kJ,则 Q1 (填“>”“<”或“=”)Q。
(4)已知断开 1 mol H-H 键、1 mol O=O 键、1 mol O-H 键吸收的能量分别为 Q1 kJ、Q2 kJ、
Q3 kJ,则 H2(g)和 O2(g)反应生成 1 mol H2O(g)的△H= kJ·mol-1。
18.(11 分)通过测定 50 mL 0.50 mol·L-1 盐酸与 50 mL 0.55mol·L-1 NaOH 溶液反应过程中放出
的热量可计算中和热[指中和反应生成 1 mol H2O(l)时放出的热量]。某兴趣小组设计实验装置
如图所示,请回答下列问题:
(1)从所学内容判断,图中尚缺少的一种仪器是 ;该装置还有不妥之处,应如何改
正? 。
(2)烧杯间填满碎泡沫塑料的作用是 。
(3)如果大烧杯上不盖硬纸板,则计算出的中和热(△H)会 (填“偏大”“偏小”或“无
影响”)。
(4)实验中改用 60 mL 0.50 mol·L-1 盐酸与 50 mL 0.55 mol·L-1 NaOH 溶液进行反应,与上述实
验相比,所放出的热量 (填“相等”或“不相等”,下同),计算出的中和热 。
(5)下列关于中和热的说法正确的是 。
A.稀硫酸和 Ba(OH)2 溶液代替盐酸与 NaOH 溶液进行中和热测定,所测中和热数值相同
B.测定中和热时,为保证酸、碱充分反应,应将碱溶液缓慢分次倒入酸溶液中,并充分搅拌
C.温度计测量盐酸的温度后,用蒸馏水洗净后再测 NaOH 溶液温度
19.(12 分 )T ℃ 时 , 体 积 均 为 2 L 的 三 个 恒 容 密 闭 容 器 中 发 生 合 成 氨 反 应 : N2(g) +
3H2(g) 2NH3(g) △H=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如表所示:
回答下列问题:
(1)容器①中,反应达到平衡时 H2(g)的转化率为 ;若要增大 H2(g)的转化率,可采
取的措施有 (填两种)。
(2)T℃时,合成氨反应的平衡常数 K= (保留三位有效数字);容器②中反应达到平衡
时放出的热量 Q= kJ。
(3)容器③中反应达到平衡时,体系将 (填“放出”或“吸收”)热量。
(4)平衡时,容器①中 H2 的体积分数 (填“大于”“小于”或“等于”)容器③中 H2
的体积分数。
20.(10 分)用如图装置进行电解实验(a、b、c、d 均为铂电极),供选择的有 4 组电解液,其体积
均为 500 mL,浓度均为 2 mol·L-1:
(1)工作时,a、b、c、d 电极上均有气体产生,则选择的电解液是上述四组中的第 组。
(2)选择第 1 组电解液时,电解过程中各电极上的电极反应为 a 极: ;
b 极: ;c 极: ;d 极: 。
(3)选择第 2 组电解液时,当 b 极析出 2 g 电解产物时,a 极上析出产物的质量为 g;
忽略电解前后电解液的体积变化,此时 B 槽中的 c(OH-)= mol·L-1。(不考虑 OH-
与 Cl2 的反应)
21.(9 分)某化学兴趣小组对某一类型反应进行研究[aA(g) bB(g)+cC(g)],得到图像如下(其
中 p 表示压强,T 表示温度,n 表示物质的量,a 表示转化率不同反应中,A,B,C 为不同物
质)。回答下列问题:
(1)在反应 I 中,该反应的正反应为 (填“放热”或“吸热”)反应,若 p1>p2,则 a
(填“>”“=”或“<”)b+c,由此判断,该反应自发进行必须满足的条件是 。
(2)在反应 II 中,T1 (填“>”“<”或“=”)T2,该反应的正反应为 (填“放热”
或“吸热”)反应。
(3)在反应 III 中,若 T1>T2,且该反应能正向自发进行,则△S (填“>”“<”或,“=”)0。