高二化学上学期期中试题(2)
长春外国语学校2018-2019学年第一学期期中考试高二年级
化学试卷(理科)
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共4页。考试结束后,将答题卡交回。
注意事项:
1. 答题前,考生先将自己的姓名、准考证号填写清楚,将条形码准确粘贴在考生信
息条形码粘贴区。
2.选择题必须使用2B铅笔填涂;非选择题必须使用0.5毫米黑色字迹的签字笔书
写,字体工整、笔迹清楚。
3.请按照题号顺序在各题目的答题区域内作答,超出答题区域书写的答案无效;
在草稿纸、试题卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5. 保持卡面清洁,不要折叠,不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
第Ⅰ卷
一、选择题:本题共14小题,每小题3分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.根据反应Br+H2HBr+H的能量随反应历程的变化示意图甲进行判断,
下列叙述中不正确的是( )
A.正反应吸热
B.加入催化剂,该化学反应的反应热不变
C.加入催化剂后,该反应的能量随反应历程的变化示意图可用图乙表示
D.加入催化剂可增大正反应速率,降低逆反应速率
2.在2 L的密闭容器中,发生以下反应:2A(g)+B(g)2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol·L-1·s-1,则10秒钟时,容器中B的物质的量是 ( )
A.1.6 mol B.2.8 mol C.2.4 mol D.1.2 mol
3.对可逆反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列叙述正确的是( )
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v正(H2O)
4.下列说法正确的是( )
A.增大压强,活化分子百分数增多,化学反应速率一定增大
B.升高温度,活化分子百分数不一定增大,化学反应速率一定增大
C.加入反应物,使活化分子百分数增加,化学反应速率增大
D.使用催化剂,降低了反应的活化能,增大了活化分子百分数,
化学反应速率一定增大
5.25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
Sn(s)+Pb2+(aq)Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。
下列判断正确的是 ( )
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
D.25 ℃时,该反应的平衡常数K=2.2
6.在一定温度不同压强(p1
p2,x轴表示温度,y轴表示平衡时混合气体中G的体积分数。
据此可判断( )
①上述反应是放热反应 ②上述反应是吸热反应
③a>b ④ac(CH3COO-)>c(H+)>c(OH-)
C.物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者小于后者
D.常温下,某溶液中由水电离出的c(H+)=10-5 mol·L-1,则此溶液可能是盐酸
13.根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,
各种离子浓度关系正确的是( )
化学式
电离常数
HClO
K=3×10-8
H2CO3
K1=4.3×10-7
K2=5.6×10-11
A.c(HCO3― )>c(ClO― )>c(OH― )
B.c(ClO― )>c(HCO3― )>c(H+)
C.c(HClO)+c(ClO― )=c(HCO3― )+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO3― )+c(ClO― )+c(OH― )
14.25 ℃时,在20 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )
A.在A点:c(Na+)>c(OH― )>c(CH3COO― )>c(H+)
B.在B点:c(OH― )=c(H+),c(Na+)=c(CH3COO― )
C.在C点:c(CH3COO― )>c(Na+)>c(H+)>c(OH― )
D.在C点:c(CH3COO― )+c(CH3COOH)=2c(Na+)
第Ⅱ卷
二、填空题:本题共4小题,共58分。
15.(14分)已知2A2(g)+B2(g)2C(g) ΔH=-a kJ·mol-1(a > 0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为w mol·L-1,放出热量b kJ。
(1)a (填“>”“=”或“<”)b。
(2)若将反应温度升高到700 ℃,该反应的平衡常数将 (填“增大”“减小”或“不变”)。
(3)若在原来的容器中,只加入2 mol C,500 ℃时充分反应达到平衡后,吸收热量c kJ,
C的浓度 (填“>”“=”或“<”)w mol·L-1。
(4)能说明该反应已经达到平衡状态的是 。(填序号,下同)
a.v(C)=2v(B2) b.容器内压强保持不变
c.v逆(A2)=2v正(B2) d.容器内气体的密度保持不变
(5)使该反应的反应速率增大,且平衡向正反应方向移动的操作是 ;能使B的
转化率增大的操作是 ;使平衡向逆反应方向移动的操作是 。
a.及时分离出C气体 b.适当升高温度
c.增大B2的浓度 d..选择高效的催化剂
16.(14分)已知化学反应①:Fe(s)+CO2(g)FeO(s)+CO(g),其平衡常数为K1;
化学反应②:Fe(s)+H2O(g)FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1 173 K情况下,K1、K2的值分别如下:
温度
K1
K2
973 K
1.47
2.38
1 173 K
2.15
1.67
请填空:
(1)通过表格中的数值可以推断:反应①是________(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)CO(g)+H2O(g),请你写出该反应的
平衡常数K3的数学表达式:K3=________。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式________,据此关系式
及上表数据,也能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有
________(填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
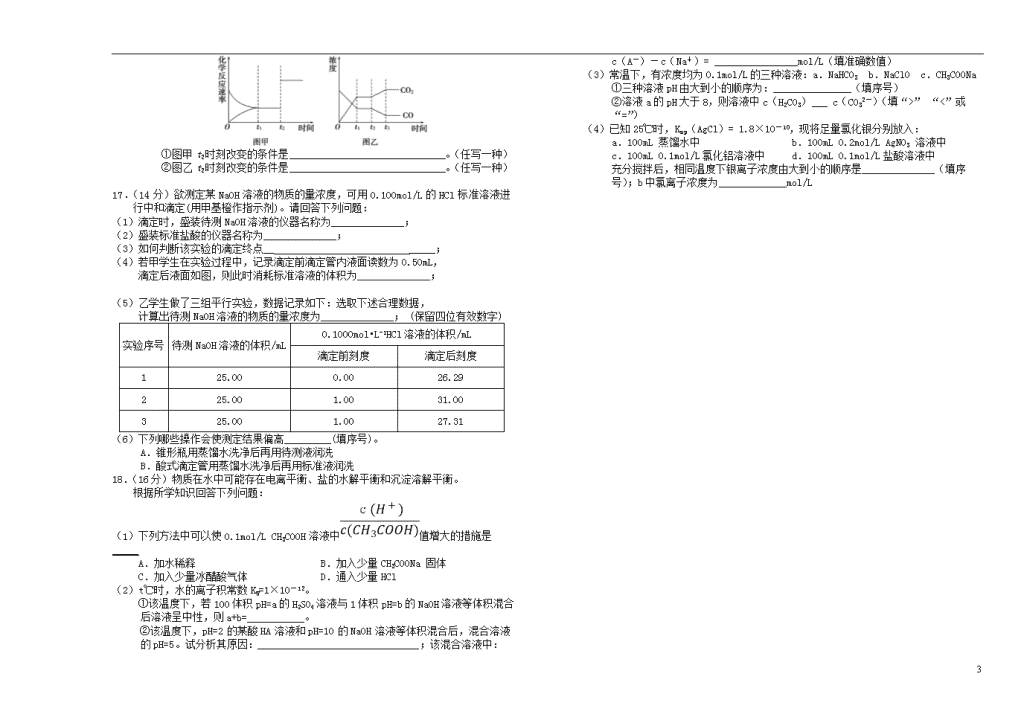
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而
发生变化的情况:
4
①图甲t2时刻改变的条件是______________________________。(任写一种)
②图乙t2时刻改变的条件是______________________________。(任写一种)
17.(14分)欲测定某NaOH溶液的物质的量浓度,可用0.100mol/L的HCl标准溶液进行中和滴定(用甲基橙作指示剂)。请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为______________;
(2)盛装标准盐酸的仪器名称为______________;
(3)如何判断该实验的滴定终点__ _____;
(4)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,
滴定后液面如图,则此时消耗标准溶液的体积为______________;
(5)乙学生做了三组平行实验,数据记录如下:选取下述合理数据,
计算出待测NaOH溶液的物质的量浓度为______________; (保留四位有效数字)
实验序号
待测NaOH溶液的体积/mL
0.1000mol•L-1HCl溶液的体积/mL
滴定前刻度
滴定后刻度
1
25.00
0.00
26.29
2
25.00
1.00
31.00
3
25.00
1.00
27.31
(6)下列哪些操作会使测定结果偏高_________(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
18.(16分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡。
根据所学知识回答下列问题:
(1)下列方法中可以使0.1mol/L CH3COOH溶液中值增大的措施是_____
A.加水稀释 B.加入少量CH3COONa 固体
C.加入少量冰醋酸气体 D.通入少量HCl
(2)t℃时,水的离子积常数KW=1×10-12。
①该温度下,若100体积pH=a的H2SO4溶液与1体积pH=b的NaOH溶液等体积混合后溶液呈中性,则a+b=___________。
②该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。试分析其原因:_______________________________;该混合溶液中:
c(A-)-c(Na+)= ________________mol/L(填准确数值)
(3)常温下,有浓度均为0.1mol/L的三种溶液:a.NaHCO3 b.NaClO c.CH3COONa
①三种溶液pH由大到小的顺序为:_______________(填序号)
②溶液a的pH大于8,则溶液中c(H2CO3)___ c(CO32―)(填“>” “<”或“=”)
(4)已知25℃时,Ksp(AgCl)= 1.8×10-10,现将足量氯化银分别放入:
a.100mL 蒸馏水中 b.100mL 0.2mol/L AgNO3 溶液中
c.100mL 0.1mol/L氯化铝溶液中 d.100mL 0.1mol/L盐酸溶液中
充分搅拌后,相同温度下银离子浓度由大到小的顺序是______________(填序号);b中氯离子浓度为_____________mol/L
4
答案
第Ⅰ卷
1
2
3
4
5
6
7
D
B
A
D
D
B
D
8
9
10
11
12
13
14
A
D
B
C
C
A
A
第Ⅱ卷
二、填空题:本题共4小题,除特殊说明外,每空2分,共58分。
15. (1)> (2)减小 (3)= (4)bc (5)c;a;b
16. (1)吸热 (2) (3)K3= 吸热
(4)CE (5)①增大压强或使用催化剂 ②降低温度或设法分离出H2
17. (1)锥形瓶 (2)酸式滴定管
(3)当滴入最后一滴标准液时,溶液由黄色变成橙色且半分钟内不回复原来颜色(3分)
(4)26.90mL (5)0.1052mol/L (3分) (6)A
18.(1)AD
(2)①14;②HA为弱酸,HA中和NaOH后,混合溶液中有较多HA分子剩余,可继续电离H+ ,使溶液的pH=5;9.9×10-6或者(10-5-10-7)
(3)①b>a>c;②>
(4)b>a>d>c;9×10-10
4