- 2021-05-10 发布 |
- 37.5 KB |
- 15页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习专题二十六物质性质与制备探究性实验含解析
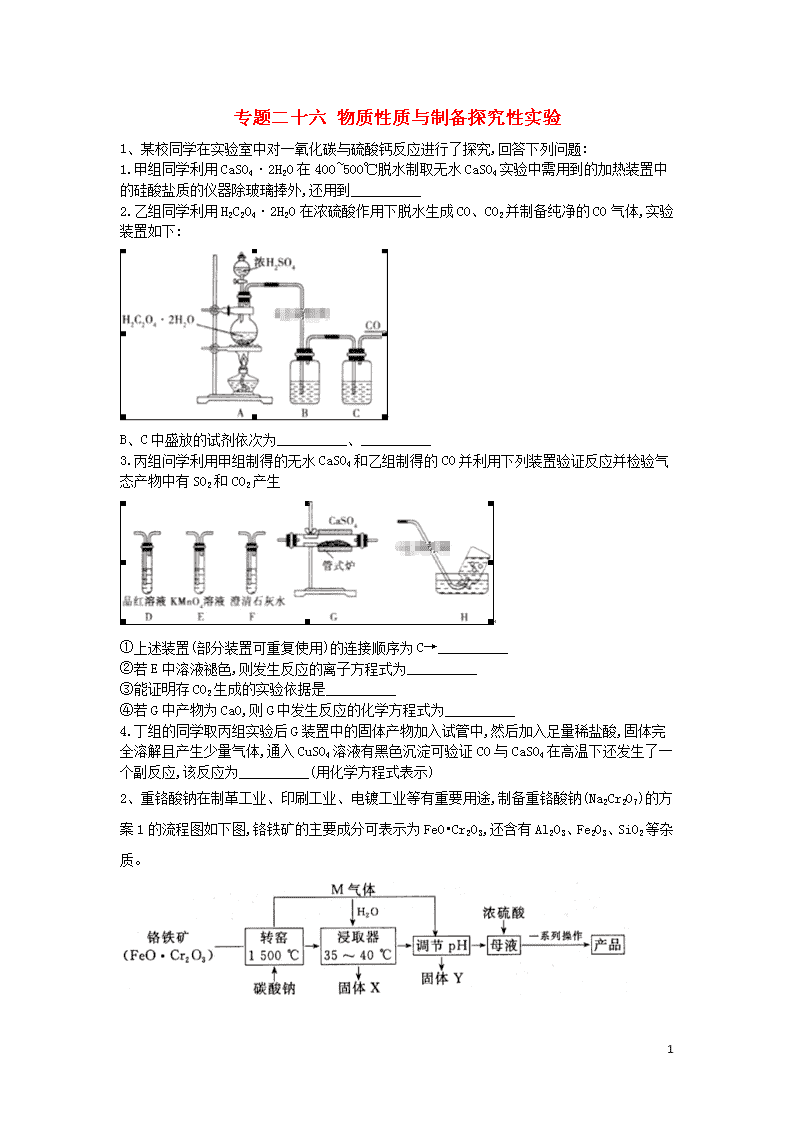
专题二十六 物质性质与制备探究性实验 1、某校同学在实验室中对一氧化碳与硫酸钙反应进行了探究,回答下列问题: 1.甲组同学利用CaSO4·2H2O在400~500℃脱水制取无水CaSO4实验中需用到的加热装置中的硅酸盐质的仪器除玻璃捧外,还用到__________ 2.乙组同学利用H2C2O4·2H2O在浓硫酸作用下脱水生成CO、CO2并制备纯净的CO气体,实验装置如下: B、C中盛放的试剂依次为__________、__________ 3.丙组问学利用甲组制得的无水CaSO4和乙组制得的CO并利用下列装置验证反应并检验气态产物中有SO2和CO2产生 ①上述装置(部分装置可重复使用)的连接顺序为C→__________ ②若E中溶液褪色,则发生反应的离子方程式为__________ ③能证明存CO2生成的实验依据是__________ ④若G中产物为CaO,则G中发生反应的化学方程式为__________ 4.丁组的同学取丙组实验后G装置中的固体产物加入试管中,然后加入足量稀盐酸,固体完全溶解且产生少量气体,通入CuSO4溶液有黑色沉淀可验证CO与CaSO4在高温下还发生了一个副反应,该反应为__________(用化学方程式表示) 2、重铬酸钠在制革工业、印刷工业、电镀工业等有重要用途,制备重铬酸钠(Na2Cr2O7)的方案1的流程图如下图,铬铁矿的主要成分可表示为FeO•Cr2O3,还含有Al2O3、Fe2O3、SiO2等杂质。 15 除此外工厂还有相关改进工艺,制备重铬酸钠(Na2Cr2O7)的方案2如图,采用电化学原理如图所示的装置(电极为NaOH石墨),通过电解提高阳极区溶液的酸性,实现Na2CrO4转浓溶液化为Na2Cr2O7。 1.在方案2中请指明哪端是阴极?_____________(填“左”或“右”),写出阳极的电极方程式___________________。 2.方案1中煅烧前应将铬铁矿充分粉碎,其目的是_______________________。灼烧是中学化学中常用的操作方法,如在实验室中将铬铁矿和碳酸钠固体混合物灼烧,下列各实验仪器中不需要的是__________________(填序号)。 a.陶瓷坩埚 b.铁 c.三脚架 d.泥三角 转窑中发生的主要反应除了下面的两个反应外,还有其他反应。 ①Na2CO3+Al2O32NaAlO2+CO2↑; ②________FeO•Cr2O3+ __________Na2CO3+ ________O2 _______Na2CrO4+_______Fe2O3+_________。 请配平反应②的化学方程式。 请写出其他主要反应方程式:______________、_____________。 3.固体Y的化学式为____________、____________。 4.向母液中加入浓硫酸,把铬酸钠转化为重铬酸钠,经两次蒸发,主要是除去__________(填化学式),冷却至30-40 ℃得到产品晶体。洗涤该晶体的容剂最好是____________(填序号)。 a.蒸馏水 b无水乙醇 c.75%乙醇溶液 5.为了测定实验制得的产品中Na2Cr2O7的含量,称取样品0.140 g置于锥形瓶中,加50 mL水;再加入2 g KI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10 min;然后加入150 mL蒸馏水并加入3 mL 0.5%淀粉溶液;用0.100 0 mol/L.Na2S2O3标准溶液滴定至终点,消耗Na2S2O3 15 标准溶液30.00 mL。(假定杂质不参加反应,已知:+6I- +14H+=2Cr3+ +3I2+7H2O,I2+2=2I-+ ①终点实验现象是______________。 ②该产品中Na2Cr2O7的纯度为________________。(以质量分数表示) ③若滴定管在滴定前俯视读数,滴定结束后视读数,测得样品的纯度将_________(填“偏高"或“偏低”或“无影响") 3、实验室中制备对氯苯甲酸的反应以及装置如下图所示: 常温下,物质的有关数据和性质如表所示: 熔点/℃ 沸点/℃ 密度/g • cm-3 颜色 水溶性 对氯甲苯 7.5 162 1.07 无色 难溶 对氯苯甲酸 243 275 1.54 白色 微溶 对氯苯甲酸钾 具有盐的通性,属于可溶性盐 实验步骤:在规格为250 mL的仪器A中加入一定量的催化剂、适量KMnO4,100 mL水;安装好装置,在滴液漏斗中加入6.00 mL对氯甲苯,在温度为93 ℃左右时,逐滴滴入对氯甲苯;控制温度在93 ℃左右,反应2 h,过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,加入稀硫酸酸化,加热浓缩,冷却,然后过滤,将滤渣用冷水进行洗涤,干燥后称量其质量。请回答下列问题: 1.仪器A的名称为____________。 2.仪器B是冷凝管,实验过程中,冷却水从a口进入,如此操作的目的是____________。 3.实验过程中两次过滤、洗涤操作,第一次过滤的滤渣成分为_____________(填化学式),洗涤该滤渣用热水,目的是______________,第二次过滤后,洗涤滤渣用冷水,目的是___________。 4.过滤、洗涤操作中能用到的仪器是_____________(填选项字母)。 a.烧杯 b.分液漏斗 c.锥形瓶d.玻璃棒 5.第一次过滤后的滤液中加入硫酸,出现的现象是______________。 15 6.如图是温度对对氯苯甲酸产率的影响关系,最后干燥、称量得到的对氯苯甲酸的质量为____________(保留小数点后两位)。 4、叠氮化钠()是一种白色剧毒晶体,是汽车安全气囊的主要成分。易溶于水,微溶于乙醇,水溶液呈弱碱性,能与酸发生反应产生具有爆炸性的有毒气体叠氮化氢。实验室可利用亚硝酸叔丁酯(t-BuNO2,以t-Bu表示叔丁基)与N2H4、氢氧化钠溶液混合反应制备叠氮化钠。 1.制备亚硝酸叔丁酯 取一定溶液与50%硫酸混合,发生反应。可利用亚硝酸与叔丁醇(t-BuOH)在40 ℃左右制备亚硝酸叔丁酯,试写出该反应的化学方程式:________________________________________________________________________。 2.制备叠氮化钠() 按如图所示组装仪器(加热装置略)进行反应,反应方程式为: ①装置a的名称是________________; ②该反应需控制温度在65 ℃,采用的实验措施是____________________; ③反应后溶液在0 ℃下冷却至有大量晶体析出后过滤,所得晶体使用无水乙醇洗涤。试解释低温下过滤和使用无水乙醇洗涤晶体的原因是______________________________________________。 3.产率计算 15 ①称取2.0g叠氮化钠试样,配成100mL溶液,并量取10.00mL溶液于锥形瓶中。 ②用滴定管加入0.10 mol·L-1六硝酸铈铵[(NH4)2Ce(NO3)6]溶液40.00 mL[发生的反应为](假设杂质均不参与反应)。 ③充分反应后将溶液稀释并酸化,滴入2滴邻菲罗啉指示液,并用0.10 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]为标准液,滴定过量的,终点时消耗标准溶液20.00 mL(滴定原理:)。计算可知叠氮化钠的质量分数为__________(保留2位有效数字)。若其他操作及读数均正确,滴定到终点后,下列操作会导致所测定样品中叠氮化钠质量分数偏大的是______(填字母代号)。 A.锥形瓶使用叠氮化钠溶液润洗 B.滴加六硝酸铈铵溶液时,滴加前仰视读数,滴加后俯视读数 C.滴加硫酸亚铁铵标准溶液时,开始时尖嘴处无气泡,结束时出现气泡 D.滴定过程中,将挂在锥形瓶壁上的硫酸亚铁铵标准液滴用蒸馏水冲进瓶内 4.叠氮化钠有毒,可以使用次氯酸钠溶液对含有叠氮化钠的溶液进行销毁,反应后溶液碱性明显增强,且产生无色无味的无毒气体,试写出反应的离子方程式:____________________________。 5、硫代硫酸钠可由亚硫酸钠和硫粉通过化合反应制得: Na2SO3+S = Na2S2O3。常温下溶液中析出晶体为Na2S2O3·5H2O。 Na2S2O3·5H2O于40~45 ℃熔化,48 ℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如下图所示。 Ⅰ.现按如下方法制备Na2S2O3·5H2O: 将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150 mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按如下图所示安装好装置。 15 1.仪器2的名称为_______________,装置6中可放入__________。 A.BaCl2溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.NaOH溶液 2.打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:①Na2CO3+SO2=Na2SO3+CO2 ②Na2S+SO2+H2O=Na2SO3+H2S ③2H2S+SO2=3S+2H2O ④Na2SO3+SNa2S2O3 随着SO2气体的通入,看到溶液中有大量浅黄色固体析出,继续通SO2气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7的理由是:__________________(用文字和相关离子方程式表示)。 Ⅱ.分离Na2S2O3·5H2O并测定含量: 3.为减少产品的损失,操作①为______________,操作②是过滤洗涤干燥,其中洗涤操作是用_____________________(填试剂)作洗涤剂。 4.蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高_____________。 5.制得的粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。 称取1.28 g的粗样品溶于水,用0.40 mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中,全部被氧化时,消耗KMnO4溶液体积20.00 mL。(5+8+14H+ =8Mn2++10+7H2O) 15 试回答: ①滴定终点时的颜色变化:_____________。 ②产品中Na2S2O3·5H2O的质量分数为_____________。 6、某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。 实验一 制取氯酸钾和氯水 利用如图所示的实验装置进行实验(部分夹持仪器省略)。 (1)制取实验结束后,取出中试管冷却结晶,过滤,洗涤。该实验操作过程需要的玻璃仪器有__________。 (2)若对调B和C装置的位置,__________(填“能”或“不能”)提高B中氯酸钾的产率。 实验二 氯酸钾与碘化钾反应的研究 (3)在不同条件下可将KI氧化为或。该小组设计了系列a实验研究反应条件对反应产物的影响,其中系列实验的记录表如下(实验在室温下进行): 试管编号 1 2 3 4 0.20 KI/mL 1.0 1.0 1.0 1.0 0.10 0.10 0.10 0.10 6.0 0 3.0 6.0 9.0 蒸馏水/mL 9.0 6.0 3.0 0 实验现象 ①系列a实验的实验目的是__________。 15 ②设计1号试管实验的作用是__________。 ③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为__________。 实验三 测定饱和氯水中氯元素的总量 (4)该小组设计的实验方案为:使用如图装置,加热15.0mL饱和氯水试样,测定产生气体的体积,此方案不可行的主要原因是__________。(不考虑实验装置及操作失误导致不可行的原因) (5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):__________。 资料:ⅰ.次氯酸会破坏酸碱指示剂; ⅱ.次氯酸或氯气可被、和等物质还原成。 7、某小组在验证反应“”的实验中检测到发现和探究过程如下。向硝酸酸化的0.05硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色间体,溶液呈黄色。 (1)检验产物 ①取出少量黑色固体,洗涤后,______________________________(填操作和现象),证明黑色固体中含有Ag。 ②取上层清液,滴加溶液,产生蓝色沉淀,说明溶液中含有_________________。 (2)针对"溶液呈黄色",甲认为溶液中有,乙认为铁粉过量时不可能有,乙依据的原理是____________________________________(用离子方程式表示),针对两种观点继续实验: ①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下: 序号 取样时间/min 现象 15 i 3 产生大量白色沉淀;溶液呈红色 ii 30 产生白色沉淀,较3min时量少;溶液红色较3min时加深 iii 120 产生白色沉淀,较30min时量少;溶液红色较30min时变浅 (资料:与生成白色沉淀AgSCN) ②对产生的原因作出如下假设: 假设a:可能是铁粉表面有氧化层,能产生; 假设b:空气中存在,由于____________________________(用离子方程式表示),可产生; 假设c:酸性溶液中的;具有氧化性,可产生; 假设d:根据_______________________________现象,判断溶液中存在,可产生。 ③下述实验I可证实假设a、b、c不是产生的主要原因,实验II可证实假设d成立 实验I:向硝酸酸化的__________溶液(pH≈2)中加入过量铁粉,搅拌后静置不同时间取上层清液滴加KSCN溶液。3min时溶液呈浅红色,30min后溶液几乎无色 实验II:装置如下图。其中甲溶液是_______________________,操作及现象是___________________________。 (3)根据实验现象,结合方程式推测实验i~iii中浓度变化的原因:________________________________________。 答案以及解析 1答案及解析: 答案:1.坩埚和泥三角; 2.NaOH溶液; 浓硫酸; 3.①G→D→E→D→F→H ②5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+ ③连接在E后面的D中品红溶液不褪色,F中的澄清石高温灰水变浑浊 15 ④CaSO4+COCaO+SO2+CO2 4.CaSO4+4COCaS+4CO2 解析:1.甲组同学利用CaSO4·2H2O在400~500℃脱水制取无水CaSO4所用到的坩埚、泥三角都属于硅酸盐质的仪器 2.H2C2O4·2H2O在浓硫酸作用下脱水生成CO、CO2,要制得纯净的CO气体,必须先除去CO2和水,由实验装置知B除去CO2,C除去水,所以B中加NaOH溶液,C中加浓硫酸 3.无水CaSO4和CO反应会产生SO2和CO2检验SO2和CO2的顺序为检验SO2→除去SO2→验证SO2是否除净→检验CO2 ①装置的连接顺序为:C→G→D→E→D→F→H 4.由题意可知产生的少量气体时H2S,则固体物质中含有硫化物,故CO与CaSO4在高温下发生的副反应为CaSO4+4COCaS+4CO2 2答案及解析: 答案:1.左;2H2O-4e-=O2↑+4H+,2+2H+=+H2O 2.增大表面积,提高反应速率,使反应更充分;a;4、8、7、8、2、8CO2; Na2CO3+ SiO2Na2SiO3+CO2↑ 3.A1(OH)3;H2SiO3; 4.Na2SO4;с 5.①当滴入最后一滴标准液时,溶液由蓝色变为无色,且半分钟内不复原 ②93.57%;③偏高 解析:1.由图可知,与电源负极相连的左端为电解池的阴极,电极反应式为2H2O+2e-=H2↑+ 2OH-,右端为阳极,电极反应式为2H2O-4e-=O2+4H+,2+2H+=+H2O; 2.方案1中将铬铁矿充分粉碎,可以增大固体的表面积,增大表面积,提高反应速率,使反应更充分;如在实验室中将铬铁矿和碳酸钠固体混合物灼烧,因陶瓷中二氧化硅与碳酸钠固体高温反应,所以实验仪器为铁坩埚、三脚架、泥三角,不需要陶瓷增场;反应②中,FeO•Cr2O3中铬元素被氧气氧化生成Na2CrO4,配平的化学方程式为4FeO•Cr2O3+8Na2CO3+7O28Na2CrO4+2Fe2O3+8CO2;反应中二氧化硅杂质也与碳酸钠高温下反应生成硅酸钠和二氧化碳,反高温应的化学方程式为Na2CO3+ SiO2Na2SiO3+ 15 CO2↑; 3.向含有溶于水的Na2CrO4、NaAlO2,Na2SiO3的滤液中通入反应生成的二氧化碳气体调节溶液pH,NaAlO2、Na2SiO3与二氧化碳溶液生成硅酸沉淀和氢氧化铝沉淀,过滤得到含有Na2CrO4的母液和含有硅酸沉淀和氢氧化铝沉淀的滤渣Y; 4.向母液中加入浓硫酸,Na2Cr2O7与浓硫酸反应生成重铬酸钠和硫酸钠,将混合溶液蒸发浓缩、冷却结晶除去硫酸钠得到Na2Cr2O7晶体;为除去晶体表面的可溶性杂质,洗涤该晶体的溶剂最好是75%乙醇溶液; 5.①向Na2Cr2O7溶液中加入过量KI溶液发生如下氧化还原反应,反应的离子方程式为+6I-+14H+=2Cr3++3I2+7H2O,向反应后的溶液中加入淀粉溶液,溶液变为蓝色,再加入Na2S2O3标准溶液,发生反应I2+2=2I-+,溶液蓝色褪去,所以终点实验现象为当滴入最后一滴标准液时,溶液由蓝色变为无色,且半分钟内不复原;②有反应方程式可得如下关系:-3I2-6,反应消耗n()为0.100 0 mol/L ×0.030 0 L=0.003 mol,则n()为0.003 mol/6=0.000 5 mol,则Na2Cr2O7的纯度为(0.000 5 mol×262 g/mol)/0.140 g× 100%≈93.57%;③若滴定管在滴定前俯视读数,滴定结束后仰视读数,消耗Na2S2O3标准溶液体积偏大,则所测结果偏高。 3答案及解析: 答案:1.三颈烧瓶; 2.使水充满冷凝管,从而使挥发出的气体得到充分冷却、回流; 3.MnO4;减少对氯苯甲酸钾的损失;降低对氯苯甲酸中杂质的含量,减少对氯苯甲酸的溶解损失; 4.ad;5.出现白色沉淀;6.6.59g 解析:1.由仪器A的结构特点为三口圆底,可知其名称为三颈烧瓶。 2.从冷凝管的下口进水,可使水慢慢充满冷凝管,从而使装置A中挥发出的气体得到充分冷却、回流,减少反应物及生成物的挥发损失。 3.由题给反应可知,高锰酸钾被还原为MnO2,故第一次过滤的滤渣为MnO2;滤渣附着有对氯苯甲酸钾。由表格中的信息知,酸钾的溶解度随着温度的升高而增大,故用可减少其损失;第二次过滤的滤渣为对氯苯我们的实验目标产物,使用冷水洗涤的目的对氯苯甲酸中的杂质,同时还可以减少对氯溶解损耗。 15 4.过滤和洗涤操作中均需要使玻璃棒,不需要使用分液漏斗和锥形瓶。 5.表格中的信息,可知对氯苯甲酸微溶于水,中加入硫酸后,会出现白色沉淀。 6.根据转化关系: 对氯甲苯 —— 对氯苯甲酸 126.5 156.5 6.00 mL×1.07 g/cm3 x/0.83 x=6.59 g 4答案及解析: 答案:1. 2.①恒压滴液漏斗(滴液漏斗) ②水浴加热 ③降低叠氮化钠的溶解度,防止产物损失 3.65%;AC 4. 解析:1.根据元素组成以及酯化反应特点,有水分子生成,无机酸与醇的酯化反应应生成亚硝酸酯与水。 2.②加热温度低于100℃,所以用水浴加热。③叠氮化钠易溶于水,微溶于乙醇,低温下溶解度降低,用乙醇洗涤溶质损失更少。 3.总计为0.10mol·L-1×0.04L=0.004mol,分别与和反应。其中与按1∶1反应消耗0.10mol·L-1×0.02L=0.002mol,则与N按1∶1反应也为0.002mol,即10mL所取溶液中有0.002mol。原2.0g叠氮化钠试样,配成100mL溶液中有0.02mol即1.3g NaN3,所以样品质量分数为65%。 误差分析:A选项,使用叠氮化钠溶液润洗锥形瓶,使进入锥形瓶中溶质比所取溶液更多,滴定消耗的硫酸亚铁铵标准液体积减小,叠氮化钠溶液浓度偏大;B选项,六硝酸铈铵溶液实际取量大于40.00mL,滴定消耗的硫酸亚铁铵标准液体积增大,计算叠氮化钠溶液浓度偏小;C选项,滴定前无气泡,终点时出现气泡,则读数体积为实际溶液体积减气泡体积,硫酸亚铁铵标准液读数体积减小,叠氮化钠溶液浓度偏大;D选项,无影响。 5答案及解析: 答案:1.蒸馏烧瓶;CD 15 2.Na2S2O3在酸性环境中不能稳定存在。+2H+=S↓+SO2+H2O 3.趁热过滤;乙醇; 4.温度过高会导致析出的晶体分解 5.溶液恰好由无色变为浅红色,半分钟内不褪色;96.9% 解析:1.根据图示装置可知,仪器2的名称为蒸馏烧瓶6是尾气吸收装置,主要吸收SO2污染性气体,选项中酸性KMnO4溶液具有氧化性,能氧化SO2生成H2SO4而吸收;NaOH溶液和SO2反应生成Na2SO3和水,也能吸收SO2,而浓硫酸、氯化银与SO2都不反应,不能吸收SO2,故选项C、D合理; 2.当溶液pH<7时,溶液显示酸性,会发生反应: +2H+=S↓+SO2+H2O,所以Na2S2O3在酸性环境中不能稳定存在,溶液的pH应不小于7; 3.常温下溶液中祈出晶体为Na2S2O3•5H2O,Na2S2O3•5H2O于40~45 ℃熔化,为了避免析出Na2S2O3•5H2O导致产率降低,所以操作①过滤出活性炭时需要趁热;洗涤晶体时为减少晶体损失,减少Na2S2O3•5H2O的溶解,依据Na2S2O3易溶于水,不溶于乙醇的性质选择乙醇洗涤,且洗涤后乙醇易辉发,不引入新的杂质; 4.由于Na2S2O3•5H2O于40~45℃熔化,48℃分解,所以蒸发时温度过高会导致析出的晶体分解,降低了产率; 5.①依据标定的原理可知,反应结束前溶液为无色,反应结束后溶液中高锰酸根离子过量,溶液变为浅红色,所以滴定终点的现象为:溶液由无色变为浅红色,半分钟内不褪色; ②20.00 mL 0.40 mol/L KMnO4溶液中含有高锰酸钾的物质的量为:n(KMnO4)=0.40 mol/L×0.02 L=0.008 mol,根据反应5 +8+14H+=8Mn2++10+7H2O可知,1.28g的粗样品含有Na2S2O3•5H2O的物质的量为:n(Na2S2O3•5H2O)=n()=5/8×n(KMnO4)=0.005 mol,产品中Na2S2O3•5H2O的质量分数为:(248 g/mol×0,005 mol)/1.28 g=96.9%。 6答案及解析: 答案:(1)烧杯、漏斗、玻璃棒、胶头滴管(不填“胶头滴管”也可); (2)能 (3)①研究反应体系中硫酸浓度对反应产物的影响 ②硫酸浓度为0的对照实验 ③ 15 (4)因存在的重新溶解、HClO分解等,此方案无法测算试样含氯总量(或其他合理答案); (5)量取一定量的试样,加入足量的溶液,加热除去过量的,冷却,再加入足量的硝酸银溶液,经过滤、洗涤、干燥后称量沉淀质量(或其他合理答案) 解析:(2)若对调B、C位置,中的HCl气体杂质因溶于C中的水而被除去,B中与反应的KOH的量增加,故能提高B中的产率。 (3)①仔细观察实验记录表可知,4个实验中、KI的浓度均相同,只有的浓度不同,实验的目的显然是研究硫酸浓度对反应产物的影响。 ②1号试管中的浓度为0,该实验的作用是硫酸浓度为0的对照实验。 ③根据淀粉溶液显蓝色知氧化产物为,该反应的离子方程式为。 (4)氯水中氯元素以、HClO、和等形式存在,加热时HClO分解产生,部分因受热逸出,因此只能测出及逸出的的量,溶液中、及残余的量无法测定,故此方案不可行。 (5)依题给信息,欲测定氯水中氯元素的总量,可量取一定体积的氯水,加入足量的溶液,将氯水中的、HClO、全部还原成,加热除去过量的,冷却,再加入足量溶液,经过滤、洗涤、干燥、称量测出生成AgCl沉淀的质量,即可计算出饱和氯水中氯元素的总量。 7答案及解析: 答案:(1)①加硝酸加热溶解固体,再滴加稀盐酸,产生白色沉淀 ② (2) ②;加入KSCN溶液后产生白色沉淀 ③0.05溶液 15 分别取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,后者红色更深 (3)溶液中存在反应:① ② ③;反应开始时,大,以反应①、②为主,增大。约30min后,小,以反应③为主,减小 解析:(1)①烧杯底部的黑色固体中含有银和过量的铁,要证明Ag的存在,可加硝酸并加热将固体溶解,然后用盐酸来检验的存在。 (2)③要证实假设a、b、c不是产生的主要原因,需将原实验中的溶液换成分别相同,但不含的溶液,可选硝酸酸化的0.05,溶液(pH≈2),通过向上层清液中滴加KSCN溶液后的现象差异进行验证。实验II中甲溶液是溶液,电极反应为:负极,正极,—段时间后检验的存在及浓度,即可得出能将氧化成的结论 3.解题时要注意实验过程中过量的铁始终是存在的。 15查看更多