- 2021-04-29 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
红岭中学2017-2018学年度第二学期第二学段考试高二化学试卷
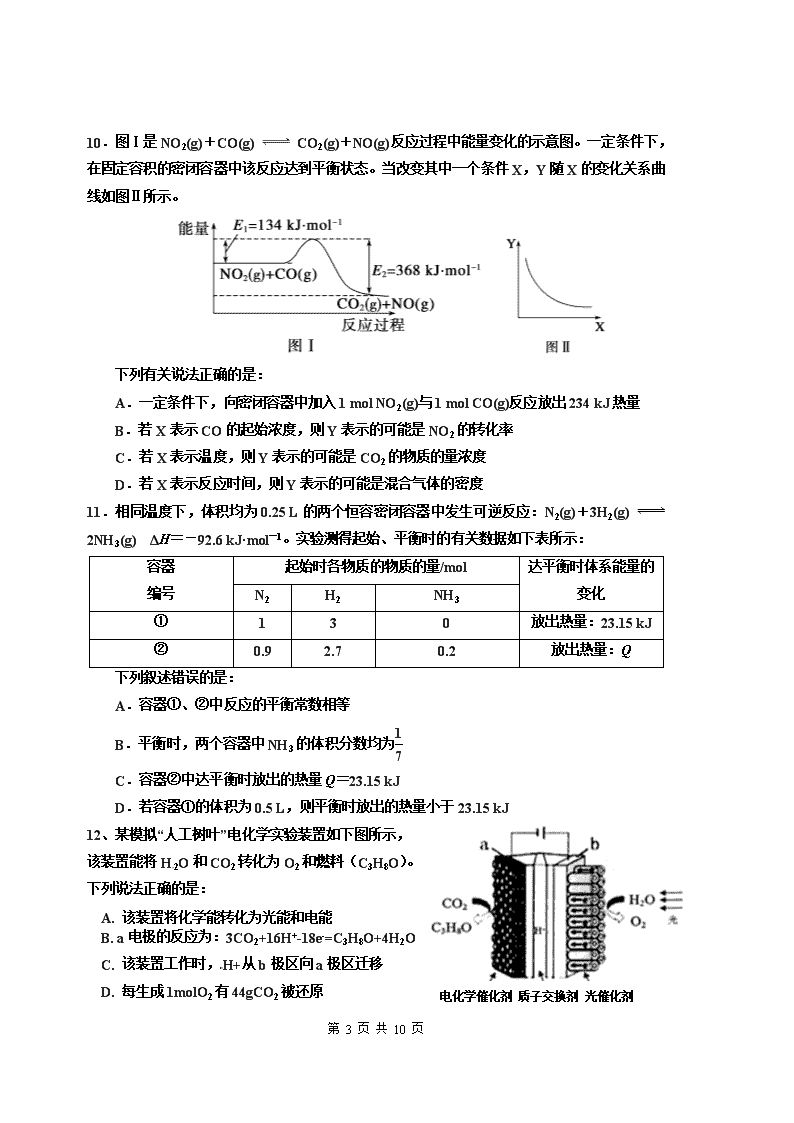
红岭中学2017-2018学年度第二学期第二学段考试高二化学试卷 (说明:本试卷考试时间为90分钟,满分为100分) 可能用到的原子量:H-1 Na-23 O-16 S-32 Al-27 Cu-64 一 、选择题(本大题共20小题,每题3分,共60分,每小题的4个选项中仅有一个选项是正确的,请将你认为正确的答案的代号涂在答题卡上) 1、用NA表示阿伏加德罗常数的值。下列叙述不正确的是: A、2.7 g 金属铝分别与足量的NaOH溶液和盐酸反应转移的电子数目均为0.3NA B、标准状况下,2.24 L Cl2与过量NaOH溶液反应,转移的电子总数为0.1 NA C、1L 1 mol•L-1 Na2CO3溶液中阴离子数小于NA D、2.3 g金属钠完全反应生成Na2O与Na2O2的混合物中阴离子数为0.05 NA 2、对于0.1 mol•L-1 Na2CO3溶液,下列说法中,不正确的是: A、溶液中水的电离程度大于纯水中水的电离程度 B、升高温度,溶液的pH值也升高 C、加入少量NaOH固体,c(CO32―)与c(Na+)均增大 D、离子浓度关系:c (Na+) + c (H+) = c (CO32―) + c (HCO3―) + c (OH―) 3、等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是: A.2mol·L-1H2SO4溶液 B.18 mol·L-1H2SO4溶液 C.6 mol·L-1KOH溶液 D.3 mol·L-1HNO3溶液 4、一种新型乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍。电池总反应为: C2H5OH +3O2= 2CO2 +3H2O,电池示意图如右下图。 下面对这种电池的说法正确的是: A.标准状况下,通入5.6LO2并完全反应后, 有0.5mol电子转移 B.电池工作时电子由b极沿导线经灯泡再到a极 C.电池正极的电极反应为:4H+ +O2 +4e- =2H2O D.b极为电池的负极 第 10 页 共 10 页 5、在298K、100kPa时,已知:2 ⊿ ⊿ ⊿ 则⊿与⊿和⊿间的关系正确的是: A 、⊿=⊿+2⊿ B、⊿=⊿+⊿ C、 ⊿=⊿-2⊿ D、⊿=⊿- ⊿ 6、100℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。下列叙述中不正确的是: A、此时水的离子积Kw=1×10-14 B、水电离出的c(H+)=1×10-10mol•L-1 C、水的电离程度随温度升高而增大 D、 c(Na+)=c(SO42-) 7、常温下,向20 mL x mol·L-1 CH3COOH溶液中逐滴加入等物质的量浓度的NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如右图所示(忽略温度变化)。下列说法中不正确的是: A.上述 CH3COOH溶液中:c(H+)=1×10-3 mol·L-1 B.图中V1 <20 mL C.a点对应的溶液中:c (CH3COO-)=c (Na+) D.当加入NaOH溶液的体积为20 mL时,溶液中:c (CH3COOH) + c (H+)>c (OH-) 8、常温下,下列叙述正确的是: A、pH=a的氨水,稀释10倍后,其pH=b,则a=b+1 B、在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液的pH< 7 C、向10 mL 0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中, 将减小 D、向10mL pH=11的氨水中,加入10mL pH=3的H2SO4溶液,混合液pH=7 9. 常温下,下列离子浓度关系或结论正确的是: A. 将0.1 mol/L 氨水与0. 1 mol/L稀盐酸等体积混合 C(Cl-)>c(NH4+)>c(H+)>c(OH-) B. 将PH= 2的稀盐酸与PH =12的氨水等体积混合,所得溶液PH<7 C. 在PH=1的溶液中:K+,Fe2+、Cl-,NO3-,Na+等离子能够大量共存 D. 用惰性电极电解稀硫酸时,实质上就是电解水,所以溶液的PH不变 第 10 页 共 10 页 10.图Ⅰ是NO2(g)+CO(g) CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。 下列有关说法正确的是: A.一定条件下,向密闭容器中加入1 mol NO2(g)与1 mol CO(g)反应放出234 kJ热量 B.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率 C.若X表示温度,则Y表示的可能是CO2的物质的量浓度 D.若X表示反应时间,则Y表示的可能是混合气体的密度 11.相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表所示: 容器 编号 起始时各物质的物质的量/mol 达平衡时体系能量的变化 N2 H2 NH3 ① 1 3 0 放出热量:23.15 kJ ② 0.9 2.7 0.2 放出热量:Q 下列叙述错误的是: A.容器①、②中反应的平衡常数相等 B.平衡时,两个容器中NH3的体积分数均为 C.容器②中达平衡时放出的热量Q=23.15 kJ 电化学催化剂 质子交换剂 光催化剂 D.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ 12、某模拟“人工树叶”电化学实验装置如下图所示, 该装置能将H2O和CO2转化为O2和燃料(C3H8O)。 下列说法正确的是: A. 该装置将化学能转化为光能和电能 B. a电极的反应为:3CO2+16H+-18e-=C3H8O+4H2O C. 该装置工作时,H+从b极区向a极区迁移 D. 每生成1molO2有44gCO2被还原 第 10 页 共 10 页 13.反应H2(g)+I2(g) 2HI(g)的平衡常数为K1;反应HI(g) 1/2H2(g)+1/2I2(g)的平衡常数为K2,则K1、K2的关系为(平衡常数为同温度下的测定值): A.K1=2K2 B.K1=K C.K1=1/K D.K1=1/2K2 14.工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为CH2===CH2(g)+H2O(g) CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是: A.合成乙醇的反应一定为吸热反应 B.目前工业上采用250~300 ℃,主要是因为在此温度下乙烯的转化率最大 C.目前工业上采用加压条件(7 MPa左右),目的是提高乙醇的产率和加快反应速率 D.相同催化剂下,在300 ℃ 14.70 MPa乙醇产率反而比300 ℃ 7.85 MPa低得多,是因为加压平衡向逆反应方向移动 15.在一定温度下,下列叙述不是可逆反应A(g)+3B(g) 2C(g)达到平衡的标志的是: ①C的生成速率与C的分解速率相等;②单位时间内有a mol A生成的同时生成3a mol B;③A、B、C的浓度不再变化;④容积不变的密闭容器中混合气体的总压强不再变化;⑤混合气体的物质的量不再变化;⑥单位时间消耗a mol A,同时生成3a mol B;⑦A、B、C的分子数目之比为1∶3∶2。 A.②⑤ B.①③ C.②⑦ D.⑤⑥ 16、已知:25 C 时,Ksp[Zn(OH)2]= 1.0×10-18, Ka(HCOOH)= 1.0×10-4。该温度下,下列说法错误的是: A、HCOO-的水解平衡常数为 1.0×10-10 B、向 Zn(OH)2 悬浊液中加少量 HCOOH,溶液中 c(Zn2+)增大 C、Zn(OH)2溶于水形成的饱和溶液中,c(Zn2+)>1.0×10-6 mol/L D、Zn(OH)2(s) +2HCOOH(aq)Zn2+(aq) +2HCOO-(aq) +2H2O(l)的平衡常数 K= 100 第 10 页 共 10 页 17、下列溶液中有关物质的量浓度关系不正确的是: A.10℃时pH=12的NaOH溶液与40℃时pH=12的NaOH溶液中:c(H+)相等 B.25℃时pH=10的NaOH溶液与pH=10的氨水中: c(Na+)=c(NH4+) C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合: c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) D.0.1mol·L-1(NH4)2Fe(SO4)2溶液中: c(NH4+)+ c(NH3·H2O) + c(Fe2+)=0.3 mol·L-1 C(H+)/mol·L-1 · · a C(OH-)/mol·L-1 · b c d 10-6 10-7 10-6 · 10-7 18、水的电离平衡曲线如下图所示。下列说法正确的是 A.图中对应点的温度关系为: a>b B.水的电离常数KW数值大小关系为:b>d C.温度不变,加入少量NaOH可使溶液从c点变到a点 D.在b点对应温度下,将pH=2的H2SO4与pH=10的 NaOH溶液等体积混合后,溶液显酸性 19、下列有关物质的量浓度关系中,不正确的是: A.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合: c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) B.浓度相同的下列溶液: ①(NH4) 2 Fe(SO4)2 ②(NH4) 2 CO3 ③(NH4) 2SO4 , NH4+浓度由大到小的顺序是:①>③>② C.浓度均为0.1 mol·L-1CH3COONa、NaHCO3、 -ONa溶液中: 若c(OH-)分别为c1、c2、c3,则c3>c2>c1 D.NaHCO3溶液中:c(Na+)=c(H2CO3)+c(HCO3-)+2c(CO32-) 20、高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为: 下列叙述错误的是: A、放电时正极附近溶液的碱性增强 B、充电时锌极与外电源正极相连 C、放电时每转移3 mol电子,正极有1mol K2FeO4被还原 D、充电时阳极反应为:Fe(OH)3 - 3e- + 5OH- = FeO42- + 4 H2O 第 10 页 共 10 页 二、填空计算题:(40分,共3题) 21、(12分)复分解反应是中学化学中常见的一种反应类型。 (1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH值: 溶质 CH3COONa NaHCO3 Na2CO3 NaClO NaCN C6H5ONa pH 8.8 9.7 11.6 10.3 11.1 11.3 复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3 = 2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是___________(填编号)。 A.CO2+H2O +2NaClO = Na2CO3+2HClO B.CO2+H2O +NaClO = NaHCO3+HClO C.CO2 +H2O +C6H5ONaNaHCO3+C6H5OH D.CO2 +H2O +2C6H5ONaNa2CO3+2C6H5OH E.Na2CO3+C6H5OHNaHCO3+C6H5ONa F.CH3COOH+NaCN = CH3COONa+HCN (2)根据前述信息判断,常温下,浓度均为0.05 mol·L-1的下列5种物质的溶液中, pH最小的是 (填编号),其pH值为_______(填数值);pH最大的是 (填编号)。 ①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4 (3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应: ①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液 ②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体 请根据上述反应,总结出复分解反应发生的另一规律: 。 (4)根据(3)中结论,现将KI溶液和AgCl固体混合搅拌,则可能会观察到的现象是 ,反应的离子方程式为 。 第 10 页 共 10 页 22. (12分)苯乙烷( -C2H5)可生产塑料单体苯乙烯( -CH=CH2),其原理反应是: -C2H5(g) -CH=CH2(g) + H2(g);△H = +125 kJ·mol-1。某温度下,将0.40 mol -C2H5(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表: 时间/min 0 10 20 30 40 n( -C2H5)/mol 0.40 0.30 0.26 n2 n3 n( -CH=CH2)/mol 0.00 0.10 n1 0.16 0.16 (1)n1= mol,计算该反应的平衡常数,K= 。 图22-1 0 4 8 12 16 40 60 80 202kPa(900K) 101kPa(900K) -C2H5平衡转化率/% n(H2O) n( -C2H5) (2)工业上常以高温水蒸气作为反应体系的稀释剂(不参与反应)。 -C2H5(g)的平衡转化率与水蒸气的用量、体系总压强的 关系如图22-1所示。当其它条件不 变时,水蒸气的用量越大,平衡转化 率将 (填“越大”、“越小” 或“不变”),原因是 。 (3)副产物H2用做氢氧燃料电池。写出酸 性条件下,该电池正极的电极反应式 。 (4)在相同条件下,若最初向该容器中充入 -CH=CH2(g)和H2(g),假设在40 min时达到上述同样的平衡状态,请在图22-2中画出并标明该条件下 -C2H5(g) t/min c/mol·L-1 0.04 0.08 0.12 0.16 0.20 0.24 10 20 30 40 图22-2 0 和 -CH=CH2(g)的浓度c随时间t变化的曲线。 第 10 页 共 10 页 23、(16分) Na2SO3是一种重要的还原剂,I2O5是一种重要的氧化剂,二者都是化学实验室中的重要试剂。 (1)已知:2Na2SO3 (aq)+O2(aq)==2Na2SO4(aq) △H =m kJ·mol-1,O2(g)O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为_______________________。 (2)Na2SO3的氧化分富氧区和贫氧区两个阶段,贫氧区速率方程为v=k·ca(SO32-)·cb(O2),k为常数。 ①当溶解氧浓度为4.0 mg/L(此时Na2SO3的氧化位于贫氧区)时,c(SO32-)与速率数值关系如下表所示,则a=_______。 c(SO32-)×103 3.65 5.65 7.65 11.65 V×106 10.2 24.4 44.7 103.6 ②两个阶段的速率方程和不同温度的速率常数之比如下表所示。已知1n(k2/k1)=(Ea/R)(1/T2-1/T1),R 为常数,则Ea(富氧区)______(填“>”或“<”)Ea(贫氧区)。 反应阶段 速率方程 k(297.0K)/k(291.5K) 富氧区 v= k·c(SO32-)·c(O2) 1.47 贫氧区 v= k·ca(SO32-)·cb(O2) 2.59 (3)等物质的量的Na2SO3和Na2SO4混合溶液中,c(SO32-) +c( HSO3-)______(填“>”“<”或“=”)c(SO42-)。 (4)利用I2O5可消除CO 污染,其反应为I2O5(s)+5CO(g) 5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。 ①从反应开始至a点时的平均反应速率v(CO)=__________。 ②b点时,CO 的转化率为_____________。 第 10 页 共 10 页 ③b点 和 d点 的 化学 平衡常数:Kb____(填“ >”“<”或“=” )Kd,判断的理由是_________。 高二化学期末考试答案 一、选择题:(共60分,每个3分) 题号 1 2 3 4 5 6 7 8 9 10 答案 C D A C A A D C A C 题号 11 12 13 14 15 16 17 18 19 20 答案 C C C C C C D B D B 二、填空计算题:(共40分) 21.(12分) (1)A、D(2分) (2)⑤(1分),1(2分); ①(1分) (3)复分解反应能够向生成更难溶或溶解度更小的物质的方向进行。(2分) (4)白色固体变成黄色(2分) I-+AgCl = AgI+Cl- (2分) 22、(12分)有效数字错误或无单位扣1分 (1)0.14 (2分); 0.053 mol·L-1(2分)如果写成0.05或0.0533,均扣1分,写分数4/75,也给分,但是建议不写分数。 (2)越大(2分),体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动(2分)。或者:水蒸汽的用量增大,体系内各物质的浓度商QC小于平衡常数KC,所以平衡将向右移动,使苯乙烷的转化率增大。如果以“水蒸汽多时,会稀释反应体系的物质浓度,导致平衡向右移动”也给分。用“热量变化解释”错误,不得分。 (3)O2+ 4H+ + 4e- = 2H2O (2分) t/min c/mol·L-1 0.04 0.08 0.12 0.16 0.20 0.24 10 20 30 40 图22-2 · · 0 -C2H5 -CH=CH2 (4)(2分)只要苯乙烯曲线变化趋势在减小,弓向时间轴,且起点(0,0.20)、终点在(40,0.08);苯乙烷曲线变化趋势在增大,弓向浓度轴,且起点(0,0)、终点(40,0.12),即可得满分] 上述作线图中(1)曲线画成直线,0分(2)40点后,没有画出直线,扣1分(3)平衡点放在30点处,与已知条件不吻合,0分(4)终点平衡浓度错误,不是0.08及0.12,0分(5)两条线没有注明对应物质,扣1分。 第 10 页 共 10 页 23、(16分) (1)2Na2SO3(aq)+O2(g)=2Na2SO4(aq) ΔH=(m+n)kJ/mol (2)2 > (代公式,纯数学运算) (3) < (4)0.6 mol/(L·min) 80% > 其他条件相同时,曲线II 先达到平衡,温度高于曲线I的,说明温度升高CO2的产率降低,平衡向逆反应方向移动,平衡常数减小。 (每空2分) 第 10 页 共 10 页查看更多