- 2021-04-27 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习苏教版原子结构与元素性质学案
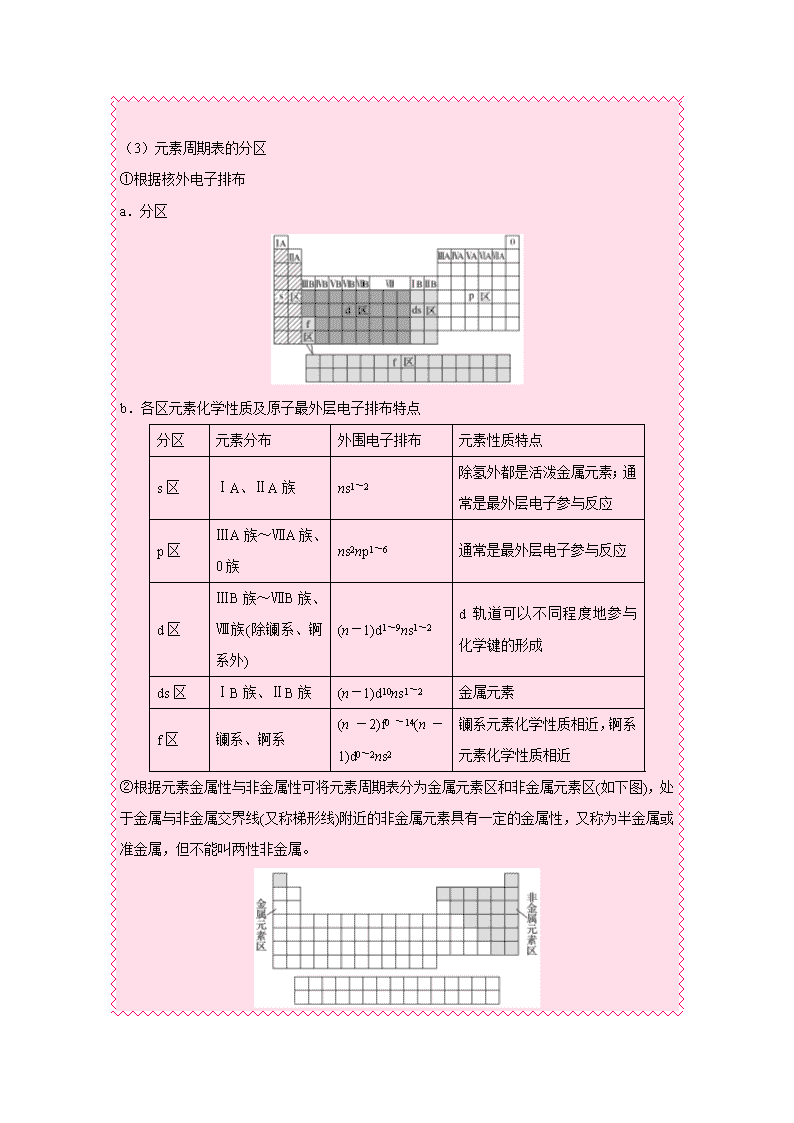
1.原子结构与周期表的关系 (1)完成下列表格 周期 能层数 每周期第一种元素 每周期最后一种元素 原子序数 基态原子的简化电子排布式 原子序数 基态原子的电子排布式 二 2 3 He]2s1 10 1s22s22p6 三 3 11 Ne]3s1 18 1s22s22p63s23p6 四 4 19 Ar]4s1 36 1s22s22p63s23p63d10 4s24p6 五 5 37 Kr]5s1 54 1s22s22p63s23p63d104s24p6 4d105s25p6 六 6 55 Xe]6s1 86 1s22s22p63s23p63d104s24p6 4d104f145s25p65d106s26p6 (2)每族元素的价电子排布特点 ①主族 主族 ⅠA ⅡA ⅢA ⅣA 排布特点 ns1 ns2 ns2np1 ns2np2 主族 ⅤA ⅥA ⅦA 排布特点 ns2np3 ns2np4 ns2np5 ②0族:He:1s2;其他ns2np6。 ③过渡元素(副族和第Ⅷ族,Pd除外):(n-1)d1~10ns1~2。 (3)元素周期表的分区 ①根据核外电子排布 a.分区 b.各区元素化学性质及原子最外层电子排布特点 分区 元素分布 外围电子排布 元素性质特点 s区 ⅠA、ⅡA族 ns1~2 除氢外都是活泼金属元素;通常是最外层电子参与反应 p区 ⅢA族~ⅦA族、0族 ns2np1~6 通常是最外层电子参与反应 d区 ⅢB族~ⅦB族、Ⅷ族(除镧系、锕系外) (n-1)d1~9ns1~2 d轨道可以不同程度地参与化学键的形成 ds区 ⅠB族、ⅡB族 (n-1)d10ns1~2 金属元素 f区 镧系、锕系 (n-2)f0~14(n-1)d0~2ns2 镧系元素化学性质相近,锕系元素化学性质相近 ②根据元素金属性与非金属性可将元素周期表分为金属元素区和非金属元素区(如下图),处于金属与非金属交界线(又称梯形线)附近的非金属元素具有一定的金属性,又称为半金属或准金属,但不能叫两性非金属。 注意:“外围电子排布”即“价电子层”,对于主族元素,价电子层就是最外电子层,而对于过渡元素原子不仅仅是最外电子层,如Fe的价电子层排布为3d64s2。 2.对角线规则 在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的,如。 3.元素周期律 (1)原子半径 ①影响因素 ②变化规律 元素周期表中的同周期主族元素从左到右,原子半径逐渐减小;同主族元素从上到下,原子半径逐渐增大。 (2)电离能 ①第一电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,符号:I1,单位:kJ·mo1-1。 ②规律 a.同周期:第一种元素的第一电离能最小,最后一种元素的第一电离能最大,总体呈现从左至右逐渐增大的变化趋势。 b.同族元素:从上至下第一电离能逐渐减小。 c.同种原子:逐级电离能越来越大(即I1查看更多