- 2021-04-22 发布 |
- 37.5 KB |
- 42页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习化学能与热能学案
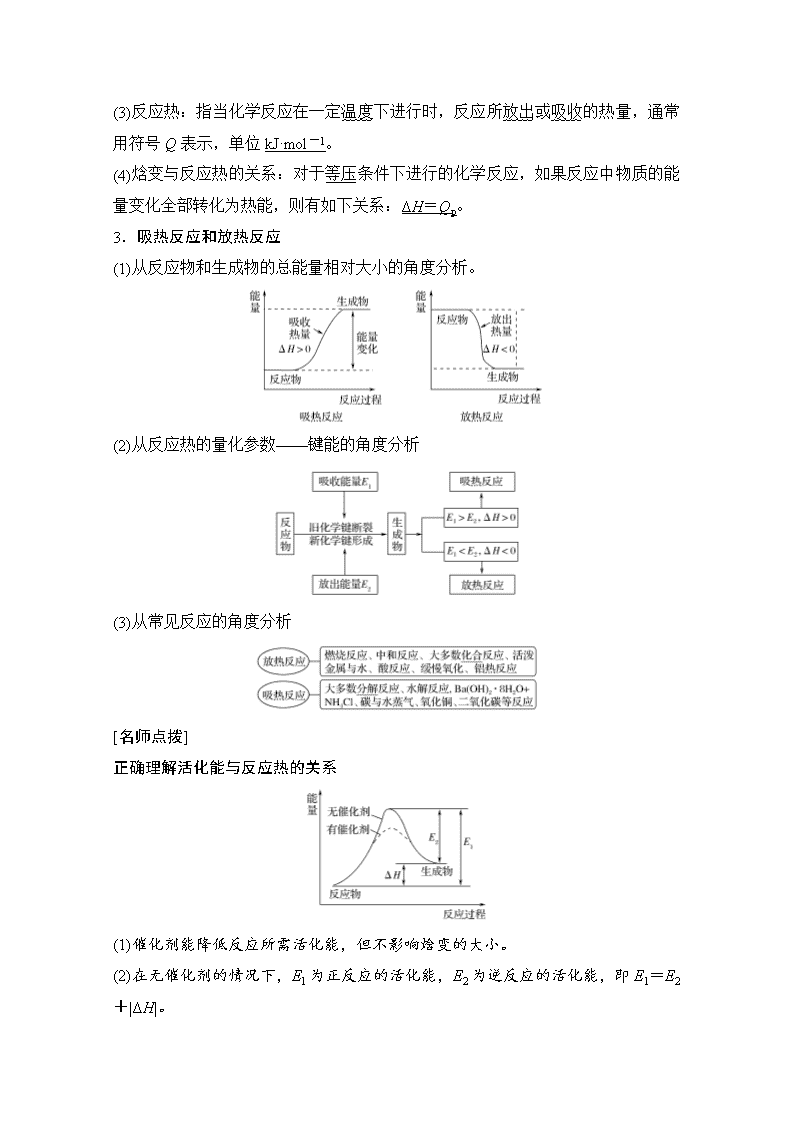
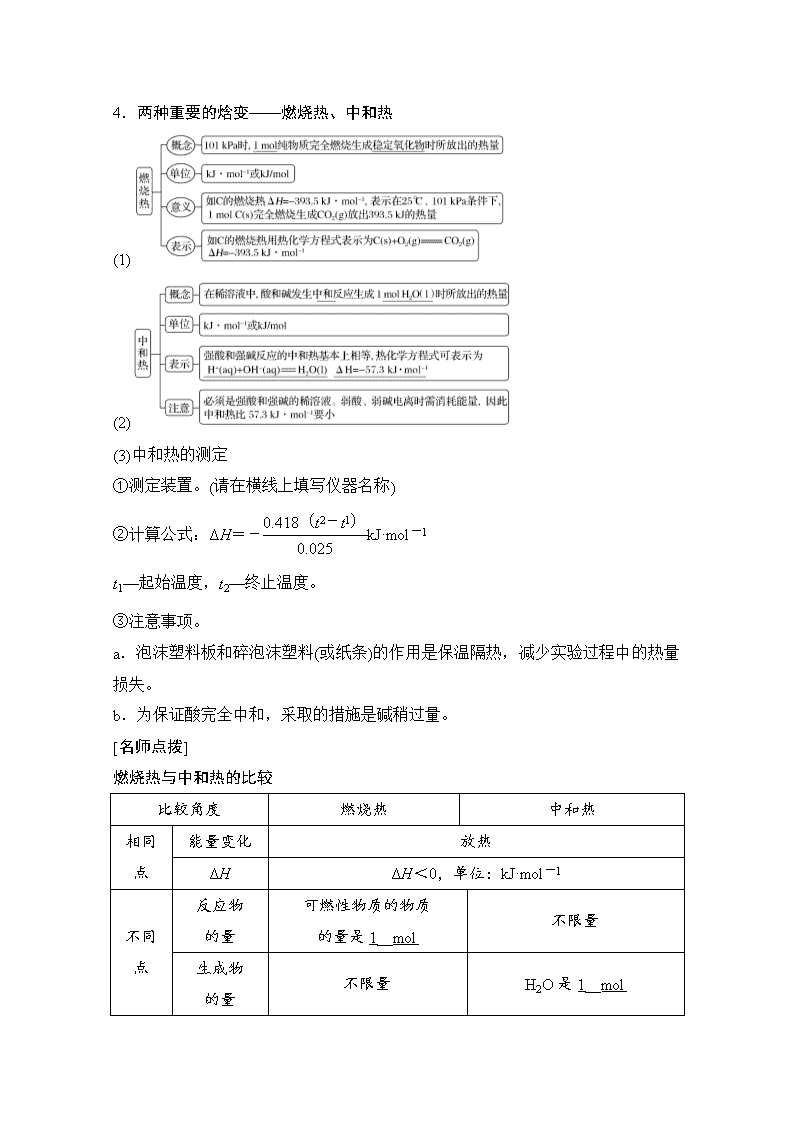
第 1 讲 化学能与热能 教学指导意见 核心素养 1.了解常见的能量转化形式,能解释化 学变化中能量转化的本质。 2.了解吸热反应、放热反应、反应热与 焓变(ΔH)的含义。能正确书写热化学方 程式并能进行简单计算。 3.理解盖斯定律,并能运用盖斯定律进 行有关反应焓变的计算。 4.了解能源及化学在解决能源危机中的 重要作用。 1.变化观念与平衡思想:认识化学变化 的本质是有新物质生成,并伴有能量的 转化;能多角度、动态地分析热化学反 应方程式,运用热化学反应原理解决实 际问题。 2.证据推理与模型认知:通过分析、推 理等方法认识研究反应热的本质,建立 盖斯定律模型。 3.科学态度与社会责任:赞赏化学对社 会发展的重大贡献,具有可持续发展意 识和绿色化学观念。 考点一 焓变 热化学方程式 [学在课内] 1.化学反应的实质与特征 2.焓变、反应热 (1)焓(H):用于描述物质所具有能量的物理量。 (2)焓变(ΔH):ΔH=H(生成物)-H(反应物)。单位 kJ·mol-1。 (3)反应热:指当化学反应在一定温度下进行时,反应所放出或吸收的热量,通常 用符号 Q 表示,单位 kJ·mol-1。 (4)焓变与反应热的关系:对于等压条件下进行的化学反应,如果反应中物质的能 量变化全部转化为热能,则有如下关系:ΔH=Qp。 3.吸热反应和放热反应 (1)从反应物和生成物的总能量相对大小的角度分析。 (2)从反应热的量化参数——键能的角度分析 (3)从常见反应的角度分析 [名师点拨] 正确理解活化能与反应热的关系 (1)催化剂能降低反应所需活化能,但不影响焓变的大小。 (2)在无催化剂的情况下,E1 为正反应的活化能,E2 为逆反应的活化能,即 E1=E2 +|ΔH|。 4.两种重要的焓变——燃烧热、中和热 (1) (2) (3)中和热的测定 ①测定装置。(请在横线上填写仪器名称) ②计算公式:ΔH=-0.418(t2-t1) 0.025 kJ·mol-1 t1—起始温度,t2—终止温度。 ③注意事项。 a.泡沫塑料板和碎泡沫塑料(或纸条)的作用是保温隔热,减少实验过程中的热量 损失。 b.为保证酸完全中和,采取的措施是碱稍过量。 [名师点拨] 燃烧热与中和热的比较 比较角度 燃烧热 中和热 能量变化 放热相同 点 ΔH ΔH<0,单位:kJ·mol-1 反应物 的量 可燃性物质的物质 的量是 1__mol 不限量 生成物 的量 不限量 H2O 是 1__mol 不同 点 反应热 1 mol 可燃物完全燃烧生 在稀溶液中,强酸与强碱发生 的含义 成稳定氧化物时放出的热 量;其中 C―→CO2(g) H―→H2O(l) S―→SO2(g)等 中和反应,生成 1 mol H2O(l) 和可溶性盐时放出的热量;不 同反应物的中和热大致相同, 均约为 57.3 kJ·mol-1 5.能源 (1)概念:能提供能量的资源 (2)分类 [考在课外] 教材延伸 判断正误 (1)放热反应中,生成物的总能量高于反应物的总能量(×) (2)放热反应在任何条件下都可以发生,吸热反应不加热就不能发生(×) (3)C(石墨,s)===C(金刚石,s) ΔH>0,说明石墨比金刚石稳定(√) (4)碳在空气燃烧生成 CO2,该反应中化学能全部转化为热能(×) (5)活化能越大,表明反应断裂旧化学键需要克服的能量越大(√) (6)同温同压下,反应 H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的 ΔH 不同(×) (7)可逆反应的 ΔH 表示完全反应时的热量变化,与反应是否可逆无关(√) (8)反应 2SO2(g)+O 2(g) 2SO3(g) ΔH=-Q kJ·mol - 1(Q>0),则将 2 mol SO2(g)和 1 mol O2(g)置于一密闭容器中充分反应后放出 Q kJ 的热量(×) (9)吸热反应中,反应物化学键断裂吸收的总能量高于生成物形成化学键放出的总 能量(√) (10)释放能量的过程一定是放热反应(×) (11)化石燃料属于可再生能源,对其过度开采不影响可持续发展(×) (12)化石燃料和植物燃料燃烧时放出的能量均来源于太阳能(√) (13)低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排 放(√) (14)已知 H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则 H2SO4 和 Ba(OH)2 反应的反应热 ΔH=2×(-57.3)kJ·mol-1(×) (15)H2(g)的燃烧热是 285.8 kJ·mol -1,则 2H2O(g)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1(×) (16)葡萄糖的燃烧热是 2 800 kJ·mol - 1 ,则 1 2C6H12O6(s)+3O 2(g)===3CO2(g)+ 3H2O(l) ΔH=-1 400 kJ·mol-1(√) (17) 燃 料 电 池 中 将 甲 醇 蒸 气 转 化 为 氢 气 的 热 化 学 方 程 式 是 CH3OH(g) + 1 2 O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol -1,则 CH3OH(g)的燃烧热为 192.9 kJ·mol-1(×) (18)已知稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则稀醋酸 与稀氢氧化钠溶液反应生成 1 mol 水时放出 57.3 kJ 的热量(×) 拓展应用 如图表示某反应的能量变化,按要求回答下列问题: (1)该反应是________(填“放热”或“吸热”)反应。 (2)该反应的 ΔH=________。 (3)使用催化剂________(填“能”或“不能”)影响该反应的反应热。 (4)过程Ⅰ逆反应的活化能可表示为________。 答案 (1)放热 (2)E2-E1 (3)不能 (4)E3-E2 思维探究 (1)化学反应吸热、放热与反应条件的关系是什么? 答案 化学反应吸热、放热与反应条件无必然联系。 如吸热反应 NH4Cl 与 Ba(OH)2·8H2O 在常温常压下即可进行,而很多放热反应需要 在加热的条件下才能进行。 参照 2 题图反应吸热、放热取决于 ΔH=E2-E1,而反应是否需要加热取决于 E3- E1 的大小与环境提供能量的关系,满足则不需要加热,否则需加热。 (2)如何理解可逆反应的 ΔH? 答案 ①可逆反应的 ΔH 与“ 无关”,与反应条件无关。 ②可逆反应中正反应与逆反应的 ΔH 数值相等,符号相反。 ③可逆反应由于反应的可逆性,故不能进行到底,充分反应后对应热量的数值比 理论值小。 [基础点巩固] 1.下列变化过程,属于放热反应的是( ) A.水蒸气变为液态水 B.酸碱中和反应 C.弱酸弱碱电离 D.用 FeCl3 饱和溶液制 Fe(OH)3 胶体 答案 B 2.(2018·滕州月考)下列说法正确的是( ) A.任何化学反应都伴随着能量的变化 B.升高温度或加入催化剂,可以改变化学反应的反应热 C.化学反应中的能量变化都是以热量的形式体现 D.2CO(g)+O2(g)===2CO2(g) ΔH<0,则 56 g CO 和 32 g O2 所具有的总能量小于 88 g CO2 所具有的总能量 解析 化学反应的实质为旧键的断裂和新键的形成,任何化学反应都伴随着能量 的变化,故 A 项正确;反应热与催化剂无关,故 B 项错误;化学反应中的能量变 化可以热能、电能、光能等形式体现,故 C 项错误;2CO(g)+O2(g)===2CO2(g)是 放热反应,反应物总能量大于生成物总能量,故 D 项错误。 答案 A 3.BeCl2 是有机反应的催化剂。铍和氯气反应的能量变化如图所示。下列说法正 确的是( ) A.E2 是正反应的活化能 B.该反应的 ΔH<0 C.加入催化剂,ΔH 减小 D.ΔH=E2-E1 解析 E1 是正反应活化能,E2 是逆反应活化能,A 项错误;该反应是放热反应,B 项正确;加入催化剂,减小 E2 和 E1,不改变 ΔH,C 项错误;ΔH=E1-E2,D 项 错误。 答案 B 4.(2018·北京东城区模拟)由 N2O 和 NO 反应生成 N2 和 NO2 的能量变化如图所示。 下列说法不正确的是( ) A.反应生成 1 mol N2 时转移 4 mol e- B.反应物能量之和大于生成物能量之和 C.N2O(g)+NO(g)===N2(g)+NO2(g) ΔH=-139 kJ·mol-1 D.断键吸收能量之和小于成键释放能量之和 解析 N2O 和 NO 反应生成 N2 和 NO2 的化学方程式为 N2O+NO===N2+NO2,反 应生成 1 mol N2 时转移 2 mol e-,A 不正确;根据图示,反应物能量之和大于生成 物能量之和,B 正确;该反应的反应热为(209-348)kJ·mol-1=-139 kJ·mol-1,C 正确;由于该反应放热,所以断键吸收能量之和小于成键释放能量之和,D 正确。 答案 A [能力点提升] 5.下列有关能量的判断和表示方法正确的是( ) A.由 C(s,石墨)===C(s,金刚石) ΔH=+1.9 kJ·mol -1 可知:石墨比金刚石更 稳定 B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多 C.由 H + (aq)+OH - (aq)===H2O(l) ΔH=-57.3 kJ·mol - 1 ,可知:含 1 mol CH3COOH 的溶液与含 1 mol NaOH 的溶液混合,放出热量等于 57.3 kJ D.2 g H2 完全燃烧生成液态水放出 285.8 kJ 热量,则氢气燃烧的热化学方程式为 2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ·mol-1 解析 石墨转化为金刚石的过程是吸热反应,金刚石能量高,石墨比金刚石稳定, A 正确;等质量的硫蒸气和硫固体分别完全燃烧,固体硫变为蒸气需要吸收热量, 前者放出热量更多,B 错误;含 1 mol CH3COOH 的溶液与含 1 mol NaOH 的溶液 混合,醋酸为弱酸,溶于水电离需要吸热,放出热量小于 57.3 kJ,C 错误;2 g H2 的物质的量为 1 mol,此反应为放热反应,ΔH<0,故氢气燃烧的热化学方程式为 2H2(g)+O2(g)===2H2O(l) ΔH=2×(-285.8 kJ·mol-1)=-571.6 kJ·mol-1,D 错误。 答案 A 6.25 ℃、101 kPa 时,强酸与强碱的稀溶液发生中和反应的中和热为 57.3 kJ/mol, 辛烷的燃烧热为 5 518 kJ/mol。下列热化学方程式书写正确的是( ) A.2H+(aq)+SO2-4 (aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) ΔH=-57.3 kJ/mol B.KOH(aq)+1 2H2SO4(aq)===1 2K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol C.C8H18(l)+25 2 O2(g)===8CO2(g)+9H2O(g) ΔH=-5 518 kJ/mol D.2C8H18+25O2(g)===16CO2(g)+18H2O(l) ΔH=-5 518 kJ/mol 答案 B 7.利用如图所示装置测定中和热的实验步骤如下: ①用量筒量取 50 mL 0.50 mol·L-1 盐酸倒入小烧杯中,测出盐酸温度;②用另一量 筒量取 50 mL 0.55 mol·L-1 NaOH 溶液,并用同一温度计测出其温度;③将 NaOH 溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题: (1)为什么所用 NaOH 溶液要稍过量?____________________________ _____________________________________________________________。 (2)倒入 NaOH 溶液的正确操作是________(填字母)。 A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入 (3)使盐酸与 NaOH 溶液混合均匀的正确操作是________(填字母)。 A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌 C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动 (4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和 1 L 1 mol·L-1 的稀盐酸恰好完全反应,其反应热分别为 ΔH1、ΔH2、ΔH3,则 ΔH1、ΔH2、ΔH3 的 大小关系为________。 (5)测定中和热的实验中________(填“能”或“不能”)用 Ba(OH)2 溶液和 H2SO4 溶 液代替氢氧化钠溶液和盐酸,理由是____________________________。 解析 (1)在中和热的测定实验中为了确保反应物被完全中和,常常使加入的一种 反应物稍微过量一些。 (2)为了减少热量损失,应将 NaOH 溶液迅速倒入小烧杯中。(3)使盐酸与 NaOH 溶 液混合均匀的正确操作是用套在温度计上的环形玻璃搅拌棒轻轻地搅动混合溶液。 (4)稀氢氧化钠溶液和稀氢氧化钙溶液中的溶质均完全电离,故它们与稀盐酸反应 的反应热相等,即 ΔH1=ΔH2,稀氨水中的 NH3·H2O 是弱电解质,在反应过程中 NH3·H2O 的电离要吸收热量,故稀氨水与盐酸反应放出的热量要少一些,故 ΔH3>ΔH1=ΔH2。(5)因为 H2SO4 与 Ba(OH)2 反应生成 BaSO4 沉淀的过程也会放出 热量,所以不能用 Ba(OH)2 溶液和 H2SO4 溶液代替氢氧化钠溶液和盐酸。 答案 (1)确保盐酸被完全中和 (2)C (3)D (4)ΔH1=ΔH2<ΔH3 (5)不能 H2SO4 与 Ba(OH)2 反应生成 BaSO4 沉淀也会放出热量 [高考真题体验] 8.(2018·北京理综,7)我国科研人员提出了由 CO 2 和 CH4 转化为高附加值产品 CH3COOH 的催化反应历程。该历程示意图如图。 下列说法不正确的是( ) A.生成 CH3COOH 总反应的原子利用率为 100% B.CH4―→CH3COOH 过程中,有 C—H 键发生断裂 C.①→②放出能量并形成了 C—C 键 D.该催化剂可有效提高反应物的平衡转化率 解 析 由 CO2 和 CH4 制 备 CH3COOH 的 化 学 方 程 式 为 CO2 + CH4 ― ― →催化剂 CH3COOH,反应中没有副产物生成,所以总反应的原子利用率为 100%,A 项正 确;CH4 分子中含有 4 个 C—H 键,而 CH3COOH 分子中含有 3 个 C—H 键,显然 CH4―→CH3COOH 过程中必有 C—H 键发生断裂,B 项正确;观察反应的示意图 可知,①→②过程中放出能量,且在此过程中形成了新化学键,即乙酸分子中的 C—C 键,C 项正确;催化剂只能改变化学反应速率,而不影响化学平衡,不能提 高反应物的平衡转化率,D 项错误。 答案 D 9.(2018·浙江 4 月选考,21)氢卤酸的能量关系如图所示,下列说法正确的是( ) A.已知 HF 气体溶于水放热,ΔH1<0 B.相同条件下,HCl 的 ΔH2 比 HBr 的小 C.相同条件下,HCl 的(ΔH3+ΔH4)比 HI 的大 D.一定条件下,气态原子生成 1 mol H—X 键放出 a kJ 能量,则该条件下 ΔH2=a kJ·mol-1 解析 A 选项 ΔH1 为溶液到气体为吸热反应 ΔH1>0,A 错误;Cl 的非金属性更强, HCl 更稳定,对应 ΔH2 更大,B 错误;C 项,ΔH3+ΔH4 表示 H(g)―→H+(aq)的焓 变,C 项错误;ΔH2 即为键能,D 正确。 答案 D 考点二 热化学方程式 [学在课内] 1.概念 表示参加反应物质的量和反应热关系的化学方程式。 2.意义 表明了化学反应中的物质变化和能量变化。 如:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1 表示:25__℃、101__kPa 条件下,2__mol 氢气和 1__mol 氧气反应生成 2__mol 液 态水时放出 571.6__kJ 的热量。 3.热化学方程的书写 [名师点拨] (1)热化学方程式中可不注明“↓、↑、点燃、加热”等。 (2)热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,可 以是整数,也可以是分数。 (3)ΔH 必须与计量数对应。计量数加倍,ΔH 也应相应加倍。 [考在课外] 教材延伸 判断正误 (1)热化学方程式前面的计量数不仅表示分子数也表示物质的量。(×) (2)150 ℃时,CH 4 燃烧的热化学方程式为 CH4(g)+2O 2(g)===CO2(g)+2H 2O(g) ΔH(√) (3)对于 SO2(g)+1 2O2(g) SO3(g) ΔH=-Q kJ·mol-1,增大压强平衡右移, 放出的热量增大,ΔH 减小。(×) (4)H2(g)+1 2O2(g)===H2O(l) ΔH1 和 2H2(g)+O2(g)===2H2O(l) ΔH2,则 ΔH1=ΔH2。 (×) 拓展应用 写出下列反应的热化学方程式 (1)14 g N2(g)与适量的 O2(g)在一定条件下反应生成 NO(g),吸收 34 kJ 热量。 ______________________________________________________________ (2)在 25 ℃、101 kPa 下,CO 燃烧的热化学方程式:2CO(g)+O2(g)===2CO2(g) ΔH = - 566 kJ·mol - 1 , 则 表 示 CO 燃 烧 热 的 热 化 学 方 程 式 为 __________________________________________。 答案 (1)N2(g)+O2(g)===2NO(g) ΔH=+68 kJ·mol-1 (2)CO(g)+1 2O2(g)===CO2(g) ΔH=-283 kJ·mol-1 [基础点巩固] 1.下列热化学方程式书写正确的是(ΔH 的绝对值均正确)( ) A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ·mol-1(燃烧热) B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1(中和热) C.S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ·mol-1(反应热) D.2NO2===O2+2NO ΔH=+116.2 kJ·mol-1(反应热) 答案 C 2.下列热化学方程式正确的是( ) 选项 已知条件 热化学方程式 A H2 的燃烧热为 a kJ·mol-1 H2+Cl2 ===== 点燃 2HCl ΔH=-a kJ·mol-1 B 1 mol SO2、0.5 mol O2 完全反应后, 放出热量 98.3 kJ 2SO2(g)+O2(g) 2SO3(g) ΔH= -98.3 kJ·mol-1 C H+(aq)+OH-(aq)===H2O(l) ΔH =-57.3 kJ·mol-1 H2SO4(aq)+ Ba(OH)2(aq)===BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1 D 31 g 白磷比 31 g 红磷能量多 b kJ P4(白磷,s)===4P(红磷,s) ΔH=- 4b kJ·mol-1 解析 选项 A 中符合已知条件的应是 H2 和 O2 反应,A 错;ΔH 应为-196.6 kJ·mol -1,B 错;选项 C 中由于生成 BaSO4 沉淀,放出的热量大于 114.6 kJ,C 错。 答案 D 3.(1)SiH4 是一种无色气体,遇到空气能发生爆炸性自燃,生成 SiO2 和液态 H2O。 已 知 室 温 下 2 g SiH4 自 燃 放 出 热 量 89.2 kJ 。 SiH4 自 燃 的 热 化 学 方 程 式 为 ___________________________________________________________________ _________________________________________________________________。 (2)在 25 ℃、101 kPa 下,一定质量的无水乙醇完全燃烧时放出热量 Q kJ,其燃烧 生成的 CO2 用过量饱和石灰水吸收可得 100 g CaCO3 沉淀,则乙醇燃烧的热化学方 程式为____________________________________________________ ______________________________________________________________。 (3)CuCl(s)与 O2 反应生成 CuCl2(s)和一种黑色固体。在 25 ℃、101 kPa 下,已知该 反 应 每 消 耗 1 mol CuCl(s) , 放 热 44.4 kJ , 该 反 应 的 热 化 学 方 程 式 是 _________________________________________________________________ __________________________________________________________________。 答案 (1)SiH4(g)+2O2(g)===SiO2(s)+2H2O(l) ΔH=-1 427.2 kJ·mol-1 (2)C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-2Q kJ·mol-1 (3)4CuCl(s)+O2(g)===2CuCl2(s)+2CuO(s) ΔH=-177.6 kJ·mol-1 [名师点拨] 判断热化学方程式正误的“五审” [能力点提升] 4.下列各组热化学方程式的 ΔH 前者大于后者的是( ) ①C(s)+O2(g)===CO2(g) ΔH1 C(s)+1 2O2(g)===CO(g) ΔH2 ②S(s)+O2(g)===SO2(g) ΔH3 S(g)+O2(g)===SO2(aq) ΔH4 ③H2(g)+1 2O2(g)===H2O(l) ΔH5 2H2(g)+O2(g)===2H2O(l) ΔH6 ④CaCO3(s)===CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)===Ca(OH)2(aq) ΔH8 A.① B.④ C.②③④ D.①②③ 解析 ΔH 有正、负之分,比较时要连同“+”“-”在内一起比较,类似数学中 的正、负数大小的比较。①中第一个热化学方程式减去第二个热化学方程式可得: CO(g)+1 2O2(g)===CO2(g) ΔH=ΔH1-ΔH2,该反应为放热反应,即 ΔH1-ΔH2<0, 所以 ΔH1<ΔH2。 答案 C 5.(1)已知化学反应 A2(g)+B2(g)===2AB(g)的能量变化如图所示,请写出该反应的 热化学方程式___________________________________________________ __________________________________________________________________。 (2)一定条件下,在水溶液中 1 mol Cl-、ClO-x (x=1,2,3,4)的能量(kJ)相对大小 如图所示。 ①D 是________(填离子符号)。 ②B―→A+C 反应的热化学方程式为_______________________________ ______________________________________________________________________ __(用离子符号表示)。 (1)解析 由图可知,生成物总能量高于反应物总能量,故该反应为吸热反应,ΔH =+(a-b)kJ·mol-1。(2)D 中氯元素的化合价为+7 价,应为高氯酸根离子 ClO-4 ; 写出 B―→A+C 的化学方程式,利用生成物的总能量减去反应物的总能量求得 ΔH=(63-60×3)kJ·mol-1=-117 kJ·mol-1,写出热化学方程式。 答案 (1)A2(g)+B2(g)===2AB(g) ΔH=+(a-b)kJ·mol-1 (2)①ClO-4 ②3ClO-(aq)===ClO-3 (aq)+2Cl-(aq) ΔH=-117 kJ·mol-1 6.煤炭燃烧过程中会释放出大量的 SO2,严重破坏生态环境。采用一定的脱硫技 术可以把硫元素以 CaSO4 的形式固定,从而降低 SO2 的排放。但是煤炭燃烧过程 中产生的 CO 又会与 CaSO4 发生化学反应,降低了脱硫效率。相关反应的热化学 方程式如下: CaSO4(s)+CO(g) CaO(s)+SO 2(g)+CO2(g) ΔH1=+218.4 kJ·mol -1(反应 Ⅰ) CaSO4(s)+4CO(g) CaS(s)+4CO2(g) ΔH2=-175.6 kJ·mol-1(反应Ⅱ) 请回答下列问题: (1)反应Ⅰ是放热反应还是吸热反应?________,能否通过反应Ⅰ判断等物质的量 的 CO、CO2 具有能量的高低?___________________________________。 (2)已知 CO 转化成 CO 2 的能量关系如图所示。写出该反应的热化学方程式 ________________________________________________________________, 则 CO 的燃烧热 ΔH 为________ kJ·mol-1。 (3)依据反应Ⅰ、Ⅱ确定反应 CaO(s)+3CO(g)+SO2(g)===CaS(s)+3CO2(g) ΔH= ________kJ·mol-1, 解析 (1)反应Ⅰ的 ΔH1>0,故为吸热反应;通过反应Ⅰ只能判断反应物总能量低 于生成物总能量,不能判断某一反应物与某一生成物之间的能量的相对大小。(2) 由图可知 2CO(g) +O2(g)===2CO2(g) ΔH =-566 kJ·mol -1 ,CO 的燃烧热为1 2 ×566 kJ·mol-1。 (3) 利 用 盖 斯 定 律 将 反 应 Ⅱ 减 去 反 应 I 可 得 目 标 方 程 式 , ΔH = ( - 175.6 - 218.4)kJ·mol-1=-394 kJ·mol-1。 答案 (1)吸热反应 否 (2)2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1 -283 (3)-394 [名师点拨] 反应热大小比较 若反应为放热反应 (1)在比较反应热(ΔH)的大小时,应带符号比较。对于放热反应,放出的热量越多, ΔH 反而越小。 (2)当反应物状态相同,生成物状态不同时,生成固体放热最多,生成气体放热最 少。 (3)当反应物状态不同,生成物状态相同时,固体反应放热最少,气体反应放热最 多。 (4)反应物、生成物状态相同时,计量系数大者放热最多。 (5)可燃物相同时,完全燃烧时放出热量多。 [高考真题体验] 7.(2018·北京理综,27)近年来,研究人员提出利用含硫物质热化学循环实现太阳 能的转化与存储。过程如下: (1)反应Ⅰ:2H2SO4(l)===2SO2(g)+2H2O(g)+O2(g) ΔH=+551 kJ·mol-1 反应Ⅲ:S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol-1 反应Ⅱ的热化学方程式:_______________________________________。 解析 (1)由于反应Ⅱ是二氧化硫的歧化反应,且由题意可知其氧化产物和还原产 物分别为 H2SO4 和 S,根据得失电子守恒和元素守恒可写出反应Ⅱ的化学方程式为: 3SO2(g)+2H2O(g)===2H2SO4(l)+S(s)。根据盖斯定律,反应 I 与反应Ⅲ的热化学方 程式相加得:2H2SO4(l)+ S(s)===3SO2(g)+2H2O(g) ΔH=+254 kJ·mol-1,所以反应Ⅱ的热化学方程式为: 3SO2(g)+2H2O(g)===2H2SO4(l)+S(s) ΔH2=-254 kJ·mol-1。 答案 (1)3SO2(g)+2H2O(g)===2H2SO4(l)+S(s) ΔH2=-254 kJ·mol-1 8.[2017·课标全国卷Ⅰ,28(2)]下图是通过热化学循环在较低温度下由水或硫化氢 分解制备氢气的反应系统原理。 通 过 计 算 , 可 知 系 统 (Ⅰ) 和 系 统 (Ⅱ) 制 氢 的 热 化 学 方 程 式 分 别 为 ______________________________________________________________、 _______________________________________________________________, 制得等量 H2 所需能量较少的是________。 解析 系统Ⅰ制氢,反应③中有 H2 生成,要消掉 HI,②中有 HI 还有 SO2,要消 掉 SO2,要和①相加,将系统(Ⅰ)中三个反应相加得 H2O(l)===H2(g)+1 2O2(g),计 算反应热 ΔH=327+(-151)+110=286 (kJ/mol)。同理将系统(Ⅱ)中三个反应相加 得 H2S(g)===H2(g)+S(s) ΔH=20 kJ/mol,制得等量 H2,系统Ⅱ所需能量较少。 答案 H2O(l)===H2(g)+1 2O2(g) ΔH=286 kJ/mol H2S (g)===H2(g)+S(s) ΔH=20 kJ/mol 系统(Ⅱ) 考点三 盖斯定律 反应热的计算 [学在课内] 1.盖斯定律 内容:对于一个化学反应,无论是一步完成还是分几步完成,其反应热都是相同 的。即:化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无 关。 (2)意义:间接计算某些反应的反应热。 (3)应用 转化关系 反应热间的关 系 aA ― ― →ΔH1 B、A ― ― →ΔH2 1 aB ΔH1=aΔH2 A B ΔH1=-ΔH2 ΔH=ΔH1+ΔH2 2.反应热计算的四种方法 (1)由 H 值计算 ΔH ΔH=∑H 生成物-∑H 反应物 (2)由键能计算 ΔH ΔH=反应物的总键能-生成物的总键能 如 H2(g)+Cl 2(g)===2HCl(g) ΔH 由能量守恒知 E H—H+ECl—Cl=2EH—Cl+ΔH 或 ΔH=EH—H+ECl—Cl-2EH—Cl (3)由反应中的热量变化 Q 计算 ΔH 如 1 g H2 充分燃烧生成 H2O(l)时放出 Q kJ 的热量,H2 的燃烧热为________kJ·mol -1。 H2(g)+1 2O2(g)===H2O(l) ΔH 1 mol |ΔH| 1 2 mol Q 故|ΔH|=2Q kJ·mol-1 ΔH=-2Q kJ·mol-1,故 H2 的燃烧热为 2Q。 (4)由分式结合盖斯定律计算 ΔH(见应用) [考在课外] 教材延伸 判断正误 (1)一个反应一步完成或几步完成,两者相比,经过的步骤越多,放出的热量越少(×) (2)H—H、O===O 和 O—H 键的键能分别为 436 kJ·mol -1 、496 kJ·mol -1 和 462 kJ·mol-1,则反应 H2(g)+1 2O2(g)===H2O(g)的 ΔH=-916 kJ·mol-1(×) (3)已知:O3+Cl===ClO+O2 ΔH1 ClO+O===Cl+O2 ΔH2 则反应 O3+O===2O2 ΔH=ΔH1+ΔH2(√) 拓展应用 (1)标准摩尔生成焓是指在 25 ℃和 101 kPa 时,最稳定的单质生成 1 mol 化合物的 焓变。已知 25 ℃和 101 kPa 时下列反应: ①2C2H6(g)+7O2(g)===4CO2(g)+6H2O(l) ΔH=-3 116 kJ·mol-1 ②C(石墨,s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1 ③2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1 写出乙烷标准摩尔生成焓的热化学方程式:__________________________ __________________________________________________________________。 解析 根据标准摩尔生成焓的定义,乙烷的标准摩尔生成焓是指由单质 C(石墨)和 单质 H2 生成 1 mol C2H6 的焓变。根据盖斯定律,(②×4-①+③×3)÷2 得:2C(石 墨,s)+3H2(g)===C2H6(g) ΔH=-86.4 kJ·mol-1。 答案 2C(石墨,s)+3H2(g)===C2H6(g) ΔH=-86.4 kJ·mol-1 思维探究 分子式为 C2H6O 的两种同分异构体 C2H5OH、CH3OCH3 的燃烧热是否相同? 答案 不相同 二者所含化学键的情况不一样。 C—C C—H C—O O—H C2H5OH 1 5 1 1 CH3OCH3 0 6 2 0 [基础点巩固] 1.已知丙烷的燃烧热 ΔH=-2 215 kJ·mol-1。若一定量的丙烷完全燃烧后生成 1.8 g 水,则放出的热量约为( ) A.55 kJ B.220 kJ C.550 kJ D.1 108 kJ 解析 由丙烷的燃烧热 ΔH=-2 215 kJ·mol -1,可写出其燃烧的热化学方程式 C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=-2 215 kJ·mol-1,丙烷完全燃烧产生 1.8 g 水,n(H2O)=m÷M=1.8 g÷18 g/mol=0.1 mol,所以反应放出的热量是 Q=(2 215 kJ÷4 mol)×0.1=55.4 kJ,A 选项正确。 答案 A 2.已知:H2(g)+1 2O2(g)===H2O(g) ΔH=-242 kJ/mol,断开 1 mol O===O 键和 1 mol H—O 键所吸收的能量分别为 496 kJ 和 463 kJ,则断开 1 mol H—H 键所吸收 的能量为( ) A.920 kJ B.557 kJ C.436 kJ D.188 kJ 解析 根据反应物键能之和减去生成物键能之和等于 ΔH,设 H—H 键能为 x,则 有 x+1 2 ×496-2×463=-242,解得 x=436,答案选 C 项。 答案 C 3.已知:C(s)+H2O(g)===CO(g)+H2(g) ΔH=a kJ·mol-1 2C(s)+O2(g)===2CO(g) ΔH=-220 kJ·mol-1 H—H、O===O 和 O—H 键的键能分别为 436 kJ·mol-1、496 kJ·mol-1 和 462 kJ·mol -1,则 a 为( ) A.-332 B.-118 C.+350 D.+130 解析 根据盖斯定律由题给的两个热化学方程式可得:2H2O(g)===2H2(g)+O2(g) ΔH=+(2a+220)kJ·mol-1,则有 4×462 kJ·mol-1-2×436 kJ·mol-1-496 kJ·mol-1 =(2a+220)kJ·mol-1,解得 a=+130,故 D 正确。 答案 D 4.(1)已知反应 2HI(g)===H2(g)+I2(g)的 ΔH=+11 kJ·mol-1,1 mol H2(g)、1 mol I2(g) 分子中化学键断裂时分别需要吸收 436 kJ、151 kJ 的能量,则 1 mol HI(g)分子中化 学键断裂时需吸收的能量为____________kJ。 (2)已知:①H2(g)+1 2O2(g)===H2O ΔH1=-198 kJ·mol-1 ②CO(g)+1 2O2(g)===CO2(g) ΔH2 ③CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH3=-846.3 kJ·mol-1 化学键 C O O===O C===O 键能/(kJ·mol-1) 958.5 497 745 ΔH2 = ________ kJ·mol - 1 ; CH4(g) + H2O(g) CO(g) + 3H2(g) 的 ΔH = ________。 解析 (1)形成 1 mol H2(g)和 1 mol I2(g)共放出 436 kJ+151 kJ=587 kJ 能量,设断 裂 2 mol HI(g)中化学键吸收 2a kJ 能量,则有 2a-587=11,得 a=299 kJ。 (2)由热化学方程式知 ΔH2=EC O+1 2EO===O-2EC===O=958.5+1 2 ×497-2×745= -283 kJ·mol-1; 目标方程式 CH4(g)+H2O(g) CO(g)+3H2(g),③-①-②得目标方程式, 故 ΔH=ΔH3-ΔH1-ΔH2。 =-846.3 kJ·mol-1-(-198 kJ·mol-1)-(-283 kJ·mol-1) =-365.3 kJ·mol-1 答案 (1)299 (2)-283 -365.3 kJ·mol-1 [名师点拨] 依据键能计算 ΔH 的方法 1.(1)计算公式:ΔH=反应物的键能总和-生成物的键能总和。 (2)根据键能计算反应热的关键是正确找出反应物和生成物所含共价键的种类与数 目。 2.常见物质中化学键的数目 1 mol 物质 CO2 (C===O) CH4 (C—H) P4 (P—P) SiO2 (Si—O) 石墨 (C—C) 金刚石 (C—C) Si (Si—Si) 化学 键数 2NA 4NA 6NA 4NA 1.5NA 2NA 2NA 3.思维导图 [能力点提升] 5.室温下,将 1 mol 的 CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为 ΔH1, 将 1 mol 的 CuSO4(s)溶于水会使溶液温度升高,热效应为 ΔH2,CuSO4·5H2O 受热 分解的化学方程式为:CuSO4·5H2O(s) ===== △ CuSO4(s)+5H2O(l),热效应为 ΔH3。 则下列判断正确的是( ) A.ΔH2>ΔH3 B.ΔH1<ΔH3 C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2>ΔH3 解析 1 mol CuSO4·5H2O(s)溶于水会使溶液温度降低,为吸热反应,故 ΔH1>0,1 mol CuSO4(s) 溶 于 水 会 使 溶 液 温 度 升 高 , 为 放 热 过 程 , 故 ΔH2<0 ; 1 mol CuSO4·5H2O(s)溶于水可以分为两个过程,先分解成 1 mol CuSO4(s)和 5 mol 水,然 后 1 mol CuSO4(s)再溶于水。CuSO4·5H2O 的分解为吸热反应,即 ΔH3>0,根据盖 斯定律得到关系式 ΔH1=ΔH2+ΔH3,分析得到答案 ΔH1<ΔH3。 答案 B 6. (原创新题)最近意大利科学家获得了极具理论研究意义的 N4 分子。N4 分子结构 如图所示,已知Ⅰ、断裂 1 mol N—N 吸收 167 kJ 热量,形成 1 mol 放出 942 kJ 热量;Ⅱ、N2(g)+3H2(g) 2NH3(g) ΔH1=-92 kJ/mol,N4(g)+ 6H2(g) 4NH3(g) ΔH 2(kJ/mol)根据以上信息和数据,下列说法正确的是 ( ) A.ΔH2>0 B.N2 分子比 N4 分子稳定 C.ΔH2=2ΔH1 D.ΔH2 与方程式系数无关 解析 因为 的键能大于 N—N 的键能,故 N2 比 N4 稳定,故 N4(g)+6H2(g) 4NH3(g),ΔH2<2×ΔH1;D 项 ΔH 与系数(实际参加反应的物质的量)有关。 答案 B 7.对于反应 C2H4(g) C2H2(g)+H2(g)、2CH4(g) C2H4(g)+2H2(g),当 升高温度时平衡都向右移动。 ①C(s)+2H2(g)===CH4(g) ΔH1; ②2C(s)+H2(g)===C2H2(g) ΔH2; ③2C(s)+2H2O(g)===C2H4(g) ΔH3 则①②③中 ΔH1、ΔH2、ΔH3 的大小顺序排列正确的是( ) A.ΔH1>ΔH2>ΔH3 B.ΔH2>ΔH3>ΔH1 C.ΔH2>ΔH1>ΔH3 D.ΔH3>ΔH2>ΔH1 解析 由 C2H4(g) C2H2(g)+H2(g) 2CH4(g) C2H4(g)+2H2(g),升温 平衡都向右移动可知二者均为吸热反应,ΔH>0,又由③×(-1)+②得 C 2H4(g) C2H2(g)+H 2(g) ΔH=ΔH 2-ΔH3>0⇒ΔH 2>ΔH3。由(-2)×①+③得 2CH4(g) C2H4(g)+2H2(g) ΔH=ΔH 3-2ΔH1>0⇒ΔH 3>2ΔH1。故 ΔH2> ΔH3>ΔH1。 答案 B [高考真题体验] 8.(1)[2015·浙江理综,28(1)]已知:乙苯催化脱氢制苯乙烯反应: +H2(g) 化学键 C—H C—C C===C H—H 键能(kJ·mol-1) 412 348 612 436 计算上述反应的 ΔH=________ kJ·mol-1。 解析 设“ ”部分的化学键键能为 a kJ·mol-1,则 ΔH=(a+348+412×5) kJ·mol-1-(a+612+412×3+436) kJ·mol-1=124 kJ·mol-1。 答案 +124 (2)(2015·课标全国Ⅱ,27 节选)甲醇既是重要的化工原料,又可作为燃料,利用合 成气(主要成分为 CO、CO2 和 H2)在催化剂作用下合成甲醇,发生的主要反应如下: ①CO(g)+2H2(g) CH3OH(g)ΔH1<0 ②CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH2 ③CO2(g)+H2(g) CO(g)+H2O(g)ΔH3 已知反应①中相关的化学键键能数据如下: 化学键 H—H C—O C O H—O C—H E/(kJ·mol-1) 436 343 1 076 465 413 由 此 计 算 ΔH1 = ________kJ·mol - 1 ; 已 知 ΔH2 = - 58 kJ·mol - 1 , 则 ΔH3 = ________kJ·mol-1。 解析 根据键能与反应热的关系可知,ΔH1=反应物的键能之和-生成物的键能之 和=(1 076 kJ·mol -1+2×436 kJ·mol -1)-(413 kJ·mol -1×3+343 kJ·mol -1+465 kJ·mol-1)=-99 kJ·mol-1。 根据质量守恒定律:由②-①可得:CO2(g)+H2(g) CO(g)+H2O(g),结合 盖斯定律可得:ΔH3=ΔH2-ΔH1 =(-58 kJ·mol-1)-(-99 kJ·mol-1)=+41 kJ·mol-1。 答案 -99 +41 (3)(2018·天津理综,10)CO 2 与 CH4 经催化重整,制得合成气:CH4(g)+CO2(g) 催化剂 2CO(g)+2H2(g) 已知上述反应中相关的化学键键能数据如下: 化学键 C—H C===O H—H C O(CO) 键能/(kJ·mol-1) 413 745 436 1 075 则该反应的 ΔH=________。 答案 +120 kJ·mol-1 盖斯定律的应用 提升学生“模型认知”素养 素养说明:高考主要以生产、生活、科学技术和能源问题等社会热点为背景,将 热化学方程式的书写和盖斯定律的计算融合在一起,较好地考查学生对知识的灵 活应用和运算能力。解题过程中,结合盖斯定律,通过数学建模,设计合理的反 应途径,计算出相应反应的 ΔH,写出对应反应的热化学方程式,从而提升学生的 模型认知素养。 [名师点拨] 利用盖斯定律计算 ΔH [题组训练] 1.根据要求回答问题 (1)(2018·课标全国Ⅱ,27)CH 4CO2 催化重整不仅可以得到合成气(CO 和 H2),还 对温室气体的减排具有重要意义。回答下列问题: (1)CH4CO2 催化重整反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g)。 已知:C(s)+2H2(g)===CH4(g) ΔH=-75 kJ·mol-1 C(s)+O2(g)===CO2(g) ΔH=-394 kJ·mol-1 C(s)+1 2O2(g)===CO(g) ΔH=-111 kJ·mol-1 该催化重整反应的 ΔH=________kJ·mol-1。 解析 将已知中 3 个反应依次记为①、②、③,根据盖斯定律③×2-①-②得该 催化重整反应的 ΔH=(-111×2+75+394) kJ·mol-1=+247 kJ·mol-1。 答案 +247 (2)(2018·课标全国Ⅰ,35)已知:2N2O5(g)===2N2O4(g)+O2(g) ΔH1=-4.4 kJ·mol -1 2NO2(g)===N2O4(g) ΔH2=-55.3 kJ·mol-1 则反应 N2O5(g)===2NO2(g)+1 2O2(g)的 ΔH=________kJ·mol-1。 答案 +53.1 (3)(2018·课标全国Ⅲ)SiHCl3 在催化剂作用下发生反应: 2SiHCl3(g)===SiH2Cl2(g)+SiCl4(g) ΔH=48 kJ·mol-1 3SiH2Cl2(g)===SiH4(g)+2SiHCl3(g) ΔH=-30 kJ·mol-1 则反应 4SiHCl3(g)===SiH4(g)+3SiCl4(g)的 ΔH 为________kJ·mol-1。 答案 +114 (4)(2018·江苏化学)用水吸收 NOx 的相关热化学方程式如下: 2NO2(g)+H2O(l)===HNO3(aq)+HNO2(aq) ΔH=-116.1 kJ·mol-1 3HNO2(aq)===HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol-1 反应 3NO2(g)+H2O(l)===2HNO3(aq)+NO(g)的 ΔH=________kJ·mol-1。 解析 ①2NO 2(g)+H 2O(l)===HNO3(aq)+HNO 2(aq) ΔH=-116.1 kJ·mol - 1 , ②3HNO2(aq)===HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol-1,根据盖斯定律, (①×3+②)/2 得:3NO2(g)+H2O(l)===2HNO3(aq)+NO(g) ΔH=-136.2 kJ·mol- 1。 答案 -136.2 2.根据要求回答问题 (1)(2017·课标全国Ⅱ)正丁烷(C4H10)脱氢制 1丁烯(C4H8)的热化学方程式如下: ①C4H10(g)===C4H8(g)+H2(g) ΔH1 已知:②C4H10(g)+1 2O2(g)===C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1 ③H2(g)+ 1 2O2(g)===H2O(g) ΔH3=-242 kJ·mol-1 反应①的 ΔH1 为________ kJ·mol-1。 (2)(2017·海南高考)已知:①2NaOH(s)+CO 2(g)===Na2CO3(s)+H2O(g) ΔH1=- 127.4 kJ·mol-1 ②NaOH(s)+CO2(g)===NaHCO3(s) ΔH2=-131.5 kJ·mol-1 反应 2NaHCO3(s)===Na2CO3(s)+H2O(s)+CO2(g)的 ΔH=________ kJ·mol-1。 解析 (1)根据盖斯定律,用②式-③式可得①式,因此 ΔH 1=ΔH2-ΔH3=-119 kJ/mol+242 kJ/mol=+123 kJ/mol。 (2)根据盖斯定律:由①-②×2 得到 2NaHCO3(s)===Na2CO3(s)+CO2(g)+H2O(g) ΔH=(-127.4+2×131.5)kJ·mol-1=+135.6 kJ·mol-1。 答案 (1)+123 (2)+135.6 3.根据要求回答问题 (1)(2016·课标全国Ⅱ节选)①2O2(g)+N2(g)===N2O4(l) ΔH1 ②N2(g)+2H2(g)===N2H4(l) ΔH2 ③O2(g)+2H2(g)===2H2O(g) ΔH3 ④2N2H4(l)+N2O4(l)===3N2(g)+4H2O(g) ΔH4=-1 048.9 kJ·mol-1 上述反应热效应之间的关系式为 ΔH4=________,联氨和 N2O4 可作为火箭推进剂 的主要原因为_______________________________________________________ ___________________________________________________________________。 解析 对照目标热化学方程式中的反应物和生成物在已知热化学方程式中的位置 和化学计量数,利用盖斯定律,③×2-②×2-①即可得出④,故 ΔH4=2ΔH3- 2ΔH2-ΔH1;联氨具有强还原性,N2O4 具有强氧化性,两者混合在一起易自发地 发生氧化还原反应,反应放热量大,并产生大量的气体,可为火箭提供很大的推 进力。 答案 2ΔH3-2ΔH2-ΔH1 反应放热量大,产生大量的气体 (2)FeSO4 可转化为 FeCO3,FeCO3 在空气中加热反应可制得铁系氧化物材料。 已知 25 ℃,101 kPa 时: 4Fe(s)+3O2(g)===2Fe2O3(s) ΔH=-1 648 kJ·mol-1 C(s)+O2(g)===CO2(g) ΔH=-393 kJ·mol-1 2Fe(s)+2C(s)+3O2(g)===2FeCO3(s) ΔH=-1 480 kJ·mol-1 FeCO3 在空气中加热反应生成 Fe2O3 的热化学方程式是 ___________________________________________________________。 解析 将所给热化学方程式标号: 4Fe(s)+3O2(g)===2Fe2O3(s) ΔH=-1 648 kJ·mol-1 ① C(s)+O2(g)===CO2(g) ΔH=-393 kJ·mol-1 ② 2Fe(s)+2C(s)+3O2(g)===2FeCO3(s) ΔH=-1 480 kJ·mol-1 ③ 根据盖斯定律:③×(-2)+①+②×4 可得:4FeCO 3(s)+O 2(g)===2Fe2O3(s)+ 4CO2(g) ΔH=-260 kJ·mol-1。 答案 4FeCO3(s)+O2(g)===2Fe2O3(s)+4CO2(g) ΔH=-260 kJ·mol-1 活页作业 A 组 基础巩固题 1.为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了 利用太阳能制取氢能的构想。 下列说法正确的是( ) A.H2O 的分解反应是放热反应 B.氢能源已被普遍使用 C.2 mol 液态 H2O 具有的总能量低于 2 mol H2 和 1 mol O2 的能量 D.氢气不易贮存和运输,无开发利用价值 解析 2H2O(l)===2H2(g)+O2(g)是吸热反应,说明 2 mol 液态 H2O 的能量低于 2 mol H2 和 1 mol O2 的能量。因由水制取 H2 耗能多且 H2 不易贮存和运输,所以氢 能源利用并未普及,但发展前景广阔。 答案 C 2.全球气候变暖给人类的生存和发展带来了严峻的挑战,在此背景下,“新能 源”“低碳”、“节能减排”、“吃干榨尽”等概念愈来愈受到人们的重视。下列 有关说法不正确的是( ) A.太阳能、地热能、生物质能和核聚变能均属于“新能源” B.“低碳”是指采用含碳量低的烃类作为燃料 C.如图,甲烷经一氯甲烷生成低碳烯烃的途径体现了“节能减排”思想 D.让煤变成合成气,把煤“吃干榨尽”,实现了煤的清洁、高效利用 解析 太阳能、地热能、生物质能和核聚变能是“新能源”,A 项正确;“低碳” 主要是指控制二氧化碳的排放量,B 项错误;从题图分析,HCl 循环利用,排出的 水无污染,符合“节能减排”思想,C 项正确;让煤变成合成气,能提高能源利用 率,节能减排,D 项正确。 答案 B 3.(2018·济南月考)下列说法中正确的是( ) A.在化学反应过程中,发生物质变化的同时不一定发生能量变化 B.破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量 时,该反应为吸热反应 C.生成物的总焓大于反应物的总焓时,反应吸热,ΔH>0 D.ΔH 的大小与热化学方程式的化学计量数无关 解析 A.在化学反应过程中,发生物质变化的同时一定发生能量变化;B.根据定 义,应为放热反应;C.正确;D.ΔH 的大小与热化学方程式的计量系数有关。 答案 C 4.(2018·滨州期末)以下关于右图说法正确的是( ) A.表明催化剂可以改变化学反应的热效应 B.表明化学反应遵循能量守恒定律 C.表示某化学反应能量的变化与生成物状态无关 D.表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 解析 由图可知,加入催化剂能降低反应的活化能,但反应热不变,A 项错误; 化学反应一定遵循质量守恒定律,反应物总能量大于生成物总能量,正反应放热, 遵循能量守恒,B 项正确;物质的聚集状态不同,能量不同,该图不能证明反应的 能量变化与生成物的状态的关系,C 项错误;由图像可知,反应物总能量大于生成 物总能量,正反应为放热反应,D 项错误。 答案 B 5.(2018·山东师范大学附中模拟)下列说法或表示方法不正确的是( ) A.盖斯定律实质上是能量守恒定律的体现 B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol -1,含 0.5 mol H2SO4 的浓硫酸与含 1 mol NaOH 的溶液混合,放出的热量大于 57.3 kJ C.由 C(石墨,s)===C(金刚石,s) ΔH>0,可知,石墨比金刚石稳定 D.H 2(g)的燃烧热 ΔH=-285.8 kJ·mol -1 ,则 2H2O(l)===2H2(g)+O 2(g) ΔH= 285.8 kJ·mol-1 解析 反应的热效应只与始态、终态有关,与过程无关,盖斯定律实质上是能量 守恒定律的体现,故 A 正确;浓硫酸稀释过程中也放出热量,所以测得中和过程 所放出的热量大于 57.3 kJ,故 B 正确;能量越低的物质越稳定,由石墨生成金刚 石吸热,说明金刚石能量高,故 C 正确;燃烧热是指 1 mol 物质完全燃烧生成稳 定氧化物时所放出的热量,则 2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1, 故 D 不正确。 答案 D 6.S2Cl2 和 SCl2 均为重要的化工原料,都满足 8 电子稳定结构。 已知:①S2(l)+Cl2(g) S2Cl2(g) ΔH1=x kJ·mol-1 ②S2Cl2(g)+Cl2(g) 2SCl2(g) ΔH2=y kJ·mol-1。 ③相关化学键的键能如下表所示: 化学键 S—S S—Cl Cl—Cl 键能/kJ·mol-1 a b c 下列说法中错误的是( ) A.SCl2 的结构式为 Cl—S—Cl B.S2Cl2 的电子式为 C.y=2b-a-c D.在 S2(l)+2Cl2(g) 2SCl2(s)的反应中,ΔH=(x+y)kJ·mol-1 解析 SCl2 中原子都达到 8 电子稳定结构,S 应该形成两个共价键,Cl 只能形成 1 个共价键,所以 SCl2 的结构式为 Cl—S—Cl,A 项正确;S2Cl2 中原子都达到 8 电 子稳定结构,S 应该形成两个共价键,Cl 只能形成 1 个共价键,所以 S2Cl2 的结构 式为 Cl—S—S—Cl,则其电子式为 ,B 项正确;反 应的焓变等于反应物的总键能减去生成物的总键能,反应②S2Cl2(g)+Cl 2(g) 2SCl2(g)的焓变 ΔH2=y kJ·mol-1=(a+c-2b)kJ·mol-1,C 项错误;反应① 加上反应②可以得到:S2(l)+2Cl2(g) 2SCl2(g),所以该反应的焓变为 ΔH= (x+y)kJ·mol-1,D 项正确。 答案 C 7.(2017·4 月浙江选考)已知断裂 1 mol H2(g)中的 H—H 键需要吸收 436.4 kJ 的能 量,断裂 1 mol O2(g)中的共价键需要吸收 498 kJ 的能量,生成 H2O(g)中的 1 mol H—O 键能放出 462.8 kJ 的能量。下列说法正确的是( ) A.断裂 1 mol H2O 中的化学键需要吸收 925.6 kJ 的能量 B.2H2(g)+O2(g)===2H2O(g) ΔH=-480.4 kJ·mol-1 C.2H2O(l)===2H2(g)+O2(g) ΔH=471.6 kJ·mol-1 D.H2(g)+1 2O2(g)===H2O(l) ΔH=-240.2 kJ·mol-1 解析 本题易错选 A。1 mol H2O 中 2 mol H—O,断裂 1 mol H2O(g)吸收热量为 2×462.8 kJ,A 选项未说明 H2O 状态,故不正确;C、D 中都为 H2O(l),根据题意, 错误;经计算 B 方程式中 ΔH=2×436.4 kJ·mol-1+498 kJ·mol-1-4×462.8 kJ·mol -1=-480.4 kJ·mol-1,故正确。 答案 B B 组 素养提升题 8.(2018·南京市、盐城市一模)H2 与 ICl 的反应分①、②两步进行,其能量曲线如 图所示,下列有关说法错误的是( ) A.反应①、反应②均为放热反应 B.反应①、反应②均为氧化还原反应 C.反应①比反应②的速率慢,与相应正反应的活化能无关 D.反应①、反应②的焓变之和为 ΔH=-218 kJ·mol-1 解析 根据图像可知,反应①和反应②中反应物总能量都大于生成物,则反应①、 ②均为放热反应,A 正确;反应①、②中都存在元素化合价变化,所以反应①、② 都是氧化还原反应,B 正确;反应①比反应②的速率慢,说明反应①中正反应的活 化能较大,反应②中正反应的活化能较小,C 错误;反应①、反应②总的能量变化 为 218 kJ,根据盖斯定律可知,反应①、反应②的焓变之和为 ΔH=-218 kJ·mol- 1,D 正确。 答案 C 9.已知:①H +(aq)+OH -(aq)===H2O(l) ΔH 1=-57.3 kJ·mol -1 ,②H2(g)+ 1 2 O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1,下列有关说法正确的是( ) A.向含 0.1 mol NaOH 的溶液中加入一定体积的 1 mol·L-1 乙二酸,反应中的能量 变化如图所示 B.H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1 C.氢气的燃烧热为 241.8 kJ·mol-1 D.若反应②中水为液态,则同样条件下的反应热:ΔH>ΔH2 解析 A 项乙二酸为弱酸,电离过程吸热,故完全反应时放出热量小于 5.73 kJ;B 项该反应中还包含 Ba2+(aq)+SO2-4 (aq)===BaSO4(s) ΔH,故该反应的 ΔH≠-57.3 kJ·mol-1×2;C 项燃烧热应对应液态水;D 项 ΔH<ΔH2。 答案 A 10.已知:C(s)+O2(g)===CO2(g) ΔH1 CO2(g)+C(s)===2CO(g) ΔH2 2CO(g)+O2(g)===2CO2(g) ΔH3 4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4 3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5 下列关于上述反应焓变的判断正确的是( ) A.ΔH1>0,ΔH3<0 B.ΔH2>0,ΔH4>0 C.ΔH1=ΔH2+ΔH3 D.ΔH3=ΔH4+ΔH5 解析 设题中反应由上到下分别为①、②、③、④、⑤,反应①为碳的燃烧,是 放热反应,ΔH1<0,反应②为吸热反应,ΔH2>0,反应③为 CO 的燃烧,是放热反 应,ΔH3<0,反应④为铁的氧化反应(化合反应),是放热反应,ΔH4<0,A、B 错误; C 项,由于反应①=反应②+反应③,所以 ΔH1=ΔH2+ΔH3,正确;D 项,反应③ =(反应④+反应⑤×2)/3,所以 ΔH3=ΔH4+ΔH5 × 2 3 ,错误。 答案 C 11.(2019·黑龙江哈尔滨三中期中)一些烷烃的燃烧热如下表: 下列说法正确的是( ) A.乙烷燃烧的热化学方程式为 2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g) ΔH=-1 560.8 kJ·mol-1 B.稳定性:正丁烷>异丁烷 C.正戊烷的燃烧热大于 3 531.3 kJ·mol-1 D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多 解析 表示乙烷燃烧的热化学方程式中,H 2O 应为液态,且该反应的 ΔH=-3 121.6 kJ·mol-1,A 错误;由表中燃烧热数据可知,1 mol 正丁烷、异丁烷分别完全 燃烧时,正丁烷放出的热量多,说明等量的两种物质,正丁烷具有的能量高于异 丁烷,则异丁烷更稳定,B 错误;2甲基丁烷的稳定性强于正戊烷,由于 2甲基丁 烷的燃烧热为 3 531.3 kJ·mol-1,故正戊烷的燃烧热大于 3 531.3 kJ·mol-1,C 正确; 由表中数据分析可知,相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越 少,D 错误。 答案 C 12.(2018·北京海淀区期中统考)已知:2H 2O2(l)===2H2O(l)+O 2(g) ΔH=-98 kJ·mol-1。在含少量 I-的溶液中,H2O2 分解反应过程为: ⅰ.H2O2(l)+I-(aq)===H2O(l)+IO-(aq) ΔH1 ⅱ.H2O2(l)+IO-(aq)===H2O(l)+O2(g)+I-(aq) ΔH2 下列说法不正确的是( ) A.ΔH1+ΔH2=ΔH B.I-是 H2O2 分解反应的催化剂 C.欲分解 2 mol H2O2(l),至少需要提供 98 kJ 的热量 D.若生成 1 mol O2,则反应ⅱ转移电子的物质的量为 2 mol 解析 根据盖斯定律,由ⅰ+ⅱ可得:2H2O2(l)===2H2O(l)+O2(g),则有 ΔH1+ΔH2 =ΔH,A 正确;该反应中,I-是过程ⅰ的反应物,是过程ⅱ的生成物,故 I-是 H2O2 分解反应的催化剂,B 正确;反应 2H2O2(l)===2H2O(l)+O2(g)为放热反应,分解 2 mol H2O2(l)放出 98 kJ 的热量,C 错误;反应ⅱ中 I 元素由+1 价降低到-1 价,则 生成 1 mol O2 时转移 2 mol 电子,D 正确。 答案 C 13.美国通用原子能公司(GA)提出的碘硫热化学循环是由反应Ⅰ、Ⅱ、Ⅲ三步反 应组成的(如下图所示),下列有关说法正确的是( ) A.设计该循环是为了制取能源气体 O2 B.整个循环过程中产生 1 mol O2 的同时产生 44.8 L H2 C.图中反应Ⅰ、Ⅱ、Ⅲ均为氧化还原反应 D.图中反应Ⅰ、Ⅱ、Ⅲ均可在常温常压下进行 解析 A 项,O2 不是能源气体,A 错误;B 项,没有说明气体所处的温度和压强, 不能确定气体的体积,B 错误;C 项,都有化合价变化,均为氧化还原反应,C 正 确;D 项,反应Ⅱ是 H2SO4 分解生成 O2、SO2、H2O,不能在常温常压下进行,D 错误。 答案 C 14.(1)一定条件下,化学反应 2H2+O2===2H2O 的能量变化如图所示,则反应生 成液态水的热化学方程式可表示为_____________________________________。 (2)用 O2 将 HCl 转化为 Cl2,可提高效益,减少污染。 传统上该转化通过如下图所示的催化循环实现。 其中,反应①为 2HCl(g)+CuO(s) H2O(g)+CuCl2(s) ΔH1 反 应 ② 生 成 1 mol Cl2 的 反 应 热 为 ΔH2 , 则 总 反 应 的 热 化 学 方 程 式 为 _____________________________________________________ (反应热用 ΔH1 和 ΔH2 表示)。 答案 (1)2H2(g)+O2(g)===2H2O(l) ΔH=2(a-b-c)kJ·mol-1 (2)2HCl(g)+1 2O2(g) H2O(g)+Cl2(g) ΔH=ΔH1+ΔH2 15.碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能 源物质。请回答下列问题: (1)有机物 M 经过太阳光光照可转化成 N,转化过程如下: ΔH=+88.6 kJ·mol-1。则 M、N 相比,较稳定的是________。 (2)已知 CH3OH(l)的燃烧热 ΔH=-726.5 kJ·mol-1,CH3OH(l)+1 2O2(g)===CO2(g)+ 2H2(g) ΔH=-a kJ·mol-1 则 a________726.5(填“>”“<”或“=”) (3)将 Cl2 和 H2O(g)通过灼热的炭层,生成 HCl 和 CO2,当有 1 mol Cl2 参与反应时 释 放 出 145.0 kJ 热 量 , 写 出 该 反 应 的 热 化 学 方 程 式 : _________________________________________________。 (4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混 合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s) +3TiC(s) ΔH=-1 176.0 kJ·mol -1,则反应过程中,每转移 1 mol 电子放出的热 量为________。 (5)已知:①Fe2O3(s)+3C(s,石墨)===2Fe(s)+3CO(g) ΔH=+489.0 kJ·mol-1 ②CO(g)+1 2O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1 ③C(s,石墨)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1 则 4Fe(s)+3O2(g)===2Fe2O3(s) ΔH=________。 解析 (1)M 转化为 N 是吸热反应,所以 N 的能量高,能量越低越稳定,故稳定性 M>N; (2)甲醇燃烧生成 CO2(g)和 H2(g)属于不完全燃烧,放出的热量少,故 a<726.5; (3)有 1 mol Cl2 参与反应时释放出 145.0 kJ 热量,2 mol 氯气反应放热 290.0 kJ,反 应的热化学方程式为 2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+CO 2(g) ΔH=-290.0 kJ·mol-1; (4)铝元素化合价从 0 价升高到+3 价,因此所给反应中转移 12 mol 电子,故每转 移 1 mol 电子放出的热量为 1 176.0 kJ÷12=98.0 kJ; (5)已知:①Fe2O3(s)+3C(s,石墨)===2Fe(s)+3CO(g) ΔH=+489.0 kJ·mol-1 ②CO(g)+1 2O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1 ③C(s,石墨)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1 由盖斯定律可知(③×3-①-②×3)×2 即得到 4Fe(s)+3O 2(g)===2Fe2O3(s) ΔH =-1 641.0 kJ·mol-1。 答案 (1)M (2)< (3)2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+CO2(g) ΔH=-290.0 kJ·mol-1 (4)98.0 kJ (5)-1 641.0 kJ·mol-1 培优训练 8 盖斯定律的应用 1.已知稀氨水和稀硫酸反应生成 1 mol(NH4)2SO4 时 ΔH=-24.2 kJ·mol-1;强酸、 强碱稀溶液反应的中和热 ΔH=-57.3 kJ·mol -1。则 NH3·H2O 的电离热 ΔH 等于 ( ) A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1 C.+69.4 kJ·mol-1 D.+45.2 kJ·mol-1 解析 根据题意先写出热化学方程式:2NH3·H2O(aq)+H2SO4(aq)===(NH4)2SO4(aq) +2H2O(l) ΔH=-24.2 kJ·mol - 1,H +(aq)+OH -(aq)===H2O(l) ΔH=-57.3 kJ·mol -1。再由盖斯定律得,NH3·H2O(aq) NH+4 (aq)+OH -(aq) ΔH=+ 45.2 kJ·mol-1,D 正确。 答案 D 2.黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为: S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g) ΔH=x kJ· mol-1 已知:碳的燃烧热 ΔH1=a kJ· mol-1 S(s)+2K(s)===K2S(s) ΔH2=b kJ· mol-1 2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3=c kJ· mol-1,则 x 为( ) A.3a+b-c B.c-3a-b C.a+b-c D.c-a-b 解析 由碳的燃烧热 ΔH1 =a kJ· mol -1 ,得①C(s) +O 2(g)===CO2(g) ΔH1 =a kJ· mol-1,将另外两个热化学方程式进行编号:②S(s)+2K(s)===K2S(s) ΔH2=b kJ· mol-1③2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3=c kJ· mol-1,运用盖斯定律, 目标反应可由①×3+②-③得到,所以 ΔH=3ΔH1+ΔH2-ΔH3,即 x=3a+b—c。 答案 A 3.(2017·山东青岛质检)已知反应:H 2(g)+Br2(l)===2HBr(g) ΔH=-72 kJ·mol - 1,蒸发 1 mol Br2 (l)需要吸收的能量为 30 kJ,其他相关数据如下表所示: H2(g) Br2(g) HBr(g) 1 mol 分子中的化学键断裂时需要吸收的能 量/kJ 436 a 369 则表中 a 为( ) A.404 B.260 C.230 D.200 解析 由 H2(g)+Br2(l)===2HBr(g) ΔH=-72 kJ·mol -1 Br2(l)===Br2(g) ΔH= +30 kJ·mol -1 可得出 H2(g)+Br 2(g)===2HBr(g) ΔH=(-72 kJ·mol -1)-(+30 kJ·mol -1)=-102(kJ·mol -1),又该反应的 ΔH=(436 kJ·mol -1 +a kJ·mol -1)- (2×369 kJ·mol-1)=-102(kJ·mol-1),所以 a=200 kJ。 答案 D 4.中国科学院上海高等研究院在合成气直接制烯烃的研究中获重大突破。已知: 反应①:C(s)+1 2O2(g)===CO(g) ΔH1 反应②:C(s)+H2O(g)===CO(g)+H2(g) ΔH2 反应③:CO(g)+2H2(g)===CH3OH(g) ΔH3=-90.1 kJ·mol-1 反应④:2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH4=-134.0 kJ·mol-1 反应⑤:3CH3OH(g)===CH3CH===CH2(g)+3H2O(g) ΔH5=-131.0 kJ·mol-1 下列说法正确的是( ) A.ΔH1-ΔH2<0 B.反应②为放热反应 C.3CH3OCH3(g)===2CH3CH===CH2(g)+3H2O(g) ΔH=-103.0 kJ·mol-1 D.3CO(g)+6H2(g)===CH3CH=CH2(g)+3H2O(g) ΔH=-301.3 kJ·mol-1 解析 根据盖斯定律,由①-②可得 H2(g)+1 2O2(g)===H2O(g) ΔH=ΔH1-ΔH2, 而该反应为放热反应,即 ΔH<0,从而推知 ΔH1-ΔH2<0,A 正确;反应②C(s)与 H2O(g)在高温下反应生成 CO(g)和 H2(g),该反应为吸热反应,B 错误;根据盖斯 定律,由⑤×2-④×3 可得 3CH3OCH3(g)===2CH3CH===CH2(g)+3H2O(g) ΔH= (-131.0 kJ·mol -1)×2-(-134.0 kJ·mol -1)×3=+140.0 kJ·mol -1,C 错误;根据 盖斯定律,由③×3+⑤可得 3CO(g)+6H2(g)===CH3CH===CH2(g)+3H2O(g) ΔH =(-90.1 kJ·mol-1)×3+(-131.0 kJ·mol-1)=-401.3 kJ·mol-1,D 错误。 答案 A 5.联氨可用作火箭燃料,回答下列问题: (1)在发射“神舟”七号的火箭推进器中装有肼(N2H4)和过氧化氢,当两者混合时 即产生气体,并放出大量的热。已知: N2H4(l)+2H2O2(l)===N2(g)+4H2O(g) ΔH =-641.6 kJ·mol-1;H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1 若用 6.4 g 液态肼与足量过氧化氢反应生成氮气和液态水,则整个过程中放出的热 量为________。 (2)“嫦娥二号”卫星使用液态四氧化二氮和液态偏二甲肼(C 2H8N2)作推进剂。 N2O4 与偏二甲肼燃烧产物只有 CO2(g)、H2O(g)、N2(g),并放出大量热,已知 10.0 g 液态偏二甲肼与液态四氧化二氮完全燃烧可放出 425 kJ 热量,该反应的热化学方 程式为_____________________________________________________。 (3)已知:①H2(g)===H2(l) ΔH=-0.92 kJ·mol-1 ②O2(g)===O2(l) ΔH=-6.84 kJ·mol-1 ③H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1 ④H2(g)+1 2O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1 请 写 出 液 氢 和 液 氧 生 成 气 态 水 的 热 化 学 方 程 式 : _____________________________________________________________ _________________________________________________________。 解析 (1)6.4 g 液态肼的物质的量为 0.2 mol,由盖斯定律可知,液态肼与过氧化氢 反应生成氮气和液态水的热化学方程式:N2H4(l)+2H 2O2(l)===N2(g)+4H 2O(l) ΔH=-(641.6+4×44)kJ·mol-1=-817.6 kJ·mol-1,故 0.2 mol 液态肼放出的热量 为 0.2 mol×817.6 kJ·mol-1=163.52 kJ。 (2)四氧化二氮与偏二甲肼反应的产物为二氧化碳、氮气和水;根据 10.0 g 偏二甲 肼与四氧化二氮完全燃烧可放出 425 kJ 热量计算。 根据 C2H8N2(l)+2N2O4(l)===2CO2(g)+4H2O(g)+3N2(g) ΔH, 得 ΔH=-425 kJ·mol-1÷ 10.0 g 60 g·mol-1 =-2 550.0 kJ·mol-1。 热化学方程式为 C2H8N2(l)+2N 2O4(l)===2CO2(g)+4H 2O(g)+3N 2(g) ΔH=-2 550.0 kJ·mol-1。 (3)将④+③-①-②×1 2 得:H2(l)+1 2O2(l)===H2O(g) ΔH=-237.46 kJ·mol-1。 答案 (1)163.52 kJ (2)C2H8N2(l)+2N2O4(l)===2CO2(g)+4H2O(g)+3N2(g) ΔH=-2 550.0 kJ·mol-1 (3)H2(l)+1 2O2(l)===H2O(g) ΔH=-237.46 kJ·mol-1 6.(2018·山东聊城一模节选)合成气(CO、H2)在合成有机物中应用广泛。工业上常 用天然气与水蒸气或二氧化碳反应等方法制取。回答下列问题: (1)一定条件下,0.25 mol CH4 与水蒸气完全反应制备“合成气”时吸收 51.5 kJ 的 热量,则该反应的热化学方程式为 ____________________________________________________________(Ⅳ)。 (2)合成气可消除 NO 的污染,2NO(g)+2CO(g) 2CO 2(g)+N2(g) ΔH=- 746 kJ·mol-1(Ⅰ) 2NO(g)+2H2(g)===N2(g)+2H2O(g),ΔH=-659 kJ·mol-1(Ⅱ) 则反应 CH4(g)+4NO(g)===CO2(g)+2N2(g)+2H2O(Ⅲ)的 ΔH=________。 (3)合成气可用于合成甲醇,方法有两种如下: CO(g)+2H2(g) CH3OH(g) ΔH1=a kJ·mol-1 反应① CO2(g)+3H2(g) CH3OH(g)+H2O(l) ΔH2=b kJ·mol-1 反应② 欲利用上述热化学方程式求出 CO 的燃烧热(实际结果为 ΔH3=c kJ·mol -1),还缺 少 一 个 热 化 学 方 程 式 ( 其 中 不 含 CH3OH) , 该 热 化 学 方 程 式 为 ______________________________________________________________ _____________________________________________________________(焓变用 a、 b、c 表示)。 解析 (1)0.25 mol CH4 反应时吸收 51.5 kJ 的热量,故 1 mol CH4 参加反应时吸收 的热量为 51.5× 1 0.25kJ=206 kJ,故反应的热化学方程式 CH4(g)+H2O(g)===CO(g) +3H2(g) ΔH=+206 kJ·mol-1(Ⅳ) (2)经分析知目标方程式(Ⅲ)=(Ⅳ)+ 1 2(Ⅰ)+3 2(Ⅱ),故 ΔH=(+206 kJ·mol -1)+1 2 ×(-746 kJ·mol-1)+3 2 ×(-659 kJ·mol-1)=-1 155.5 kJ·mol-1 (3)CO(g)+2H2(g) CH3OH(g) ΔH1=a kJ·mol-1 ① CO2(g)+3H2(g) CH3OH(g)+H2O(l) ΔH2=b kJ·mol-1 ② CO(g)+1 2O2(g)===CO2(g) ΔH3=c kJ·mol-1 ③ 根据盖斯定律:由②+③-①得:H2(g)+1 2O2(g)===H2O(l) ΔH=(b+c-a)kJ·mol -1。 答案 (1)CH4(g)+H2O(g)===CO(g)+3H2(g),ΔH=+206 kJ·mol-1 (2)-1 155.5 kJ·mol-1 (3)H2(g)+1 2O2(g)===H2O(l) ΔH=(b+c-a)kJ·mol-1查看更多