湖南版2021高考化学一轮复习专题8化学反应速率与化学平衡精练含解析
专题8 化学反应速率与化学平衡
【考情探究】
课
标
解
读
考点
化学反应速率
化学平衡 化学反应进行的方向
化学平衡的相关计算
解读
1.了解化学反应速率的概念和定量表示方法
2.了解反应活化能的概念,了解催化剂的重要作用
3.理解外界条件(浓度、温度、压强、催化剂等)对反应速率的影响,能用相关理论解释其一般规律
1.了解化学反应的可逆性及化学平衡的建立
2.掌握化学平衡的特征
3.理解外界条件(浓度、温度、压强、催化剂等)对化学平衡的影响,能用相关理论解释其一般规律
4.了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用
1.能正确计算化学反应的转化率(α)
2.了解化学平衡常数(K)的含义,能利用化学平衡常数进行相关计算
考情分析
本专题是历年高考命题的热点内容,命题形式包含选择题、填空题,并以定性、定量相结合的方式联系生产实际进行考查。考查内容主要包括化学反应速率计算及影响因素、影响化学平衡的因素及规律、平衡状态的判断、平衡常数和转化率的计算等,同时渗透对计算能力、数形结合能力、语言组织能力等的考查
备考指导
本专题是证据推理与模型认知素养、变化观念与平衡思想素养的基本载体。备考时要将知识问题化,在实际问题解决过程中掌握化学反应速率与化学平衡的相关知识
【真题探秘】
基础篇 固本夯基
【基础集训】
- 14 -
考点一 化学反应速率
1.(2020届湖南天壹联盟入学考,14)下列实验操作、现象和结论都正确且有相关性的是( )
选项
操作
现象
结论
A
将10 mL 0.1 mol·L-1 KI溶液和2 mL 0.1 mol·L-1 FeCl3溶液混合,在混合液中滴加KSCN溶液
溶液变红色
Fe3+和I-反应生成I2和Fe2+的反应是可逆反应
B
常温下,将两块形状相近的铝片分别插入稀硫酸、浓硫酸中
浓硫酸中产生气泡较快
其他条件相同时,反应物浓度越大,反应越快
C
分别向含有10 mL过氧化氢溶液的两支试管中加入1 g MnO2、1 g Fe2O3粉末
加入MnO2的一组产生气泡较快
MnO2对过氧化氢分解的催化效率高于Fe2O3
D
用注射器吸入NO2,封堵针尖处,将注射器压缩为原来的一半
气体颜色比起始时浅
加压后,NO2转变为无色的N2O4
答案 A
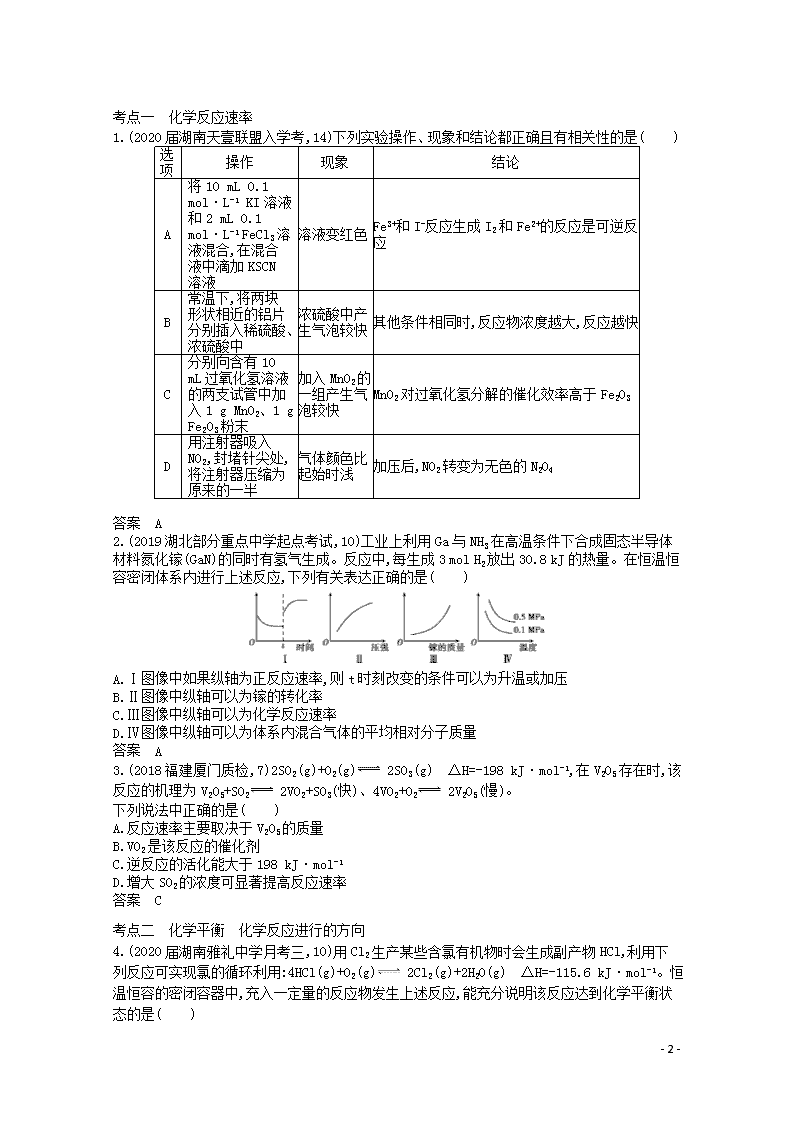
2.(2019湖北部分重点中学起点考试,10)工业上利用Ga与NH3在高温条件下合成固态半导体材料氮化镓(GaN)的同时有氢气生成。反应中,每生成3 mol H2放出30.8 kJ的热量。在恒温恒容密闭体系内进行上述反应,下列有关表达正确的是( )
A.Ⅰ图像中如果纵轴为正反应速率,则t时刻改变的条件可以为升温或加压
B.Ⅱ图像中纵轴可以为镓的转化率
C.Ⅲ图像中纵轴可以为化学反应速率
D.Ⅳ图像中纵轴可以为体系内混合气体的平均相对分子质量
答案 A
3.(2018福建厦门质检,7)2SO2(g)+O2(g) 2SO3(g) ΔH=-198 kJ·mol-1,在V2O5存在时,该反应的机理为V2O5+SO2 2VO2+SO3(快)、4VO2+O2 2V2O5(慢)。
下列说法中正确的是( )
A.反应速率主要取决于V2O5的质量
B.VO2是该反应的催化剂
C.逆反应的活化能大于198 kJ·mol-1
D.增大SO2的浓度可显著提高反应速率
答案 C
考点二 化学平衡 化学反应进行的方向
4.(2020届湖南雅礼中学月考三,10)用Cl2生产某些含氯有机物时会生成副产物HCl,利用下列反应可实现氯的循环利用:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是( )
- 14 -
A.气体的质量不再改变
B.氯化氢的转化率不再改变
C.断开4 mol H—Cl键的同时生成4 mol H—O键
D.n(HCl)∶n(O2)∶n(Cl2)∶n(H2O)=4∶1∶2∶2
答案 B
5.(2019安徽定远重点中学月考,11)在密闭容器中,反应X2(g)+Y2(g)2XY(g) ΔH>0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
A.图Ⅰ是升高温度的变化情况
B.图Ⅱ是扩大容器体积的变化情况
C.图Ⅲ是增大压强的变化情况
D.图Ⅲ是升高温度的变化情况
答案 A
6.(2018河北衡水中学大联考,24)S2Cl2和SCl2均为重要的化工原料。
已知:Ⅰ.S2(l)+Cl2(g) S2Cl2(g) ΔH1;
Ⅱ.S2Cl2(g)+Cl2(g) 2SCl2(g) ΔH2;
Ⅲ.相关化学键的键能如下表所示:
化学键
S—S
S—Cl
Cl—Cl
键能/kJ·mol-1
a
b
c
请回答下列问题:
(1)SCl2的结构式为 。
(2)若反应Ⅱ正反应的活化能E1=d kJ·mol-1,则逆反应的活化能E2= kJ·mol-1(用含a、b、c、d的代数式表示)。
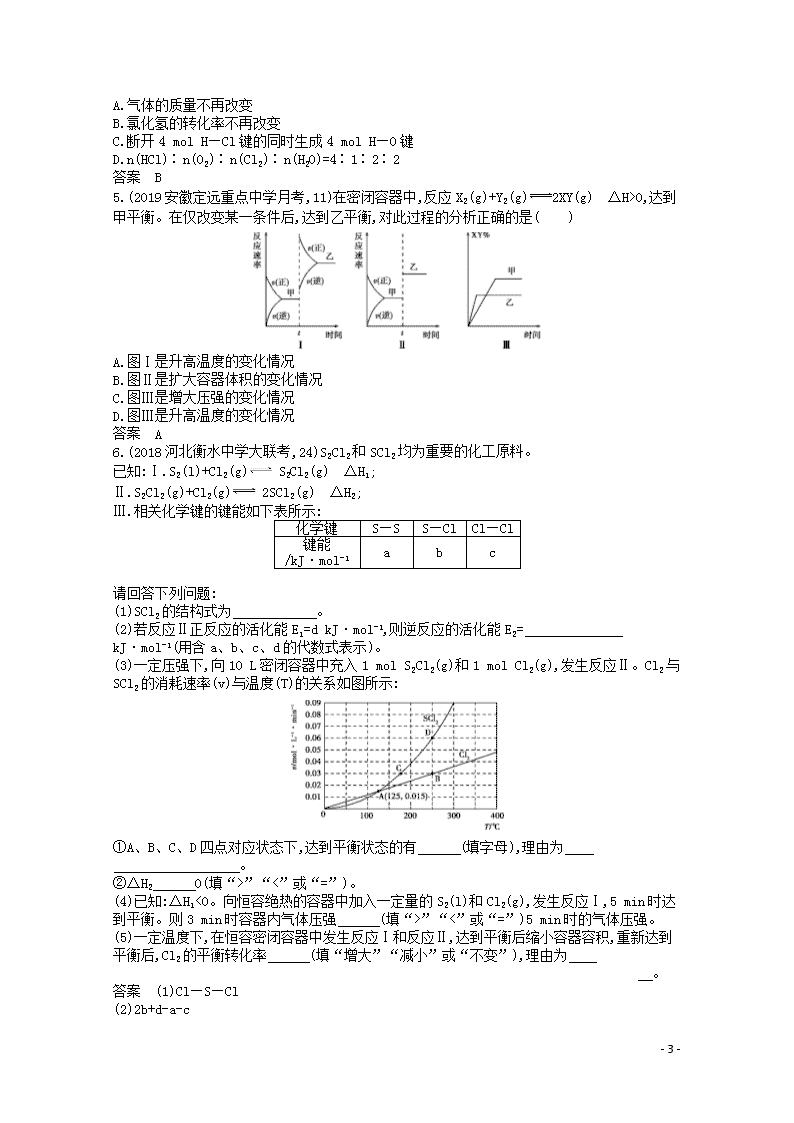
(3)一定压强下,向10 L密闭容器中充入1 mol S2Cl2(g)和1 mol Cl2(g),发生反应Ⅱ。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图所示:
①A、B、C、D四点对应状态下,达到平衡状态的有 (填字母),理由为
。
②ΔH2 0(填“>”“<”或“=”)。
(4)已知:ΔH1<0。向恒容绝热的容器中加入一定量的S2(l)和Cl2(g),发生反应Ⅰ,5 min时达到平衡。则3 min时容器内气体压强 (填“>”“<”或“=”)5 min时的气体压强。
(5)一定温度下,在恒容密闭容器中发生反应Ⅰ和反应Ⅱ,达到平衡后缩小容器容积,重新达到平衡后,Cl2的平衡转化率 (填“增大”“减小”或“不变”),理由为
。
答案 (1)Cl—S—Cl
(2)2b+d-a-c
- 14 -
(3)①BD B、D两点对应的状态下,用同一物质表示的正、逆反应速率相等(其他合理答案也可) ②<
(4)<
(5)不变 反应Ⅰ和反应Ⅱ均为反应前后气体分子总数相等的反应,压强对平衡没有影响
考点三 化学平衡的相关计算
7.(2019河北邯郸重点高中开学检测,21)在恒温、恒容条件下发生下列反应:2X2O5(g)4XO2(g)+O2(g) ΔH>0,T温度下的部分实验数据为:
t(s)
0
50
100
150
c(X2O5)(mol/L)
4.00
2.50
2.00
2.00
下列说法不正确的是( )
A.T温度下的平衡常数K=64(mol/L)3,100 s时X2O5的转化率为50%
B.50 s内X2O5的分解速率为0.03 mol/(L·s)
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
D.若只将恒容改变为恒压,其他条件都不变,则平衡时X2O5的转化率和平衡常数都不变
答案 D
8.(2020届湖南雅礼中学月考三,14)工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0。在一定条件下,向体积为1 L的恒容密闭容器中充入1 mol CH4(g)和1 mol H2O(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )
A.达到平衡时,CH4(g)的转化率为75%
B.0~10 min内,v(CO)=0.075 mol·L-1·min-1
C.该反应的化学平衡常数K=0.187 5
D.当CH4(g)的消耗速率与H2(g)的消耗速率相等时,反应到达平衡
答案 C
9.(2019河南八市重点高中一测,19)目前,处理烟气中的SO2常采用两种方法。
Ⅰ.碱液吸收法
25 ℃时,Kb(NH3·H2O)=1.8×10-5;H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5。
第1步:用过量的浓氨水吸收SO2,并在空气中氧化;
第2步:加入石灰水,发生反应Ca2++2OH-+2NH4++SO42-CaSO4↓+2NH3·H2O K。
(1)25 ℃时0.1 mol·L-1(NH4)2SO3溶液的pH (填“>”“<”或“=”)7。
(2)第2步中反应的K= 。
Ⅱ.水煤气还原法
已知:①2CO(g)+SO2(g)S(l)+2CO2(g)
ΔH1=-37.0 kJ·mol-1
②2H2(g)+SO2(g)S(l)+2H2O(g)
ΔH2=+45.4 kJ·mol-1
③CO的燃烧热ΔH3=-283 kJ·mol-1
(3)表示液态硫(S)的燃烧热的热化学方程式为 。
(4)反应②中,正反应活化能E1 (填“>”“<”或“=”)ΔH2。
- 14 -
(5)在一定压强下,发生反应①。平衡时SO2的转化率[α(SO2)]与投料比[n(CO)n(SO2)=y]、温度(T)的关系如图所示。
比较平衡时CO的转化率[α(CO)]:N (填“>”“<”或“=”,下同)M。逆反应速率:N P。
(6)某温度下,向10 L恒容密闭容器中充入2 mol H2、2 mol CO和2 mol SO2发生反应①、②,第5 min时达到平衡,测得混合气体中CO2、H2O(g)的物质的量分别为1.6 mol、1.8 mol。
该温度下,反应②的平衡常数K为 。其他条件不变,在第7 min时缩小容器体积,α(SO2) (填“增大”“减小”或“不变”)。
答案 Ⅰ.(1)> (2)4.3×1013 Ⅱ.(3)S(l)+O2(g)SO2(g) ΔH=-529 kJ·mol-1 (4)> (5)> < (6)2 700 增大
综合篇知能转换
【综合集训】
变化观念与平衡思想 化学平衡状态的标志与图像
1.(2019湖南长沙一中月考四,11)可逆反应mA(g)+nB(g)pC(g)+qD(g)的v-t图像如图甲所示,若其他条件不变,只是在反应前加入合适的催化剂,则其v-t图像如图乙所示:
①a1>a2 ②a1
b2 ④b1t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧图乙中阴影部分面积更大
以下说法中正确的是( )
A.②③⑤⑧ B.①④⑥⑧
C.②④⑤⑦ D.①③⑥⑦
答案 C
2.(2019湖南雅礼中学月考五,10)I2在KI溶液中存在平衡:I2(aq)+I-(aq) I3-(aq)。某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态)。下列说法正确的是( )
①反应I2(aq)+I-(aq) I3-(aq)的ΔH>0
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
- 14 -
③若反应进行到状态D时,一定有v正>v逆
④状态A与状态B相比,状态A的c(I2)大
⑤保持温度不变,向该混合溶液中加水,c(I3-)/c(I2)将变大
A.只有①② B.只有②③ C.①③④ D.①③⑤
答案 B
3.(2018湖南株洲教学质量统一检测一,11)已知反应:2SO3(g) 2SO2(g)+O2(g) ΔH>0,某温度下,将2 mol SO3置于10 L密闭容器中,反应达平衡后,SO3的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法中正确的是( )
①由图甲推断,B点SO2的平衡浓度为0.3 mol·L-1
②由图甲推断,A点对应温度下的平衡常数为1.25×10-3
③达平衡后,压缩容器容积,则反应速率变化图像可以用图乙表示
④相同压强、不同温度下SO3的转化率与温度关系如图丙所示
A.①② B.②③ C.③④ D.①④
答案 B
证据推理与模型认知 化学平衡的计算
4.(2019湖南雅礼中学月考四,14)甲醇脱氢制取甲醛的反应为CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化的曲线如下图所示。下列有关说法正确的是( )
A.在T1 K时,该反应的平衡常数为8.1
B.若增大体系压强,曲线将向上平移
C.脱氢反应的ΔH<0
D.600 K时,Y点甲醇的v(正)0。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是( )
容器
编号
物质的起始浓度(mol/L)
物质的平衡浓度(mol/L)
c(NO2)
c(NO)
c(O2)
c(O2)
Ⅰ
0.6
0
0
0.2
Ⅱ
0.3
0.5
0.2
Ⅲ
0
0.5
0.35
A.反应达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为1∶1
B.反应达平衡时,容器Ⅱ中c(O2)c(NO2)的值比容器Ⅰ中的大
C.反应达平衡时,容器Ⅲ中NO的体积分数大于50%
D.当温度改变为T2时,若k正=k逆,则T2>T1
答案 D
8.(2018湖南H11教育联盟联考,14)某温度下,在三个容积均为1 L的恒容密闭容器中仅发生反应:2NO(g)+Br2(g) 2NOBr(g)(正反应放热)。下列说法中正确的是( )
容器
编号
物质的起始
浓度(mol·L-1)
物质的平衡
浓度(mol·L-1)
c(NO)
c(Br2)
c(NOBr)
c(NOBr)
Ⅰ
0.3
0.15
0.1
0.2
Ⅱ
0.4
0.2
0
Ⅲ
0
0
0.2
A.容器Ⅱ达平衡所需的时间为4 min,则v(Br2)=0.05 mol/(L·min)
B.达平衡时,容器Ⅰ与容器Ⅲ中的总压强之比为2∶1
C.升高温度,逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
D.达平衡时,容器Ⅱ中c(Br2)/c(NOBr)比容器Ⅲ中的小
答案 D
应用篇 知行合一
【应用集训】
- 14 -
1.(2019 5·3原创)甲烷制取氢气的反应方程式为CH4(g)+H2O(g) CO(g)+3H2(g),在三个容积均为1 L的恒温恒容密闭容器中,按下表中起始数据投料(忽略副反应)。甲烷的平衡转化率与温度、压强的关系如下图所示。
容器
起始物质的量/mol
CH4的平衡转化率
CH4
H2O
CO
H2
Ⅰ
0.1
0.1
0
0
50%
Ⅱ
0.1
0.1
0.1
0.3
/
Ⅲ
0
0.1
0.2
0.6
/
下列说法正确的是( )
A.起始时,容器Ⅱ中甲烷的正反应速率大于甲烷的逆反应速率
B.该反应为吸热反应,压强:p2>p1
C.达到平衡时,容器Ⅰ、Ⅱ中CO的物质的量满足:n(CO)ⅡpⅢ
答案 B
2.(2019 5·3原创冲刺卷一,12)下列有关对应图像的说法正确的是( )
A.据(1)知,某温度下,平衡状态由A变到B时,平衡常数K(A)c
D.图(4)所示体系中气体平均摩尔质量:M(a)”“<”或“=”,下同),压强:p1 p2。
ⅱ.平衡时A点处氯气的体积分数为 (计算结果保留三位有效数字)。
答案 (1)-114.5 kJ· mol-1
(2)该反应是放热反应,温度较低有利于提高反应物的转化率,同时为了使催化剂活性提高,增大反应速率,温度不能太高
(3)①bd ②2∶1 ③ⅰ.> > ⅱ.34.4%
【五年高考】
考点一 化学反应速率
1.(2018江苏单科,10,2分)下列说法正确的是( )
A.氢氧燃料电池放电时化学能全部转化为电能
B.反应4Fe(s)+3O2(g) 2Fe2O3(s)常温下可自发进行,该反应为吸热反应
C.3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023
D.在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
答案 C
2.(2017江苏单科,10,2分)H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是( )
- 14 -
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
答案 D
3.(2016北京理综,8,6分)下列食品添加剂中,其使用目的与反应速率有关的是( )
A.抗氧化剂 B.调味剂 C.着色剂 D.增稠剂
答案 A
4.(2018课标Ⅲ,28,15分)三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式 。
(2)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g) SiH2Cl2(g)+SiCl4(g) ΔH1=48 kJ·mol-1
3SiH2Cl2(g) SiH4(g)+2SiHCl3(g) ΔH2=-30 kJ·mol-1
则反应4SiHCl3(g) SiH4(g)+3SiCl4(g)的ΔH为 kJ·mol-1。
(3)对于反应2SiHCl3(g) SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
①343 K时反应的平衡转化率α= %。平衡常数K343 K= (保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是 ;要缩短反应达到平衡的时间,可采取的措施有 、 。
③比较a、b处反应速率大小:va vb(填“大于”“小于”或“等于”)。反应速率v=v正-v逆=k正xSiHCl32-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处的v正v逆= (保留1位小数)。
答案 (1)2SiHCl3+3H2O (HSiO)2O+6HCl
(2)114
- 14 -
(3)①22 0.02
②及时移去产物 改进催化剂 提高反应物压强(浓度)
③大于 1.3
考点二 化学平衡 化学反应进行的方向
5.(2019海南单科,3,2分)反应C2H6(g) C2H4(g)+H2(g) ΔH>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是( )
A.增大容器容积 B.升高反应温度
C.分离出部分氢气 D.等容下通入惰性气体
答案 D
6.(2019上海单科,19,2分)已知反应式:mX(g)+nY(?) pQ(s)+2mZ(g)。已知反应已达平衡,此时c(X)=0.3 mol/L,其他条件不变,若容器缩小到原来的12,c(X)=0.5 mol/L,下列说法正确的是( )
A.反应向逆方向移动 B.Y可能是固体或液体
C.系数n>m D.Z的体积分数减小
答案 C
7.(2019浙江单科,17,2分)下列说法正确的是( )
A.H2(g)+I2(g) 2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变
B.C(s)+H2O(g) H2(g)+CO(g),碳的质量不再改变说明反应已达平衡
C.若压强不再随时间变化能说明反应2A(?)+B(g) 2C(?)已达平衡,则A.C不能同时是气体
D.1 mol N2和3 mol H2反应达到平衡时H2转化率为10%,放出热量Q1;在相同温度和压强下,当2 mol NH3分解为N2和H2的转化率为10%时,吸收热量Q2,Q2不等于Q1
答案 B
8.(2018天津理综,5,6分)室温下,向圆底烧瓶中加入1 mol C2H5OH和含1 mol HBr的氢溴酸,溶液中发生反应:C2H5OH+HBr C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4 ℃和78.5 ℃。下列有关叙述错误的是( )
A.加入NaOH,可增大乙醇的物质的量
B.增大HBr浓度,有利于生成C2H5Br
C.若反应物均增大至2 mol,则两种反应物平衡转化率之比不变
D.若起始温度提高至60 ℃,可缩短反应达到平衡的时间
答案 D
9.(2019课标Ⅲ,28,15分)近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl)∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:
可知反应平衡常数K(300 ℃) K(400 ℃)(填“大于”或“小于”)。设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据计算K(400 ℃)= (列出计
- 14 -
算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是 。
(2)Deacon直接氧化法可按下列催化过程进行:
CuCl2(s) CuCl(s)+12Cl2(g) ΔH1=83 kJ·mol-1
CuCl(s)+12O2(g) CuO(s)+12Cl2(g)
ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g) CuCl2(s)+H2O(g)
ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)的ΔH= kJ·mol-1。
(3)在一定温度的条件下,进一步提高HCl的转化率的方法是 。(写出2种)
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
负极区发生的反应有 (写反应方程式)。电路中转移1 mol电子,需消耗氧气 L(标准状况)。
答案 (1)大于 (0.42)2×(0.42)2(1-0.84)4×(1-0.21)c0
O2和Cl2分离能耗较高、HCl转化率较低
(2)-116
(3)增加反应体系压强、及时除去产物
(4)Fe3++e- Fe2+,4Fe2++O2+4H+ 4Fe3++2H2O 5.6
考点三 化学平衡的相关计算
10.(2015天津理综,6,6分)某温度下,在2 L的密闭容器中,加入1 mol X(g)和2 mol Y(g)发生反应:
X(g)+mY(g) 3Z(g)
平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1 mol Z(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1∶1
D.第二次平衡时,Z的浓度为0.4 mol·L-1
答案 D
11.(2019课标Ⅱ,27,节选)环戊二烯()是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:(g) (g)+H2(g) ΔH1=100.3 kJ·mol-1 ①
H2(g)+I2(g) 2HI(g) ΔH2=-11.0 kJ·mol-1 ②
对于反应:(g)+I2(g) (g)+2HI(g) ③ ΔH3= kJ·mol-1。
- 14 -
(2)某温度下,等物质的量的碘和环戊烯()在刚性容器内发生反应③,起始总压为105 Pa,平衡时总压增加了20%,环戊烯的转化率为 ,该反应的平衡常数Kp= Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有 (填标号)。
A.通入惰性气体 B.提高温度
C.增加环戊烯浓度 D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是 (填标号)。
A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L-1
答案 (1)89.3
(2)40% 3.56×104 BD
(3)CD
12.(2019课标Ⅰ,28,14分)水煤气变换[CO(g)+H2O(g) CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴Co(s),平衡后气体中H2的物质的量分数为0.025 0。②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.019 2。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO H2(填“大于”或“小于”)。
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为 (填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
可知水煤气变换的ΔH 0(填“大于”“等于”或“小于”)。该历程中最大能垒(活化能)E正= eV,写出该步骤的化学方程式 。
(4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的pH2O和pCO相等、pCO2和pH2相等。
- 14 -
计算曲线a的反应在30~90 min内的平均速率
- 14 -