天津专用2020高考化学二轮复习热点专攻8化学反应速率与化学平衡的图表及图像分析训练含解析
热点专攻8 化学反应速率与化学平衡的图表及图像分析
1.(2019天津静海第一学期四校联考)在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0,下列对图像的分析中不正确的是( )
A.图Ⅰ研究的是t0时升高温度对反应速率的影响
B.图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响
C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
答案:C
解析:t0时升高温度,平衡逆向移动,逆反应速率大于正反应速率,与图像相符,A项正确;反应前后气体的体积不变,压强改变对平衡移动无影响,图Ⅱt0时正、逆反应速率都增大,且正、逆反应速率相等,平衡不移动,应是加入催化剂或增大压强的影响,B项正确;如加入催化剂,平衡不移动,CO的转化率应相等,C项错误;由图可知乙达到平衡用时较少,如是温度的影响,乙的温度应较高,D项正确。
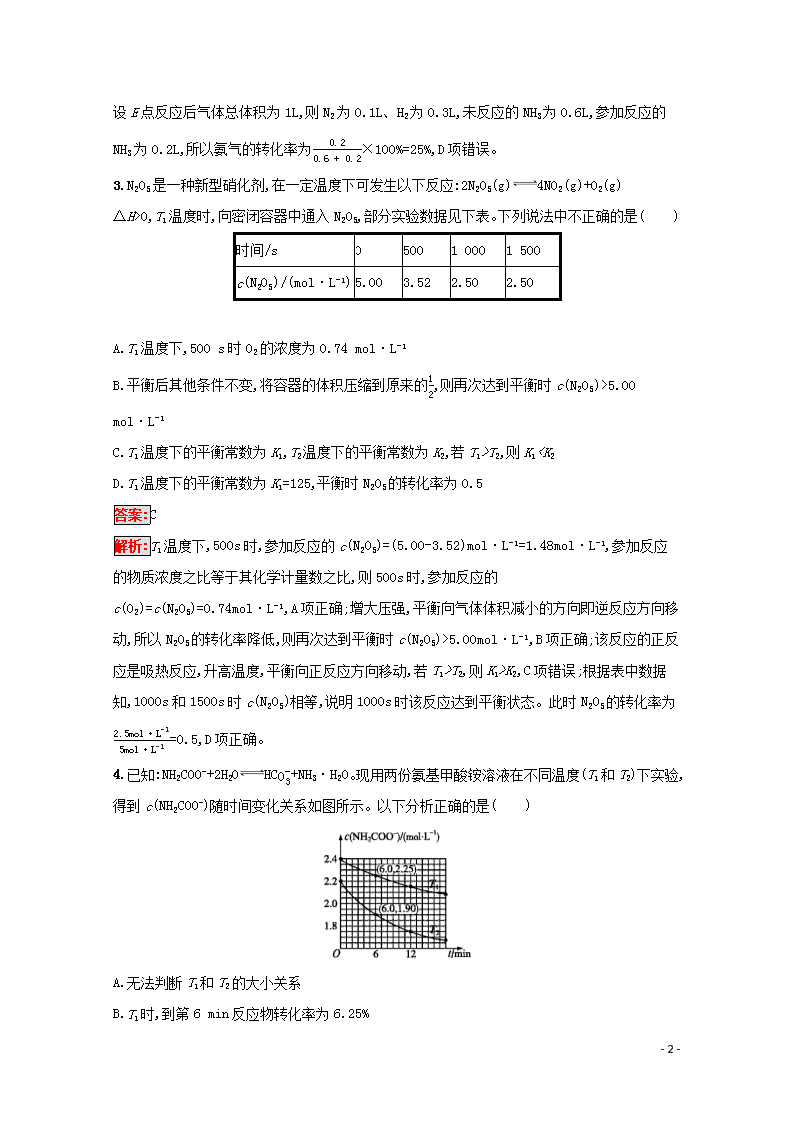
2.一定条件下,向一密闭容器中充入一定量的NH3,反应2NH3(g)N2(g)+3H2(g)达到平衡时N2的体积分数与温度、压强的关系如图所示。下列说法正确的是( )
A.压强:p1>p2
B.F、G两点对应的平衡常数:KF
p1,A项错误;由图像可知该反应为吸热反应,所以温度越高,K越大,B项正确;E点为平衡点,应为3v正(NH3)=2v逆(H2
- 4 -
),C项错误;假设E点反应后气体总体积为1L,则N2为0.1L、H2为0.3L,未反应的NH3为0.6L,参加反应的NH3为0.2L,所以氨气的转化率为0.20.6+0.2×100%=25%,D项错误。
3.N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)4NO2(g)+O2(g) ΔH>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见下表。下列说法中不正确的是( )
时间/s
0
500
1 000
1 500
c(N2O5)/(mol·L-1)
5.00
3.52
2.50
2.50
A.T1温度下,500 s时O2的浓度为0.74 mol·L-1
B.平衡后其他条件不变,将容器的体积压缩到原来的12,则再次达到平衡时c(N2O5)>5.00 mol·L-1
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K15.00mol·L-1,B项正确;该反应的正反应是吸热反应,升高温度,平衡向正反应方向移动,若T1>T2,则K1>K2,C项错误;根据表中数据知,1000s和1500s时c(N2O5)相等,说明1000s时该反应达到平衡状态。此时N2O5的转化率为2.5mol·L-15mol·L-1=0.5,D项正确。
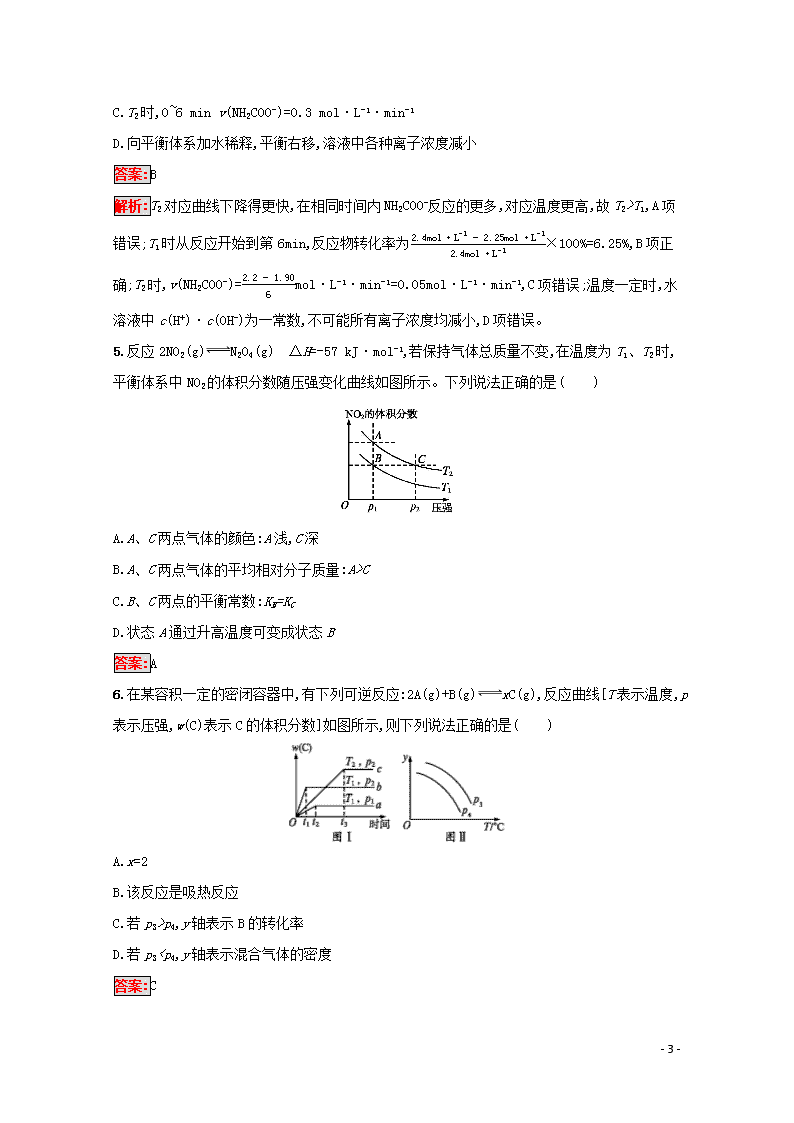
4.已知:NH2COO-+2H2OHCO3-+NH3·H2O。现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示。以下分析正确的是( )
A.无法判断T1和T2的大小关系
B.T1时,到第6 min反应物转化率为6.25%
- 4 -
C.T2时,0~6 min v(NH2COO-)=0.3 mol·L-1·min-1
D.向平衡体系加水稀释,平衡右移,溶液中各种离子浓度减小
答案:B
解析:T2对应曲线下降得更快,在相同时间内NH2COO-反应的更多,对应温度更高,故T2>T1,A项错误;T1时从反应开始到第6min,反应物转化率为2.4mol·L-1-2.25mol·L-12.4mol·L-1×100%=6.25%,B项正确;T2时,v(NH2COO-)=2.2-1.906mol·L-1·min-1=0.05mol·L-1·min-1,C项错误;温度一定时,水溶液中c(H+)·c(OH-)为一常数,不可能所有离子浓度均减小,D项错误。
5.反应2NO2(g)N2O4(g) ΔH=-57 kJ·mol-1,若保持气体总质量不变,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
A.A、C两点气体的颜色:A浅,C深
B.A、C两点气体的平均相对分子质量:A>C
C.B、C两点的平衡常数:KB=KC
D.状态A通过升高温度可变成状态B
答案:A
6.在某容积一定的密闭容器中,有下列可逆反应:2A(g)+B(g)xC(g),反应曲线[T表示温度,p表示压强,w(C)表示C的体积分数]如图所示,则下列说法正确的是( )
A.x=2
B.该反应是吸热反应
C.若p3>p4,y轴表示B的转化率
D.若p3T2、ΔH<0、p10),已知P是可自由滑动的活塞。在相同温度时关闭K,向A、B容器中都分别充入2 mol A2和1 mol B2气体,此时两容器的容积相等。两容器分别在500 ℃达平衡时,A中C的浓度为c1 mol·L-1,放出热量b kJ,B中C的浓度为c2 mol·L-1,放出热量c kJ。下列说法中正确的是( )
A.500 ℃达平衡时有:c1>c2
B.500 ℃达平衡时有:a>b>c
C.达平衡后打开K,容器B的容积将减小
D.此反应的平衡常数随温度升高而增大
答案:C
解析:该反应的特点:正反应是气体体积减小的放热反应。达平衡时B容器相当于对A容器中平衡体系加压,故有:c2>c1,A项错误;平衡时,充入的2molA2和1molB2不可能完全反应,且B容器比A容器中反应物的转化率大,故有:a>c>b,B项错误;达平衡后,A容器内的压强比B容器内的压强小,打开K,活塞P向左移动,B容器的容积将减小,C项正确;由于该反应的正反应是放热反应,平衡常数随温度升高而减小,D项错误。
- 4 -