- 2021-04-16 发布 |
- 37.5 KB |
- 71页


文档介绍
2018届二轮复习化学反应速率与化学平衡课件(71张)(全国通用)
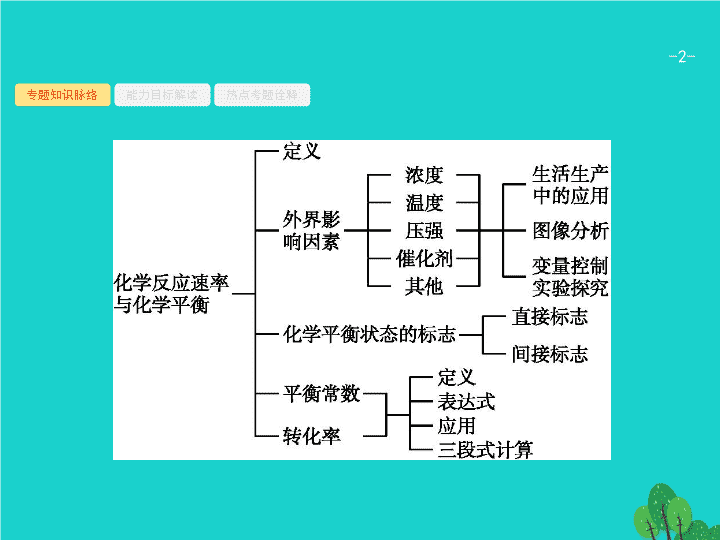
第 3 讲 化学反应速率与化学平衡 - 2 - 专题知识脉络 能力目标解读 热点考题诠释 - 3 - 专题知识脉络 能力目标解读 热点考题诠释 - 4 - 专题知识脉络 能力目标解读 热点考题诠释 - 5 - 专题知识脉络 能力目标解读 热点考题诠释 - 6 - 专题知识脉络 能力目标解读 热点考题诠释 1 2 3 1 .(2014 课标全国 Ⅰ ) 已知分解 1 mol H 2 O 2 放出热量 98 kJ 。在含少量 I - 的溶液中 ,H 2 O 2 分解的机理为 : 下列有关该反应的说法正确的是 ( ) A. 反应速率与 I - 浓度有关 B.IO - 也是该反应的催化剂 C. 反应活化能等于 98 kJ·mol -1 D. v (H 2 O 2 )= v (H 2 O)= v (O 2 ) 答案 解析 解析 关闭 在一个化学反应的过程中 , 较慢的过程对整个反应起决定作用 ; 化学反应的活化能与反应热无关 ; 一个化学反应 , 用不同的反应物或生成物表示反应速率 , 速率之比等于化学方程式中相应物质的计量数之比。 答案 解析 关闭 A - 7 - 专题知识脉络 能力目标解读 热点考题诠释 1 2 3 - 8 - 专题知识脉络 能力目标解读 热点考题诠释 1 2 3 (2) 图 (a) 为丙烯腈产率与反应温度的关系曲线 , 最高产率对应的温度为 460 ℃ 。低于 460 ℃ 时 , 丙烯腈的产率 ( 填 “ 是 ” 或 “ 不是 ”) 对应温度下的平衡产率 , 判断理由是 ; 高于 460 ℃ 时 , 丙烯腈产率降低的可能原因是 ( 双选 , 填标号 ) 。 A. 催化剂活性降低 B. 平衡常数变大 C. 副反应增多 D. 反应活化能增大 - 9 - 专题知识脉络 能力目标解读 热点考题诠释 1 2 3 (3) 丙烯腈和丙烯醛的产率与 n ( 氨 ) /n ( 丙烯 ) 的关系如图 (b) 所示。由图可知 , 最佳 n ( 氨 )/n( 丙烯 ) 约为 , 理由是 。进料气氨、空气、丙烯的理论体积比约为 。 答案 (1) 两个反应均为放热量大的反应 降低温度、降低压强 催化剂 (2) 不是 该反应为放热反应 , 平衡产率应随温度升高而降低 AC (3)1 该比例下丙烯腈产率最高 , 而副产物丙烯醛产率最低 1 ∶ 7.5 ∶ 1 - 10 - 专题知识脉络 能力目标解读 热点考题诠释 1 2 3 解题要领 (1) 从反应的焓变可看出这两个反应都为放热反应 , 且 “1 mol 反应 ” 放出的热量大 , 故两个反应在热力学上的趋势很大。由于生成丙烯腈的反应为气体体积增大的放热反应 , 故要提高丙烯腈的产率可采取的措施为降温、降压。提高丙烯腈反应选择性的关键因素是使用合适的催化剂。 (2) 图 (a) 中 , 低于 460 ℃ 时的曲线不表示丙烯腈的产率 , 因为合成丙烯腈的反应为放热反应 , 温度降低时 , 丙烯腈的产率应增大 , 而非减小。高于 460 ℃ 时 , 丙烯腈产率降低的原因分析 : 催化剂活性降低 , 合成丙烯腈的反应速率减小 , 而副反应可能更多地发生 ,A 项符合题意 ; 平衡常数增大 , 丙烯腈的产率增大 ,B 项不符合题意 ; 副反应增多 , 可能导致丙烯腈产率降低 ,C 项符合题意 ; 反应活化能增大 , 并不影响平衡的移动 , 不会导致丙烯腈的产率变化 ,D 项不符合题意。 - 11 - 专题知识脉络 能力目标解读 热点考题诠释 1 2 3 (3) 由图 (b) 可知 , 当 n ( 氨 )/ n ( 丙烯 ) 在 1.0 左右时丙烯腈的产率达最大值 , 而副产物丙烯醛的产率达最小值。由反应 ① 知 , V (NH 3 ) ∶ V (O 2 ) ∶ V (C 3 H 6 )=2 ∶ 3 ∶ 2, 而 V (O 2 ) ∶ V ( 空气 )≈1 ∶ 5, 则进料气的理论体积比约为 V (NH 3 ) ∶ V ( 空气 ) ∶ V (C 3 H 6 )=2 ∶ 15 ∶ 2, 即 1 ∶ 7.5 ∶ 1 。 - 12 - 专题知识脉络 能力目标解读 热点考题诠释 1 2 3 - 13 - 专题知识脉络 能力目标解读 热点考题诠释 1 2 3 - 14 - 专题知识脉络 能力目标解读 热点考题诠释 1 2 3 - 15 - 热点一 热点二 热点三 热点四 化学反应速率的计算及影响因素 有关化学反应速率解题的思维路径 - 16 - 热点一 热点二 热点三 热点四 问题探究 1 . 如何计算化学反应速率和进行化学反应速率大小比较 ? 化学反应速率是表示反应进行快慢的物理量 , 它用单位时间内反应物浓度的减少或生成物浓度的增加来表示。 用上式进行某物质反应速率计算时需注意以下几点 : (1) 浓度变化只适用于气体和溶液中的溶质 , 不适用于固体和纯液体。 (2) 化学反应速率是某段时间内的平均反应速率 , 而不是即时速率 , 且计算时取正值。 - 17 - 热点一 热点二 热点三 热点四 (3) 同一反应用不同的物质表示反应速率时 , 数值可能不同 , 但意义相同。不同物质表示的反应速率 , 存在如下关系 : v (A ) ∶ v (B ) ∶ v (C ) ∶ v (D )= m ∶ n ∶ c ∶ d 。 (4) 对于可逆反应 , 通常所计算的是正、逆反应抵消后的总反应速率。 ( 注 : 总反应速率也可理解为净速率 ) 2 . 外界条件怎样影响化学反应速率 ? (1) 纯液体和固体的浓度视为常数 , 它们的量的改变不会影响化学反应速率。但固体颗粒的大小导致接触面的大小发生变化 , 故影响反应速率。 (2) 对于固体、液体物质 , 由于压强改变对它们的体积影响很小 , 因而压强对它们浓度的影响可看作不变 , 即压强对无气体参加的化学反应的速率无影响。 - 18 - 热点一 热点二 热点三 热点四 (3) 升高温度 , 不论吸热反应还是放热反应 , 也不论正反应速率还是逆反应速率都增大。 (4) 用催化剂催化的反应 , 由于催化剂只有在适宜的温度下活性最大 , 反应速率才能达到最大 , 故在许多工业生产中温度的选择还需考虑催化剂活性最大时的温度范围。 (5) 对于有气体参与的化学反应 , 有以下几种情况 : - 19 - 热点一 热点二 热点三 热点四 - 20 - 热点一 热点二 热点三 热点四 例 1 在一定温度下 ,10 mL 0.40 mol·L -1 H 2 O 2 溶液发生催化分解。不同时刻测得生成 O 2 的体积 ( 已折算为标准状况 ) 如下表。 下列叙述不正确的是 ( 溶液体积变化忽略不计 )( ) A.0~6 min 的平均反应速率 : v (H 2 O 2 )≈3.3×10 -2 mol·(L·min) -1 B.6~10 min 的平均反应速率 : v (H 2 O 2 )<3.3×10 -2 mol·(L·min) -1 C. 反应至 6 min 时 , c (H 2 O 2 )=0.30 mol·L -1 D. 反应至 6 min 时 ,H 2 O 2 分解了 50% - 21 - 热点一 热点二 热点三 热点四 分析推理 (1) 根据选项知道 6 min 时是关键点 , 如何求算 6 min 时的 H 2 O 2 的物质的量 ? 一般可以根据三段式来求解 : 初始物质的量 ( mol ) 0.004 0 变化的物质的量 ( mol ) 0.002 0.001 6 min 时物质的量 ( mol ) 0.002 0.001 - 22 - 热点一 热点二 热点三 热点四 (2) 如何求解 0~6 min 内 H 2 O 2 的平均反应速率及 6 min 时 H 2 O 2 的浓度和分解率 ? 0~6 min 内 : Δ n (H 2 O 2 )=0.002 mol , (3) 根据表格中的 O 2 的体积 , 可以得出哪些信息 ? 随着反应的进行 , 相同时间内产生氧气的量越来越少。同时也说明了浓度的减小导致过氧化氢的分解速率降低。 答案 C - 23 - 热点一 热点二 热点三 热点四 题后反思 由于反应速率的单位是 mol · ( L · min ) -1 或 mol · (L · s) -1 , 所以 , 用于表示化学反应速率的反应物或生成物必须有浓度的改变 , 固体、纯液体、敞开体系中产生的气体不能用于表示化学反应速率。如本题中不能用 v (O 2 ) 表示速率。 - 24 - 热点一 热点二 热点三 热点四 对点训练 1 (2015 湖北天门模拟 ) 在容积固定的容器中发生反应 CO(g)+2H 2 (g) CH 3 OH(g) Δ H <0, 各物质的浓度如下表 : - 25 - 热点一 热点二 热点三 热点四 下列说法不正确的是 ( ) A.2~4 min 内用 H 2 表示的平均反应速率为 0.3 mol·L -1 ·min -1 B. 达到平衡时 ,CO 的转化率为 62.5% C. 反应在第 2 min 时改变了条件 , 可能是加入了催化剂 D. 反应在第 2 min 时改变了条件 , 可能是增加了 H 2 的浓度 D - 26 - 热点一 热点二 热点三 热点四 化学平衡状态的判断及平衡移动的影响因素 有关化学平衡状态及平衡移动解题的思维路径 - 27 - 热点一 热点二 热点三 热点四 - 28 - 热点一 热点二 热点三 热点四 2 . 如何判定平衡移动的方向 ? (1) 应用平衡移动原理。 如果改变影响平衡的一个条件 ( 如浓度、压强或温度等 ), 平衡就向着能够减弱这种改变的方向移动。 ① 原理中 “ 减弱这种改变 ” 的正确理解应当是升高温度时 , 平衡向吸热反应方向移动 ; 增加反应物浓度 , 平衡向反应物浓度减小的方向移动 ; 增大压强时 , 平衡向气体体积缩小的方向移动。 - 29 - 热点一 热点二 热点三 热点四 ② 化学平衡移动的根本原因是外界条件 ( 如温度、压强、浓度等 ) 的改变破坏了原平衡体系 , 使得正、逆反应速率不再相等。当 v ( 正 ) >v ( 逆 ) 时 , 平衡向正反应方向移动。当 v ( 正 )10 5 时 , 可以认为该反应已经进行完全。虽然转化率也能表示反应进行的程度 , 但转化率不仅与温度有关 , 而且与起始条件有关。 ② K 的大小只与温度有关 , 与反应物或生成物的起始浓度无关。 - 44 - 热点一 热点二 热点三 热点四 - 45 - 热点一 热点二 热点三 热点四 下列说法正确的是 ( ) A. 实验 ① 中 , 若 5 min 时测得 n (M)=0.050 mol , 则 0 至 5 min 时间内 , 用 N 表示的平均反应速率 v (N)=1.0×10 -2 mol ·( L·min ) -1 B. 实验 ② 中 , 该反应的平衡常数 K =2.0 C. 实验 ③ 中 , 达到平衡时 ,X 的转化率为 60% D. 实验 ④ 中 , 达到平衡时 , b >0.060 - 46 - 热点一 热点二 热点三 热点四 分析推理 (1) 如何求算实验 ② 的平衡常数 ? 根据反应物、生成物反应前后物质的量浓度计算。平衡时 n (M)=0.080 mol , 则生成 N 0.080 mol , 消耗 X 、 Y 的物质的量分别为 0.080 mol , 因此平衡时容器中有 X 0.02 mol 、 Y 0.32 mol , 其平衡常 (2) 实验 ③ 没有告知 a 的具体值 , 如何求 X 的转化率 ? 根据平衡常数只与温度有关 , 实验 ② 、 ③ 温度不变 , 平衡常数也不变 , 故 K= 1, 再根据 “ 三段式 ” 计算 a , 求算 X 的转化率。有 - 47 - 热点一 热点二 热点三 热点四 (3) 如何判断该反应是吸热反应还是放热反应 ? 分别求实验 ① 、实验 ② 的平衡常数 , 通过不同温度时平衡常数的 K= 1, 温度越高 , K 越小 , 说明该反应是放热反应。 (4) 实验 ④ 中 b 值大小如何确定 ? 利用假设法进行比较。实验 ④ 起始物质的量是实验 ③ 的一半 , 假设温度也是 800 ℃ , 根据 K 值不变 , 则 b 是 a 的一半。该反应是放热反应 , 则 b 比 a 的一半要小。 答案 C - 48 - 热点一 热点二 热点三 热点四 题后反思 (1) 对于同类型的反应 , K 值越大 , 反应物转化率越大 , 表示反应进行的程度越大 ; K 值越小 , 反应物转化率越小 , 表示反应进行的程度越小。 (2) 化学平衡常数只与温度有关 , 与反应物或生成物的浓度无关。 (3) 反应物或生成物中若有固体或纯液体 , 由于其浓度可以看作为 “1” 而不代入平衡常数表达式。 (4) 化学平衡常数是指某一具体反应的平衡常数。若化学方程式中的化学计量数变化 , 相应地化学平衡常数也要发生变化 ; 当化学反应逆向进行时 , 平衡常数为原平衡常数的倒数。 - 49 - 热点一 热点二 热点三 热点四 请回答下列问题 : (1) 上述反应的化学平衡常数表达式为 : 。该反应的 Q 0( 填 “>” 或 “<”) 。 (2)850 ℃ 时在体积为 10 L 反应器中 , 通入一定量的 CO 和 H 2 O(g), 发生上述反应 ,CO 和 H 2 O(g) 浓度变化如图所示 , 则 0~4 min 时平均反应速率 v (CO)= 。 - 50 - 热点一 热点二 热点三 热点四 (3) 若反应在 500 ℃ 时进行 , 且 CO 、 H 2 O(g) 的起始浓度均为 0.020 mol·L -1 , 该条件下 ,CO 的最大转化率为 。 (4) 若反应在 850 ℃时进行 , 设起始时 CO 和 H 2 O(g) 共为 1 mol , 其中水蒸气的体积分数为 x , 平衡时 CO 的转化率为 y , 试推导 y 随 x 变化的函数关系式为 。 - 51 - 热点一 热点二 热点三 热点四 - 52 - 热点一 热点二 热点三 热点四 - 53 - 热点一 热点二 热点三 热点四 化学反应速率及化学平衡图像、图表的分析 有关化学平衡图像题常见的思维路径 - 54 - 热点一 热点二 热点三 热点四 - 55 - 热点一 热点二 热点三 热点四 问题探究 解答化学平衡图像题应注意哪些问题 ? - 56 - 热点一 热点二 热点三 热点四 例 4 (2014 安徽理综 ) 臭氧是理想的烟气脱硝试剂 , 其脱硝反应为 :2NO 2 (g)+O 3 (g) N 2 O 5 (g)+O 2 (g), 若反应在恒容密闭容器中进行 , 下列由该反应相关图像作出的判断正确的是 ( ) - 57 - 热点一 热点二 热点三 热点四 分析推理 (1) 如何判断温度与平衡常数的关系 ? 根据能量图像中反应物与生成物能量高低 , 得出该反应是放热反应 , 则温度升高 , K 值减小。 (2) 反应速率计算时要注意规范书写 , 尤其是单位 , 该题 B 项中单位应是什么 ? 根据横坐标 , 速率单位是 mol · (L · s) -1 。 (3) 根据图像 ,NO 2 转化率随 x 增加而增大 , 思考能使 NO 2 转化率增大的因素有哪些 ? 增加 O 3 的含量或加压均可以 , 但是增加 O 2 的量会使平衡逆向移动 , 不能增大 NO 2 的转化率。 答案 A - 58 - 热点一 热点二 热点三 热点四 对点训练 4 关于下列各图的叙述中正确的是 ( ) - 59 - 热点一 热点二 热点三 热点四 A.N 2 (g)+3H 2 (g) 2NH 3 (g) Δ H =-92.4 kJ·mol -1 现将 1 mol N 2 (g) 、 3 mol H 2 (g) 充入一容积为 2 L 的密闭容器中 , 反应过程中 , 混合气体平均相对分子质量为 M , 混合气体密度为 ρ , 混合气体压强为 p , 三者关系如图 ① B. 在常温下 ,X 2 (g) 和 H 2 反应生成 HX 的平衡常数如表 ② 所示 , 仅依据 K 的变化 , 就可以说明在相同条件下 , 平衡时 X 2 ( 从 F 2 到 I 2 ) 的转化率逐渐降低 , 且 X 2 与 H 2 反应的剧烈程度逐渐减弱 - 60 - 热点一 热点二 热点三 热点四 C. 图 ③ 表示锌粒与过量稀盐酸反应时 , 生成氢气的速率 v (H 2 ) 随时间的变化图 D. 图 ④ 中曲线表示反应 2SO 2 (g)+O 2 (g) 2SO 3 (g) Δ H <0; 正、逆反应的平衡常数 K 随温度的变化 - 61 - 1 2 3 4 1 .(2016 陕西西安铁一中学测试 )X 、 Y 、 Z 是三种气态物质 , 在一定温度下其变化符合下图。下列说法不正确的是 ( ) - 62 - 1 2 3 4 A. 该反应的化学方程式为 X(g)+3Y(g) 2Z(g) B. 若升高温度 , 该反应的平衡常数减小 ,Y 的转化率降低 C. 若图 Ⅱ 中有一种情况是加入了催化剂 , 曲线 b 是加入催化剂时的能量变化曲线 , 曲线 a 是没有加入催化剂时的能量变化曲线 D. 若图 Ⅲ 中甲表示压强 , 乙表示 Z 的含量 , 则其变化符合图 Ⅲ 中曲线 答案 解析 解析 关闭 答案 解析 关闭 - 63 - 1 2 3 4 2 .(2016 陕西师范大学附中一模 ) 在 1.0 L 密闭容器中放入 0.10 mol X, 在一定温度下发生反应 : X(g ) Y(g)+Z(g ) Δ H <0 容器内气体总压强 p 随反应时间 t 的变化关系如图所示。以下分析正确的是 ( ) B. 该温度下此反应的平衡常数 K =0.32 C. 欲提高平衡体系中 Y 的含量 , 可升高体系温度或减少 Z 的量 D. 其他条件不变 , 再充入 0.1 mol 气体 X, 平衡正向移动 ,X 的转化率增大 B - 64 - 1 2 3 4 - 65 - 1 2 3 4 - 66 - 1 2 3 4 3 . 在密闭容器中进行反应 :X(g)+3Y(g) 2Z(g), 下列说法正确的是 ( ) A. 左上图说明正反应为吸热反应 B. 反应达平衡后 , 增大压强气体密度将减小 C. 右上图可表示升高温度使平衡向逆反应方向移动 D. 右上图可表示使用催化剂后引发的反应速率变化 答案 解析 解析 关闭 A 项 , 题图中左上图说明当反应达到平衡后 , 升高温度 , v ( 正 ) 增大得少、 v ( 逆 ) 增大得多 , 平衡逆向移动。根据平衡移动原理 , 升高温度 , 化学平衡向吸热反应方向移动 , 逆反应为吸热反应 , 错误。 B 项 , 反应达到平衡后 , 增大压强 , 平衡正向移动 , 由于反应是在体积恒定的密闭容器内进行 , 气体的质量在反应前后保持不变 , 所以气体密度也不变 , 错误。 C 项 , 题中右上图改变条件后 v '( 正 ) 、 v '( 逆 ) 都增大 , v '( 逆 ) 增大得多 , 所以平衡逆向移动。由于升高温度 , 能使化学反应速率增大。因此可以表示升高温度使平衡向逆反应方向移动 , 正确。 D 项 , 使用催化剂后正反应、逆反应的速率都加快 , 但是平衡不发生移动 , 错误。 答案 解析 关闭 C - 67 - 1 2 3 4 4 .( Ⅰ ) 在一定条件下 , 发生反应 : a A(g)+ b B(g ) c C(g ) Δ H = Q kJ·mol -1 , 其化学平衡常数 K 和温度的关系如下表所示 : 依据图中数据判断该反应 Δ H ( 填 “>” 或 “<”)0; 若其他条件保持一定 , 降低温度 , 该反应物 A 的转化率 ( 填 “ 增大 ”“ 减小 ” 或 “ 不变 ”, 下同 ), 化学反应速率将 。 - 68 - 1 2 3 4 ( Ⅱ ) 在恒定温度 t ℃ 、 2 L 恒容密闭容器中发生反应 a A(g)+ b B(g ) c C(g ), 容器中 A 、 B 、 C 物质的量变化如下图所示 , 回答下列问题 : (1) 该化学方程式中 a ∶ b ∶ c 为 , t ℃ 时该反应的化学平衡常数 K 的值为 。 ( 保留 2 位小数 ) (2)0~15 min 内 ,B 的平均反应速率为 , 反应达平衡时 ,A 的转化率为 。 - 69 - 1 2 3 4 (3) 据图判断 , 反应进行至 20 min 时 , 曲线发生变化的原因是 ( 用文字表达 ), 反应重新达平衡时 ,A 的体积分数将 ( 填 “ 增大 ”“ 减小 ” 或 “ 不变 ”) 。 (4)10 min 到 15 min 的曲线变化的原因可能是 。 答案 ( Ⅰ )< 增大 减小 ( Ⅱ )(1)2 ∶ 1 ∶ 2 0.31 (2)0.003 3 mol·(L·min) -1 20% (3) 增大了 B 的浓度 减小 (4) 使用了催化剂 ( 答案合理即可 ) - 70 - 1 2 3 4 - 71 - 1 2 3 4 (3) 反应进行至 20 min 时 ,B 的物质的量陡然增加 , 所以曲线发生变化的原因是 B 的物质的量增加了 , 平衡正向移动 , 所以 A 的体积分数将减小。 (4)10 min 时反应未达平衡 ,A 、 B 、 C 的反应速率瞬间增大 , 且反应仍正向进行 , 所以可能是加入了催化剂。