- 2021-02-26 发布 |
- 37.5 KB |
- 64页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学第1章化学反应与能量转化第2节化学能转化为电能__电池1原电池的工作原理课件鲁科版选择性必修1
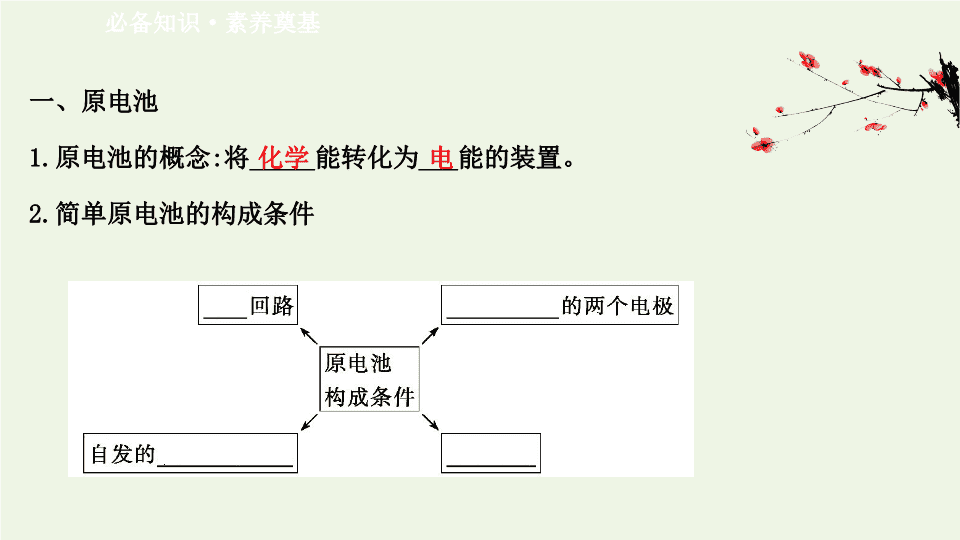
第 2 节 化学能转化为电能 —— 电池 第 1 课时 原电池的工作原理 一、原电池 1. 原电池的概念 : 将 _____ 能转化为 ___ 能的装置。 2. 简单原电池的构成条件 必备知识 · 素养奠基 化学 电 【 巧判断 】 (1) 原电池是把化学能转化为电能的一种装置。 ( ) 提示 : √ 。原电池是将化学能转化为电能的装置。 (2)CaO+H 2 O====Ca(OH) 2 是放热反应 , 可设计成原电池。 ( ) 提示 : × 。此反应不是氧化还原反应 , 因此不能设计成原电池。 (3) 反应 Cu+2Ag + ====2Ag+Cu 2+ 能以原电池的形式来实现。 ( ) 提示 : √ 。此反应为自发的氧化还原反应 , 可以设计为原电池。 【 微思考 】 下列图示装置能形成原电池的有哪些 , 请分析原因。 提示 : AD 。根据构成原电池的条件可以判断装置 A 、 D 能形成原电池。 B 装置中两电极相同且没有自发的氧化还原反应 ,C 装置中甘油为非电解质 ,E 装置中的两容器没有形成闭合回路。 二、原电池工作原理 1. 装置 2. 实验现象 检流计指针 电极表面变化情况 Ⅰ 发生 _____ 锌片质量 _____, 铜片质量 _____ Ⅱ 发生 _____ 锌片质量 _____, 铜片质量 _____ 偏转 减少 增加 偏转 减少 增加 3. 铜锌原电池工作原理分析 : 负极 正极 电极材料 锌片 铜片 电极反应 ______________ ______________ 反应类型 _____ 反应 _____ 反应 电池反应 Zn+Cu 2+ ====Cu+Zn 2+ 电子流向 由 ___ 极流向 ___ 极 离子移向 阳离子移向 ___ 极 , 阴离子移向 ___ 极 盐桥作用 构成闭合回路 , 使离子通过 , 传导电流 Zn-2e - ====Zn 2+ Cu 2+ +2e - ====Cu 氧化 还原 锌 铜 正 负 【 巧判断 】 (1) 原电池正极发生氧化反应 , 负极发生还原反应。 ( ) 提示 : × 。原电池的正极发生的是得电子的还原反应 , 负极发生的是失电子的 氧化反应。 (2) 原电池的内电路中阳离子向正极移动。 ( ) 提示 : √ 。原电池中带正电的阳离子向正极移动。 (3) 带盐桥的铜锌原电池中 , 若将盐桥移走 , 仍可构成原电池。 ( ) 提示 : × 。若将盐桥移走 , 两池不能构成闭合回路 , 因此不能形成原电池。 关键能力 · 素养形成 知识点一 原电池的工作原理及电极判断 【 重点释疑 】 1. 原电池工作原理 (1) 原理图示 (2) 电极名称与反应类型 正极→还原反应 ; 负极→氧化反应。 (3) 电子流向 : 负极→正极。 (4) 电流方向 : 正极→负极。 (5) 离子流向 : 阳离子→正极 ; 阴离子→负极。 2. 原电池正负极判断 : 【 思考 · 讨论 】 (1)Cu 、 Ag 与稀硫酸能否设计成原电池 ? 提示 : 不能。 Cu 、 Ag 与稀硫酸都不能自发地发生氧化还原反应。 (2) 外电路中电流方向与电子的流动方向有何关系 ? 提示 : 电流方向与电子的流动方向相反。 (3) 试分析用镁、铝作电极 , 氢氧化钠溶液作离子导体构成原电池时的正、负极及电子得失情况。 提示 : 镁、铝、氢氧化钠溶液构成的原电池中 , 发生反应 : 2Al+2NaOH+ 2H 2 O====2NaAlO 2 +3H 2 ↑, 铝失去电子 , 应该作负极 ,H 2 O 得到电子 , 镁作正极。 【 案例示范 】 【 典例 】 (2020· 泰安高二检测 ) 锌铜原电池装置如图所示 , 其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述正确的是 ( ) A. 铜电极上发生氧化反应 B. 电池工作一段时间后 , 甲池的 c( ) 减小 C. 电池工作一段时间后 , 乙池溶液的总质量增加 D. 阴阳离子分别通过交换膜向负极和正极移动 , 保持溶液中电荷平衡 【 解题指南 】 解答本题时注意以下几点 : (1) 注意原电池的正负极的判断方法 ; (2) 阳离子能通过阳离子交换膜 ; (3) 注意原电池中离子的移动方向。 【 解析 】 选 C 。原电池反应为 Zn+CuSO 4 ====ZnSO 4 +Cu 。 Cu 电极作正极 ,Cu 2+ 在正 极得电子 , 发生还原反应 ,A 项错误 ; 由于两半池中的阴离子 不能透过半透 膜 , 故 c( ) 都不变 ,B 项错误 ; 甲池中由于生成 Zn 2+ , 而乙池中 Cu 2+ +2e - ====Cu, 则乙池中的 CuSO 4 部分变为 ZnSO 4 , 导致乙池中溶液总质量变大 ,C 项正确 ; 阴离子 不能透过半透膜 ,D 项错误。 【 母题追问 】 (1) 写出上述电池的正负极电极反应式。 提示 : Cu 电极为正极 , 电极反应式为 Cu 2+ +2e - ====Cu;Zn 电极为负极 , 电极反应式为 Zn-2e - ====Zn 2+ 。 (2) 若将题目中“阳离子交换膜”换为“阴离子交换膜”其余不变是否还构成 原电池 ? 若构成原电池请分析甲乙两池溶液质量的变化 ? 提示 : 能 , 甲池溶液质量增加 , 乙池溶液质量减少。甲池 Zn→Zn 2+ , 并且阴离子交 换膜允许阴离子通过 , 因此 向甲池移动 , 从而导致甲池溶液的质量增加 ; 而乙池 Cu 2+ →Cu 析出 , 且 从乙池移到甲池 , 故溶液的质量减少。 【 迁移 · 应用 】 1.(2020· 商丘高二检测 ) 关于下图所示的原电池 , 下列说法正确的是 ( ) A. 电子从锌电极通过检流计流向铜电极 B. 盐桥中的阴离子向硫酸铜溶液中迁移 C. 铜电极发生还原反应 , 其电极反应是 2H + +2e - ====H 2 ↑ D. 取出盐桥后 , 检流计指针仍会偏转 , 铜电极在反应前后质量不变 【 解析 】 选 A 。锌片作负极 , 铜片作正极 , 电子从负极流向正极 ,A 选项正确 ; 盐桥中的阴离子向负极移动 ,B 选项错误 ; 负极发生氧化反应 , 正极发生还原反应 , 铜电极发生的反应为 Cu 2+ +2e - ====Cu,C 选项错误 ; 取出盐桥后不能形成原电池 , 检流计指针不偏转 ,D 选项错误。 2.(2020· 苏州高二检测 ) 如图所示装置中 , 观察到电流计指针偏转 ,M 棒变粗 ,N 棒变细 , 由此判断下表中所列 M 、 N 、 P 物质 , 其中可以成立的是 ( ) 选项 M N P A 锌 铜 稀硫酸 B 铜 铁 稀盐酸 C 银 锌 硝酸银溶液 D 锌 铁 硝酸铁溶液 【 解析 】 选 C 。该原电池中 M 棒变粗 ,N 棒变细 , 说明原电池反应时 N 棒溶解作负极 , 溶液中有金属析出在 M 棒上。 M 棒作正极。 A 、 B 选项中 , 电解质溶液均为稀酸溶液 , 故正极均产生 H 2 , 不符合题意 ;C 项 , 总反应为 Zn+2AgNO 3 ====Zn(NO 3 ) 2 +2Ag, 合理 ;D 项 ,M 极锌失电子溶解 , 不符合题意。 【 补偿训练 】 1.(2020· 唐山高二检测 ) 关于锌、铜和稀硫酸构成的原电池的下列说法中正确的是 ( ) A. 锌是正极 , 铜是负极 B. 电子从铜片经导线流向锌片 C. 负极的反应式为 2H + +2e - ====H 2 ↑ D. 反应一段时间后 , 溶液的 pH 升高 【 解析 】 选 D 。锌比铜活泼 , 应为原电池的负极 , 铜为正极 , 则 A 项错误 ; 电子从负极流向正极 , 即电子从锌片经导线流向铜片 , 故 B 项错误 ; 锌为负极 , 发生氧化反应 , 负极的反应式为 Zn-2e - ====Zn 2+ , 故 C 项错误 ; 正极上氢离子得电子发生还原反应 , 则氢离子浓度减小 , 所以反应一段时间后 , 溶液的 pH 升高 ,D 项正确。 2.(2020· 南京高二检测 ) 如图所示的原电池装置 ,X 、 Y 为两电极 , 电解质溶液为稀硫酸 , 外电路中的电子流向如图所示 , 对此装置的下列说法正确的是 ( ) A. 外电路的电流方向为 :X→ 外电路→ Y B. 若两电极分别为 Zn 和石墨棒 , 则 X 为石墨棒 ,Y 为 Zn C. 若两电极都是金属 , 则它们的活动性为 X>Y D.X 极上发生的是还原反应 ,Y 极上发生的是氧化反应 【 解析 】 选 C 。由图可知 , 电子的流动方向是 X→ 外电路→ Y, 则电流的方向就为 Y→ 外电路→ X;X 为原电池的负极 ,Y 为正极 ,X 的活动性比 Y 的强 ;X 极应发生氧化反应 ,Y 极应发生还原反应。 【 素养提升 】 利用原电池原理可以将一个自发进行的氧化还原反应设计为原电池。 (1) 利用反应 Cu+Fe 2 (SO 4 ) 3 ====2FeSO 4 +CuSO 4 设计一个原电池 , 画出实验装置图 ( 不含盐桥 ), 并写出电极反应式。 提示 : 根据反应 Cu+Fe 2 (SO 4 ) 3 ====2FeSO 4 +CuSO 4 可知 , 反应中 Cu 被氧化 , 应为原电池负极 , 失电子而被氧化 , 正极应为活泼性比 Cu 弱的金属或非金属材料 ,Fe 3+ 在正极得到电子而被还原 , 电解质溶液为 Fe 2 (SO 4 ) 3 等 , 以此画出实验装置图 : 电极反应式分别为 : 正极 Fe 3+ +e - ====Fe 2+ , 负极 Cu-2e - ====Cu 2+ 。 (2) 某同学将反应 2Al+6H + ====2Al 3+ +3H 2 ↑ 设计为原电池 , 装置如下 , 请分析此同学设计的装置是否正确 , 为什么 ? 提示 : 不正确。因为此装置中的电解质溶液为浓硝酸 , 属于强氧化性酸 ,Al 在浓硝酸中会发生钝化而被保护。应将浓硝酸改为稀盐酸或稀硫酸。同时 ,Mg 、 Al 的金属活动性 Mg>Al, 在稀酸中 Mg 失电子被氧化 , 故将 Mg 换为比 Al 金属性差的金属 , 例如 Cu 。 (3) 某校化学兴趣小组进行探究性活动 : 将氧化还原反应 :2Fe 3+ +2I - 2Fe 2+ +I 2 设计成带盐桥的原电池。提供的试剂 :FeCl 3 溶液、 KI 溶液 ; 其他用品 任选。 ①请画出设计的原电池装置图 , 并标出电极材料、电极名称及电解质溶液。 提示 : ② 写出相关的电极反应式。 提示 : 正极反应为 Fe 3+ +e - ====Fe 2+ , 负极反应为 2I - -2e - ====I 2 。 ③在实验过程中观察到灵敏电流计的“读数变为零” , 请分析原因。 提示 : 由于此反应为可逆反应 ,“ 读数变为零”是由于该可逆反应达到了化学平衡状态。 知识点二 原电池原理的应用 【 重点释疑 】 1. 加快氧化还原反应速率 如实验室用 Zn 和稀硫酸反应制 H 2 , 常用粗锌 , 它产生 H 2 的速率快。原因是粗锌中的杂质和锌、稀硫酸形成原电池 , 加快了锌的反应 , 使产生 H 2 的速率加快。 2. 比较金属的活泼性强弱 原电池中 , 负极一般为活泼性较强的金属 , 正极一般为活泼性较弱的金属。 3. 设计原电池 原电池的设计一定要满足构成原电池的几个条件。设计思路 : 以自发发生的氧化还原反应为基础 , 把氧化还原反应分解为氧化反应和还原反应两个半反应 , 从而确定电极反应 , 以两极反应为依据 , 确定电极材料及电解质溶液 , 最后画出装置图。 【 思考 · 讨论 】 (1) 若纯锌与粗锌 ( 含 Fe 、 C 等 ) 分别与同浓度的稀硫酸反应制取 H 2 , 哪种方法产生 H 2 的速率快 ? 提示 : 粗锌。粗锌中的铁可以与锌构成原电池 , 从而加快反应速率。 (2) 根据反应 HCl+NaOH====NaCl+H 2 O 能设计成原电池吗 ? 为什么 ? 提示 : 不能 ; 因为这个反应不是氧化还原反应 , 反应过程中没有电子的转移 , 不符合原电池的构成条件。 【 案例示范 】 【 典例 】 (2020· 启东高二检测 ) 某化学兴趣小组利用反应 Zn+2FeCl 3 ==== ZnCl 2 +2FeCl 2 , 设计了如图所示的原电池装置 , 下列说法正确的是 ( ) A.Zn 为负极 , 发生还原反应 B.b 电极反应式为 2Fe 3+ +2e - ====2Fe 2+ C. 电子流动方向是 a 电极→ FeCl 3 溶液→ b 电极 D. 电池的正极材料可以选用石墨、铂电极 , 也可以用铜 【 解题指南 】 分析原电池设计的思维流程如下 : (1) 氧化还原反应分解为氧化反应和还原反应两个反应 , 从而确定电极反应 ; (2) 以两电极反应原理为依据 , 确定电极材料和电解质溶液 ; (3) 用导线连接构成闭合回路。 【 解析 】 选 D 。根据 Cl - 的移动方向可知 ,b 电极为负极 ,a 电极为正极 , 根据电池反应式可知 ,Zn 发生失电子的氧化反应 , 即 b 电极反应式为 Zn-2e - ====Zn 2+ ,A 、 B 项错误 ; 电子流动方向是 b 电极→导线→ a 电极 ,C 错误 ; 正极材料的活泼性应比负极材料弱 ,D 正确。 【 迁移 · 应用 】 1.(2020· 济南高二检测 ) 某原电池的电池反应为 Fe+2Fe 3+ ====3Fe 2+ , 与此电池反应不符的原电池是 ( ) A. 铜片、铁片、 FeCl 3 溶液组成的原电池 B. 石墨、铁片、 Fe(NO 3 ) 3 溶液组成的原电池 C. 铁片、锌片、 Fe 2 (SO 4 ) 3 溶液组成的原电池 D. 铜片、铁片、 Fe(NO 3 ) 3 溶液组成的原电池 【 解析 】 选 C 。由电池反应可知 , 铁作负极 , 铁失去电子发生氧化反应。 C 项中 , 由于锌的活泼性大于铁 , 故锌作负极 , 发生氧化反应 , 与电池反应不符。 2.(2020· 镇江高二检测 ) 根据下图 , 可判断出下列离子方程式中错误的是 ( ) A.2Ag(s)+Cd 2+ (aq)====2Ag + (aq)+Cd(s) B.Co 2+ (aq)+Cd(s)====Co(s)+Cd 2+ (aq) C.2Ag + (aq)+Cd(s)====2Ag(s)+Cd 2+ (aq) D.2Ag + (aq)+Co(s)====2Ag(s)+Co 2+ (aq) 【 解析 】 选 A 。由第一个装置图中正负极的标注可知 ,Cd 失去电子作负极 , 则金属性 Cd>Co; 由第二个装置图正负极的标注可知 ,Co 失去电子被氧化作负极 , 则金属性 Co>Ag, 综上分析可知三者金属性的强弱顺序为 Cd>Co>Ag 。根据活泼性强的金属能将活泼性弱的金属从其盐溶液中置换出来的规律判断 A 项错误。 【 补偿训练 】 (2020· 福州高二检测 ) 有 A 、 B 、 C 、 D 四块金属片 , 进行如下实验 :①A 、 B 用导线相连后 , 同时浸入稀硫酸中 ,A 极为负极 ;②C 、 D 用导线相连后 , 同时浸入稀硫酸中 , 电流由 D→ 导线→ C;③A 、 C 相连后 , 同时浸入稀硫酸中 ,C 极产生大量气泡 ;④B 、 D 相连后 , 同时浸入稀硫酸中 ,D 极发生氧化反应。据此 , 判断四种金属的活动性顺序是 ( ) A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A 【 解析 】 选 B 。金属与稀硫酸组成原电池 , 活泼金属为负极 , 失去电子发生氧化反应 , 较不活泼的金属为正极 ,H + 在正极电极表面得到电子生成 H 2 , 电子移动方向由负极→正极 , 电流方向则由正极→负极。在题述原电池中 ,A-B 电池 ,A 为负极 ;C-D 原电池 ,C 为负极 ;A-C 原电池 ,A 为负极 ;B-D 原电池 ,D 为负极。综上可知 , 金属活动性 :A>C>D>B 。 【 课堂回眸 】 课堂检测 · 素养达标 1.( 教材改编题 ) 下列有关图甲和图乙的叙述不正确的是 ( ) A. 均发生了化学能转化为电能的过程 B.Zn 和 Cu 既是电极材料又是反应物 C. 工作过程中 , 电子均由 Zn 经导线流向 Cu D. 相同条件下 , 图乙比图甲的能量利用效率高 【 解析 】 选 B 。甲、乙均为原电池 ,A 项正确 ;Zn 为负极 , 电极反应式为 Zn-2e - ====Zn 2+ ,Cu 为正极 , 电极反应式为 Cu 2+ +2e - ====Cu,B 项错误 ; 电子均由 Zn 经导线流向 Cu,C 项正确 ; 图乙 Zn 没有直接与 CuSO 4 溶液接触 , 能最大限度地将化学能转化为电能 ,D 项正确。 2.(2020· 聊城高二检测 ) 用铜片、银片、 Cu(NO 3 ) 2 溶液、 AgNO 3 溶液、导线和盐桥 ( 装有琼脂 -KNO 3 的 U 形管 ) 构成一个原电池。以下有关该原电池的叙述正确的是 ( ) ① 在外电路中 , 电流由铜电极流向银电极 ②正极反应为 Ag + +e - ====Ag ③ 实验过程中取出盐桥 , 原电池仍继续工作 ④将铜片浸入 AgNO 3 溶液中发生的化学反应与该原电池反应相同 A.①② B.②③ C.②④ D.③④ 【 解析 】 选 C 。① Cu 为负极 , 电子由 Cu 电极流向 Ag 电极 ;③ 取出盐桥 , 电池不能形成闭合回路 , 不能继续工作。 3.(2020· 绵阳高二检测 ) 如图所示的装置中有电流产生 , 以下说法不正确的是 ( ) A.Fe 是负极 ,C 是正极 B. 负极反应式为 Fe-3e - ====Fe 3+ C. 内电路中阴离子移向 FeCl 2 溶液 D. 电流由石墨电极流向 Fe 电极 【 解析 】 选 B 。图示装置为原电池 , 负极 (Fe):Fe-2e - ====Fe 2+ , 正极 (C):2Fe 3+ +2e - ====2Fe 2+ ,A 项正确 ,B 项不正确 ; 内电路中 ,Fe 电极失电子 , 生成 Fe 2+ , 吸引阴离子 ,C 项正确 ; 外电路中 , 电流由正极 (C) 流向负极 (Fe),D 项正确。 4.(2020· 合肥高二检测 ) 如图 , 下列说法不正确的是 ( ) A. 在①装置中锌棒逐渐变细 , 铜棒无变化 B. 在②装置中锌棒逐渐变细 , 铜棒逐渐变粗 C. 在②装置中部分化学能转化成了电能 D. 在①②装置中锌棒均被氧化 【 解析 】 选 B 。 A 项 , 在①装置中锌与氢离子反应生成锌离子和氢气 , 锌棒变细 , 铜不与氢离子反应 , 铜棒没有变化 ;B 项 , 在②装置中锌棒与铜棒通过导线连接形成闭合回路 , 构成原电池 , 锌失去电子转化为锌离子 , 锌棒变细 , 氢离子在铜棒上得电子生成氢气 , 铜棒不会变粗 ;C 项 ,② 装置实现了化学能到电能的转化 , 但电解质 H 2 SO 4 接触锌棒导致部分化学能转化为热能 ;D 项 , 在①②装置中 , 锌均失去电子发生氧化反应。 5.(2020· 厦门高二检测 )M 、 N 、 P 、 E 四种金属 :①M+N 2+ ====N+M 2+ ② M 、 P 用导线连接放入硫酸氢钠溶液中 ,M 表面有大量气泡 ③ N 、 E 用导线连接放入 E 的硫酸盐溶液中 , 电极反应为 E 2+ +2e - ====E,N-2e - ====N 2+ 。四种金属的还原性由强到弱的顺序是 ( ) A.P 、 M 、 N 、 E B.E 、 N 、 M 、 P C.P 、 N 、 M 、 E D.E 、 P 、 M 、 N 【 解析 】 选 A 。由①知 , 金属活动性 :M>N;M 、 P 用导线连接放入硫酸氢钠溶液中 ,M 表面产生气泡 ,M 作原电池正极 , 活动性 :P>M;N 、 E 构成的原电池中 N 作负极 , 活动性 :N>E 。 6.( 新思维 · 新考向 ) 某化学兴趣小组的同学设计了如图所示的装置 , 完成下列问题 : 世纪金榜导学号 (1) 写出上述原电池的电极反应式和电池总方程式。 (2) 分析盐桥的作用是什么 ? 并指出盐桥中 和 Cl - 的移动方向。 (3) 若反应一段时间后锌棒和铜棒的质量相差 6.45 g, 计算电路中转移的电子的物质的量。 (4) 当外电路中转移 0.2 mol 电子时 , 乙烧杯中浓度最大的阳离子是哪种离子 ? 【 解析 】 (1) 锌棒作原电池的负极 , 电极反应式为 Zn-2e - ====Zn 2+ ; 铜棒作原电 池的正极 , 电极反应式为 Cu 2+ +2e - ====Cu 。电池的总反应为 Zn+Cu 2+ ==== Cu+ Zn 2+ 。 (2) 盐桥的作用是向甲、乙两烧杯中提供 和 Cl - , 构成闭合回路 , 同时使两 烧杯溶液中保持电中性。在反应过程中盐桥中的 向乙烧杯 ( 正极 ) 移 动 ,Cl - 向甲烧杯 ( 负极 ) 移动。 (3)Zn 作负极 , 发生的电极反应为 Zn-2e - ====Zn 2+ , 故锌棒的质量会减少。 Cu 作 正极 , 发生的电极反应为 Cu 2+ +2e - ====Cu, 铜棒质量会增加。因此转移 2 mol e - 时锌棒质量减少 65 g, 铜棒质量增加 64 g, 两者质量差为 129 g, 因此质量相差 6.45 g 时电路转移的电子为 0.1 mol 。 (4) 反应过程中 , 溶液为了保持电中性 ,Cl - 将进入甲烧杯 , 进入乙烧杯。当 外电路中转移 0.2 mol 电子时 , 乙烧杯中有 0.1 mol Cu 2+ 消耗 , 还剩余 0.1 mol Cu 2+ , 有 0.2 mol 进入乙烧杯 , 故乙烧杯中浓度最大的阳离子是 。 答案 : (1) 负极 :Zn-2e - ====Zn 2+ ; 正极 :Cu 2+ +2e - ====Cu; 总方程式 :Zn+Cu 2+ ==== Cu+Zn 2+ (2) 形成闭合回路 , 使两烧杯溶液中保持电中性 , 向乙烧杯 ( 正极 ) 移动 ,Cl - 向甲烧杯 ( 负极 ) 移动 (3)0.1 mol (4)查看更多