高考化学综合题分类练习卷化学反应原理练习卷
化学反应原理练习卷
1.党的十九大报告指出:要持续实施大气污染防治行动,打赢蓝天保卫战。当前空气质量检测的主要项目除了PM2.5外,还有CO、SO2、氮氧化物(NO和NO2)、O3等气体。
(1)汽车尾气中含有NO 和CO气体,可利用催化剂对CO、NO进行催化转化反应:
2CO(g) +2NO(g) N2(g) +2CO2(g) △H
① 已知下列热化学方程式:N2(g) +O2(g) =2NO(g) △H1 = + 180.5kJ/mol,2C(s) +O2(g) =2CO(g) △H2=-2210kJ/mol ,C(s)+O2(g)=CO2(g) △H3=-393.5kJ/mol,则 △H=_________。
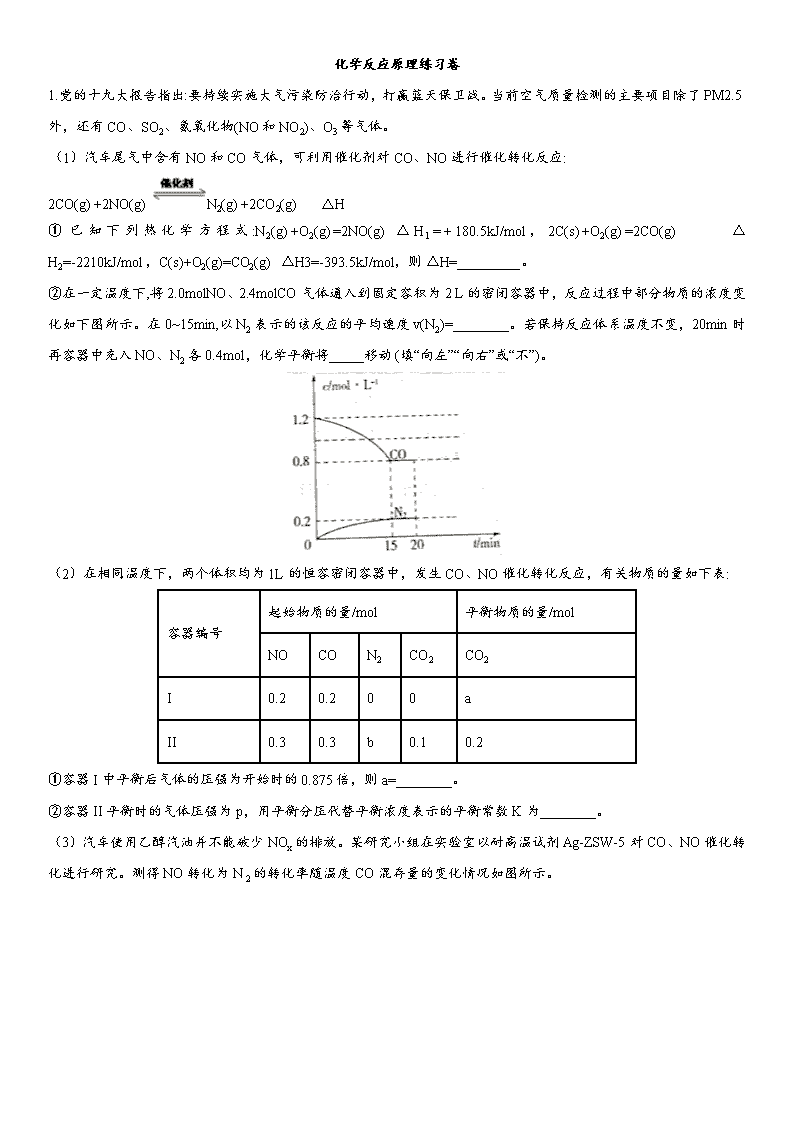
②在一定温度下,将2.0molNO、2.4molCO气体通入到固定容积为2 L的密闭容器中,反应过程中部分物质的浓度变化如下图所示。在0~15min,以N2 表示的该反应的平均速度v(N2)=________。若保持反应体系温度不变,20min时再容器中充入NO、N2 各0.4mol,化学平衡将_____移动 (填“向左”“向右”或“不”)。
(2)在相同温度下,两个体积均为1L 的恒容密闭容器中,发生CO、NO催化转化反应,有关物质的量如下表:
容器编号
起始物质的量/mol
平衡物质的量/mol
NO
CO
N2
CO2
CO2
I
0.2
0.2
0
0
a
II
0.3
0.3
b
0.1
0.2
①容器I中平衡后气体的压强为开始时的0.875倍,则a=________。
②容器II平衡时的气体压强为p,用平衡分压代替平衡浓度表示的平衡常数K 为________。
(3)汽车使用乙醇汽油并不能破少NOx的排放。某研究小组在实验室以耐高温试剂Ag-ZSW-5对CO、NO 催化转化进行研究。测得NO 转化为N 2的转化率随温度CO 混存量的变化情况如图所示。
①在n(NO)/n(CO) =1条件下,最佳温度应控制在_______左右。
②若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为________。
③加入CO后NO转化为N2 的转化率增大的原因是_______ (用平衡移动的原理解释)。
(4)以NO2、O2、熔融NaNO3 组成的燃料电池装置如右图所示,在使用过程中石墨I电极反应生成一种氧化物Y,则该电极反应式为_______。
答案: -746.5kJ·mol- 1 0.013mol/(L·min) 左 0.1 4/p 870K (860~880K 范围都可以) NO直接分解成 N2的反应是放热反应,升高温度不利于反应进行 加入的 CO与NO分解生成的O2反应,使 NO分解平衡向生成 N2的方向移动,因此NO转化率升高 NO2+NO3--e-=N2O5
2.研究发现,NOx和SO2是雾霾的主要成分。
Ⅰ. NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g) 2NO(g) ΔH=+180 kJ·mol-1
2CO(g)+O2(g) 2CO2(g) ΔH=-564 kJ·mol-1
(1)2NO(g)+2CO(g)2CO2(g)+N2(g) ΔH=_________,该反应在_______下能自发进行(填写:高温或低温或任意温度)
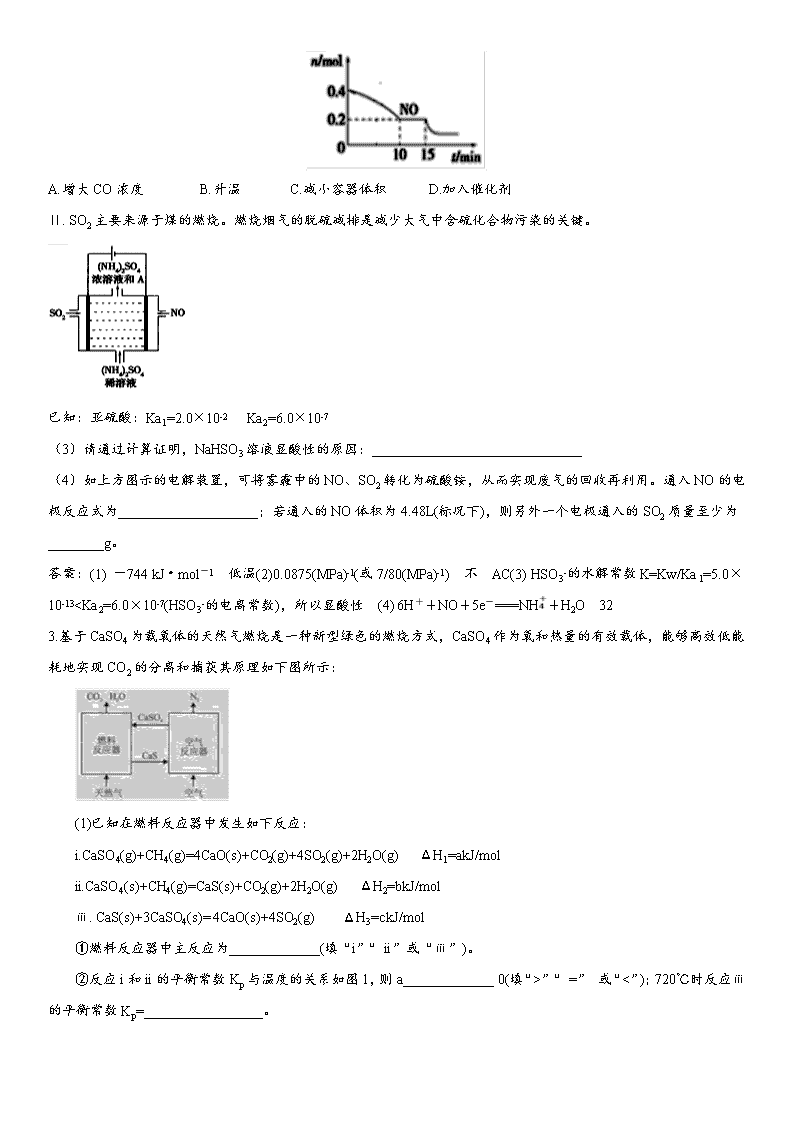
(2)T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,反应过程(0~15 min)中NO的物质的量随时间变化如上图所示。
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=20MPa,则T℃时该反应的压力平衡常数Kp=_______;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,平衡将_____(填“向左”、“向右”或“不”)移动。
②15 min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是__(填序号)
A.增大CO浓度 B.升温 C.减小容器体积 D.加入催化剂
Ⅱ. SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。
已知:亚硫酸:Ka1=2.0×10-2 Ka2=6.0×10-7
(3)请通过计算证明,NaHSO3溶液显酸性的原因:______________________________
(4)如上方图示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为____________________;若通入的NO体积为4.48L(标况下),则另外一个电极通入的SO2质量至少为________g。
答案:(1) -744 kJ·mol-1 低温(2)0.0875(MPa)-1(或7/80(MPa)-1) 不 AC(3) HSO3-的水解常数K=Kw/Ka1=5.0×10-13
”“ =” 或“<”);720℃时反应ⅲ的平衡常数Kp=_________________。
③下列措施可提高反应ii中甲烷平衡转化率的是______________ 。
A.增加CaSO4固体的投入量 B.将水蒸气冷凝 C.降温 D.增大甲烷流量
(2)如图2所示,该燃料反应器最佳温度范围为850℃-900℃之间,从化学反应原理的角度说明原因:________________________。
(3)空气反应器中发生的反应为:CaS(s) +2O2(g)=CaSO4(s) ΔH4=dkJ/mol,根据热化学原理推测该反应为 __________________(填“吸热”或“放热”) 反应。
(4)该原理总反应的热化学方程式为_____________________________。
(5)25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如右图所示,请回答:
25℃时向50mL的Sn2+、Cu2+浓度均为0.01 mol/L的混合溶液中逐滴加入Na2S溶液,当Na2S溶液加到150mL时开始生成SnS沉淀,则此时溶液中Cu2+浓度为___________mol/L。
答案: (1)ii > 1.0×10-18 B (2)温度过低,反应速率较慢;温度较高,副反应增多(3)放热(4) CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=(b+d)kJ/mol或ΔH=(a-c+d)kI/mol(5) 2.5×10-13
4.利用H2S废气制取H2的方法有利于环保。
(l) H2S的电子式是____,H2S溶液中H2S、HS-,S2-的物质的量分数δ(X)随pH的变化如图所示,H2S的电离平衡常数ka1= ___________
(2)利用H2S废气制取H2的方法有多种。
①热化学硫碘循环法 已知循环反应如下:
H2S(g)+ H2SO4(aq)═S(s)+ SO2(g)+2 H2O(l)△H1=61 kJ/mol
SO2(g)+I2(g)+2 H2O(l)=2HI(aq)+ H2SO4(aq)△H2=-151 kJ/mol
2HI(aq)= H2(g)+ I2(g)△H3=110kJ/mol
写出硫化氢气体分解为氢气和固体硫的热化学方程式_____。
②高温热分解法
已知:H2S (g) =H2(g)+l/2S2(g),在恒温密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为cmol/L,测定H2S的转化率,H2S的平衡转化率与温度关系如图所示。据图可知:温度升高平衡常数K_______(填“增大”、“减小”或“不变”)。若985℃时平衡常数K=0.04,则起始浓度c= ______mol/L 。
③电化学法 该法制氢过程的示意图如上图。循环利用的物质是____。反应池中化学反应方程式为______。电解池阳极电极反应式为____ 。
答案:(1) 10-7.24(2) H2S(g)==H2(g)+S(s) ΔH=20KJ·mol-1 增大 0.018 FeCl3 2FeCl3+H2S==2FeCl2+S↓+2HCl Fe2+-e-==Fe3+
5.铁及其化合物在工农业生产中有重要的作用。
(1)已知:①C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol;
②C(s)+CO2(g)=2CO(g) △H2=+172.5kJ/mol
③4Fe(s)+3O2(g)=2Fe2O3(s) △H3=-1651.0kJ/mol
CO还原Fe2O3的热化学方程式为__________________________________________。
(2)高炉炼铁产生的高炉气中含有CO、H2、CO2等气体,用CO和H2在催化剂作用下合成甲醇,是减少污染、节约能源的新举措,反应原理:CO(g)+2H2(g)CH3OH(g) △H。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图。
①在上图A、B、C三点中,选出对应下表物理量最小的点。
反应速率
平衡常数K
平衡转化率α
_________
_________
_________
②在300℃时,向C点平衡体系中再充入0. 5molCO、1.0molH2和0.5mol的CH3OH,该反应向_________方向进行(填“正反应”、‘逆反应”或“不移动”)。
③一定温度下,CO的转化率与起始投料比[n(H2)/n(CO)]的变化关系图所示,测得D点氢气的转化率为40%,则x=_____________。
(3)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。某腐蚀废液中含有0.5mol·L-1Fe3+和0.26mol·L-1的Cu2+,欲使Fe3+完全沉淀[c(Fe3+)≤4×l0-5]而Cu2+不沉淀,则需控制溶液pH的范围为_________。[KspCu(OH)2=2.6×l0-19;KspFe(OH)3=4×l0-38]
(4)莫尔盐,即六水合硫酸亚铁铵晶体,是一种重要的化工原料,在空气中缓慢风化及氧化,欲证明一瓶久置的莫尔盐已经部分氧化,需要进行实验操作是:取少量样品,加无氧水溶解,将溶液分成两份,______________________________________,则证明该样品已部分氧化。
答案:(1)Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g) △H=-23.5 kJ/mol-1 (2) B C B 正反应 3(3) 3 ≤pH<5(4)向一份溶液中加入KSCN溶液,溶液变为血红色;向另一溶液中加入铁氰化钾溶液,产生特征蓝色沉淀
6.碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。消除汽车尾气中的NO、CO,有利于减少PM2.5 的排放。已知如下信息:
①2CO(g)+2NO(g)2CO2(g)+N2(g) △H1=- 748kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2 =-565kJ/mol
(1)在一定条件下N2和O2会转化为NO,写出该反应的热化学方程式:______________。
(2)为研究不同条件对反应的影响,在恒温条件下,向2L恒容密闭容器中加入0.2moINO和0.3moICO,在催化剂存在的条件下发生反应D,10min时反应达到平衡,测得10min内v(NO)=7.5×10-3mol/(L•min),则平衡后CO的转化率为_______________。
(3)其他条件相同,tmin时不同温度下测得NO的转化率如图(I)所示。A点的反应速率v正___(填“>”、“<”或“=”)v逆,A、B两点反应的平衡常数较大的是_______(填“A”或“B”),理由是__________________。
(4)已知常温下: Ka(HNO2)=7.1×10-4mol/L;Kb(NH3·H2O)=1.7×10-5mol/L。0.1mol/LNH4NO2溶液中离子浓度由大到小的顺序是_________,常温下NO2-水解反应的平衡常数K=____。
(5)人工光合作用能够借助太阳能用CO2和水制备化学原料,图(II)是通过人工光合作用制备HCOOH的原理示意图,请写出催化剂b处的电极反应式:______________。
答案:(1)N2(g)+O2(g)===2NO(g) △H=+183kJ/mol(2) 50%(3) > A 正反应为放热反应,温度升高,平衡向左移动,K变小 (4) c(NO2-)>c(NH4+)>c(H+)>c(OH-) 1.4×10-11 (5) CO2+2e-+2H+
=HCOOH
7.汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)已知:2NO(g)+2CO(g)2CO2(g)+N2(g) △H=﹣746.5kJ/mol
2C(s)+O2(g)2CO(g) △H=﹣221 kJ/mol
C(s)+O2(g)CO2(g) △H=﹣393.5 kJ/mol
则N2(g)+O2(g)═2NO(g) △H= ____________ kJ/mol
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表:
时间/s
0
1
2
3
4
5
c(NO)/10-4mol/L
10.0
4.50
C1
1.50
1.00
1.00
c(CO)/10-3mol/L
3.60
3.05
C2
2.75
2.70
2.70
则C2较合理的数值为_________(填字母标号)
A.4.20 B.4.00 C.2.95 D.2.85
(3)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO2(g) CO2(g)+H2(g)得到如下三组数据:
实验组
温度/℃
起始量/mol
平衡量/mol
达到平衡所需时间/min
H2O
CO
CO
H2
i
650
2
4
2.4
1.6
5
ii
900
1
2
1.6
0.4
3
iii
900
a
b
C
d
1
若a=2,b=1,则c=____,三组实验对应平衡常数的关系K(i)_____ K(ii) _____ K(iii)(填“>”、“<”或“=”)。
(4)控制反应条件,CO和H2可以用来合成甲醇和二甲醚,其中合成二甲醚的化学方程式为:3H2(g)+3CO(g)CH3OCH3(g)+CO2(g),在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比的变化如图所示:
①合成二甲醚的最佳氢碳比为__________。
②甲醇使用不当会导致污染,可用电解法消除这种污染。其原理是电解CoSO4、稀硫酸和CH3OH的混合溶液,将Co2+氧化为Co3+,Co3+再将CH3OH氧化成CO2,Co3+氧化CH3OH的离子方程式为_________。
答案:(1) +180.5(2)D (3)0.6 > = (4) 1.0 6Co3++CH3OH+H2O=CO2↑+6Co2++6H+
8.以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命。
(1)以甲醇为原料制取高纯H2是重要研究方向。甲醇水蒸气重整制氢主要发生以下两个反应:
主反应:CH3OH(g)+H2O(g)CO2(g)+3H2(g) △H=+49 kJ•mol-1
副反应:H2(g)+CO2(g)CO(g)+H2O(g) △H=+41 kJ•mol-1
①甲醇在催化剂作用下裂解可得到H2和CO,则该反应的化学方程式为_______________,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是_________________________。
②分析适当增大水醇比(nH2O∶nCH3OH)对甲醇水蒸气重整制氢的好处________________。
③某温度下,将nH2O∶nCH3OH =1∶1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为_________________________。(忽略副反应)
(2)工业常用CH4 与水蒸气在一定条件下来制取H2,其原理为:
CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+203kJ·mol-1
①该反应的逆反应速率表达式为; V逆=k·c(CO)·c3(H2),k为速率常数,在某温度下,测得实验数据如表:
CO浓度(mol·L-1)
H2浓度(mol·L-1)
逆反应速率(mol·L-1·min-1)
0.05
C1
4.8
c2
C1
19.2
c2
0.15
8.1
由上述数据可得该温度下,上述反应的逆反应速率常数k 为__________L3·mol-3·min-1。
②在体积为3L的密闭容器中通入物质的量均为3mol 的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图2所示,则压强Pl___P2(填“大于”或“小于”)温度T3___T4(填“大于”或“小于”);压强为P1时,在N点;v正_____v逆(填“大于”或“小于”或“等于”)。求N点对应温度下该反应的平衡常数K=_______。
答案:(1) CH3OH(g)CO(g)+2H2(g) ΔH = +90 kJ·mol-1 升高温度 提高甲醇的利用率,有利于抑制CO的生成 (﹣1)×100% (2). 1.2×104 大于 小于 大于 48 mol2·L-2
9.Na2SO3是一种重要的还原剂,I2O5是一种重要的氧化剂,二者都是化学实验室中的重要试剂。
(1)已知:2Na2SO3 (aq)+O2(aq)==2Na2SO4(aq) △H =m kJ·mol-1 ,O2(g)O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
(2)Na2SO3的氧化分富氧区和贫氧区两个阶段,贫氧区速率方程为v=k·ca(SO32-)·cb(O2),k为常数。
①当溶解氧浓度为4.0 mg/L(此时Na2SO3的氧化位于贫氧区)时,c(SO32-)与速率数值关系如下表所示,则a=____。
c(SO32-)×103
3.65
5.65
7.65
11.65
V×106
10.2
24.4
44.7
103.6
②两个阶段的速率方程和不同温度的速率常数之比如下表所示。已知1n(k2/k1)=Ea/R(1/T2-1/T1),R 为常数,则Ea(富氧区)______(填“>”或“<”)Ea(贫氧区)。
反应阶段
速率方程
k(297.0K)/k(291.5K)
富氧区
v= k·c(SO32-)·c(O2)
1.47
贫氧区
v= k·ca(SO32-)·cb(O2)
2.59
(3)等物质的量的Na2SO3和Na2SO4混合溶液中,c(SO32-) +c( HSO3-)______(填“>”“<”或“=”)c(SO42-)。
(4)利用I2O5可消除CO 污染,其反应为I2O5(s)+5CO(g)5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。
①从反应开始至a点时的平均反应速率v(CO)=__________。
②b点时,CO的转化率为_____________。
③b点和d点的化学平衡常数:Kb____(填“ >”“<”或“=” )Kd,判断的理由是________。
答案:(1)2Na2SO3(aq)+O2(g)=2Na2SO4(aq) ΔH=(m+n)kJ/mol(2)2 < (3) < (4)0.6mol/(L·min) 80% > 其他条件相同时,曲线II 先达到平衡,温度高于曲线I的,说明温度升高CO2的产率降低,平衡向逆反应方向移动,平衡常数减小
10.充分利用碳的氧化物合成化工原料,既可以减少环境污染和温室效应,又能变废为宝。
Ⅰ.CO2的综合利用是解决温室效应及能源问题的有效途径。
(1)O2和H2在催化剂存在下可发生反应生成CH3OH。已知CH3OH、H2的燃烧热分别为△H1=-akJ·mol-1、△H2=-bkJ·mol-1,且1mol水蒸气转化为液态水时放出ckJ的热量。
则CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=___________kJ·mol-1。
(2)对于CO2(g)+3H2(g)CH3OH(g)+H2O(g).控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇产率的影响如图所示。由图可知获取CH3OH最适宜的温度是______,下列有利于提高CO2转化为CH3OH的平衡转化率的措施是___________。
A.使用催化剂 B.增大体系压强
C.增大CO2和H2的初始投料比 D.投料比不变和容器体积不变,增加反应物的浓度
Ⅱ.CO是合成尿素、甲酸的原料。
(3)合成尿素的反应:2NH3(g)+CO(g)CO(NH2)2(g)+H2(g)△H=-81.0kJ·mol-1。
①T℃时,在体积为2L的恒容密闭容器中,将2molNH3和1molCO混合发生反应,5min时,NH3的转化率为80%。则0~5min内的平均反应速率为v(CO)=___________。
②已知:
温度/K
398
498
…
平衡常数/K
126.5
K1
…
则:K1___________126.5(填“>”或“<”);其判断理由是___________。
(4)通过人工光合作用可将CO转化成HCOOH。
①已知常温下,浓度均为0.1mol·L-1的HCOOH和HCOONa混合溶液pH=3.7,则HCOOH的电离常数Ka的值为___________ (已知lg2=0.3)。
②用电化学可消除HCOOH对水质造成的污染,其原理是电解CoSO4、稀硫酸和HCOOH混合溶液,用电解产生的Co3+将HCOOH氧化成CO2。Co3+氧化HCOOH的离子方程式为___________;忽略体积变化,电解前后Co2+的浓度将___________ (填“增大”“减小”或“不变”)。
答案:(1) a-3b+c (2). 250℃ BD (3)0.08mol·L-1·min-1 < 合成尿素的反应为放热反应,温度升高,平衡逆向移动,K减小 (4) 2×10-4 2Co3++HCOOH=CO2↑+2Co2++2H+ 不变
11.氮气是制备含氮化合物的重要原料,而含氮化合物的用途广泛。回答下列问题:
(1)两个常见的固氮反应为:
N2(g)+O2(g)2NO(g)…………(Ⅰ)
N2(g)+3H2(g)2NH3(g)…………(Ⅱ)
①气相反应中,某物质A 的组成习惯用分压p(A)代替浓度c(A),相应的平衡常数用Kp表示。反应(Ⅰ)的平衡常数表达式Kp=_________________。
②反应(Ⅱ)在不同温度下的平衡常数Kp如下表:
温度/K
298
473
673
Kp
62(KPa)-2
6.2×10-5(KPa)-2
6.0×10-8(KPa)-2
则反应(Ⅱ) 的ΔH________0(填“>”、“<”或“=”)
(2)合成氨工业中原料气所含的少量CO对合成塔中的催化剂有害,可由“铜洗”工序实现对原料气精制。有关反应的化学方程式如下:[Cu(NH3)2]Ac(aq)+CO(g) +NH3(g)
[Cu(NH3)3] ]Ac·CO(aq)ΔH=-35 kJ·mol-1,用化学平衡移动原理分析该工序生产的适宜条件为___________。
(3)氨气是工业制硝酸的主要原料。T℃时,NH3和O2可能发生如下反应:
①4NH3(g)+5O2(g)4NO(g)+6H2O(g) △H= -907kJ•mol-1
②4NH3(g)+3O2(g)2N2(g)+6H2O(g) △H= -1269kJ•mol-1
其中②是副反应。若要减少副反应,提高NO的产率,最合理的措施是___________________;
T℃时N2和O2反应生成NO的热化学方程式为________________________________。
(4)生产和实验中常采用甲醛法测定铵盐的含氢量。反应原理如下:4NH4++6HCHO==(CH2)6N4H+(一元酸)+3H++6H2O,实验步骤如下:
①取铵盐样品溶液a mL,加入稍过量的甲醛溶液(已除去其中的酸),静置1分钟;
②滴入1-2滴酚酞溶液,用cmol·L-1的氢氧化钠溶液滴定至溶液呈粉红色且半分钟内不褪去为止,记录消耗氢氧化钠溶液的体积;
③重复以上操作2 次,三次实验平均消耗氢氧化钠溶液VmL。
则样品中的含氮量为____mg·L-1;下列铵盐不适合用甲醛法测定含氮量的是______(填标号)。
a.NH4HCO3 b. (NH4)2SO4 c.NH4Cl d.CH3COONH4
答案:(1) < (2)低温、加压 (3)使用合适的催化剂 N2(g)+O2(g)=
2NO(g)△H=+181kJ•mol-1 (4) a
12. “低碳经济”备受关注,二氧化碳的回收利用是环保和能源领域研究的热点课题。
(1)已知:①CO(g)+H2O(g)H2(g)+CO2(g)△H=-41kJ·mol-1
②CH4(g)C(s)+2H2(g)△H=+73kJ·mol-1
③2CO(g)C(s)+CO2(g)△H=-171kJ·mol-1
写出CO2与H2反应生成CH4和水蒸气的热化学方程式:_________________________。
(2)CO2与H2在催化剂作用下可以合成二甲醚,反应原理如下:2CO2(g)+6H2(g)
CH3OCH3(g)+3H2O(g) △H。某温度下,向体积为2L的密闭容器中充入CO2与H2,发生上述反应。测得平衡混合物中CH3OCH3(g)的体积分数[φ(CH3OCH3) 与起始投料比Z[Z=]的关系如图1所示;CO2的平衡转化率(a)与温度(T)、压强(p)的关系如图2所示。
①当Z=3时,CO2的平衡转化率a=__________%。
②当Z=4时,反应达到平衡状态后,CH3OCH3的体积分数可能是图1中的_________点(填"D"、"E"或“F")。
③由图2可知该反应的△H_______0(选填“>”、“<“或“=”,下同),压强p1、p2、p3由大到小的顺序为__________。
④若要进一步提高H2的平衡转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有
________________(任写一种)。
(3)我国科研人员研制出的可充电"Na-CO2"电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO22Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示。
①放电时,正极的电极反应式为____________________。
②若生成的Na2CO3和C全部沉积在正极表面,当正极增加的质量为28g时,转移电子的物质的量为__________。
③可选用高氯酸钠-四甘醇甲醚作电解液的理由是________________________。
答案(1)CO2(g)+4H2(g)CH4(g)+2H2O(g) △H=-162 kJ·mol-1(2)75 F < p1>p2>p3 将二甲醚从体系中分离或增大n(CO2)∶n(H2)(3) 3CO2+4Na++4e-=2Na2CO3+C 0.5mol 导电性好、与金属钠不反应、难挥发等(答案合理即给分)
13.MnO2可作氧化剂、催化剂和干电池中的去极化剂,通过图1装置焙烧MrCO3可以制取MnO2。
已知:2MnO(s)+O2(g)=2MnO2(s) △H1=a kJ.mol-l
MnCO3 (s)=MnO(s)+CO2 (g) △H2=b kJ.mol-l
回答下列问题:
(1)写出图1装置中制取MnO2的热化学方程式:__________(△H用含a、b的代数式表示)。
(2)一定条件下,在1L恒容密闭容器中,该反应达到化学平衡时,CO2与O2的物质的量之比为m,氧气的物质的量为2 mol,则化学平衡常数K=__________。
(3)用真空抽气泵不断抽气的目的是___________(从化学平衡的角度回答)。
(4)某科研小组对碳酸锰与空气反应制备二氧化锰的条件(焙烧温度和气氛)进行了研究,获得三幅图(如图所示)。
①制备时焙烧温度为________,气氛条件为________。
②图2中是在常压(0.1 MPa)下获得的数据,试在图2中用虚线画出10 MPa下反应温度与转化率的关系图。__________________
答案:(1)2MnCO3(s)+O2(g)=2MnO2(s)+2CO2 (g) △H=(a+2b) kJ/mol(2)2rn2(3)减小CO2的浓度,使平衡正向移动,提高MnCO3转化率(4) 350℃左右(或325~375℃) 湿空气,其中水分含量为30%左右(或水分含量为20%~40%)
14.为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。已知:①
∆H=180.5kJ·②C和CO的燃烧热(∆H)分别为-393.5kJ·和-283kJ·,则2NO(g)+2CO(g)=N2(g)+2CO2(g) ∆H=_____kJ·
(2)将0.20molNO和0.10molCO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。
①CO在0—9min内的平均反应速率=__________ mol·L-1·(保留两位有效数字);第12min时改变的反应条件可能为_________。
A.升高温度 B.加入NO C.加催化剂 D.降低温度
②该反应在第18min时又达到平衡状态,此时的体积分数为________(保留三位有效数字),化学平衡常数K=____________(保留两位有效数字)。
(3)通过人工光合作用能将水与燃煤产生的转化为HCOOH和。已知常温下0.1mol·的HCOONa溶液pH=10,则HCOOH的电离常数Ka=__________。
答案:(1)-746.5 (2)4.4×10-3 D 22.2% 3.4(3) 1.0×10-7