- 2021-04-17 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
赢在高考高三化学一轮复习专题检测评估练习苏教版
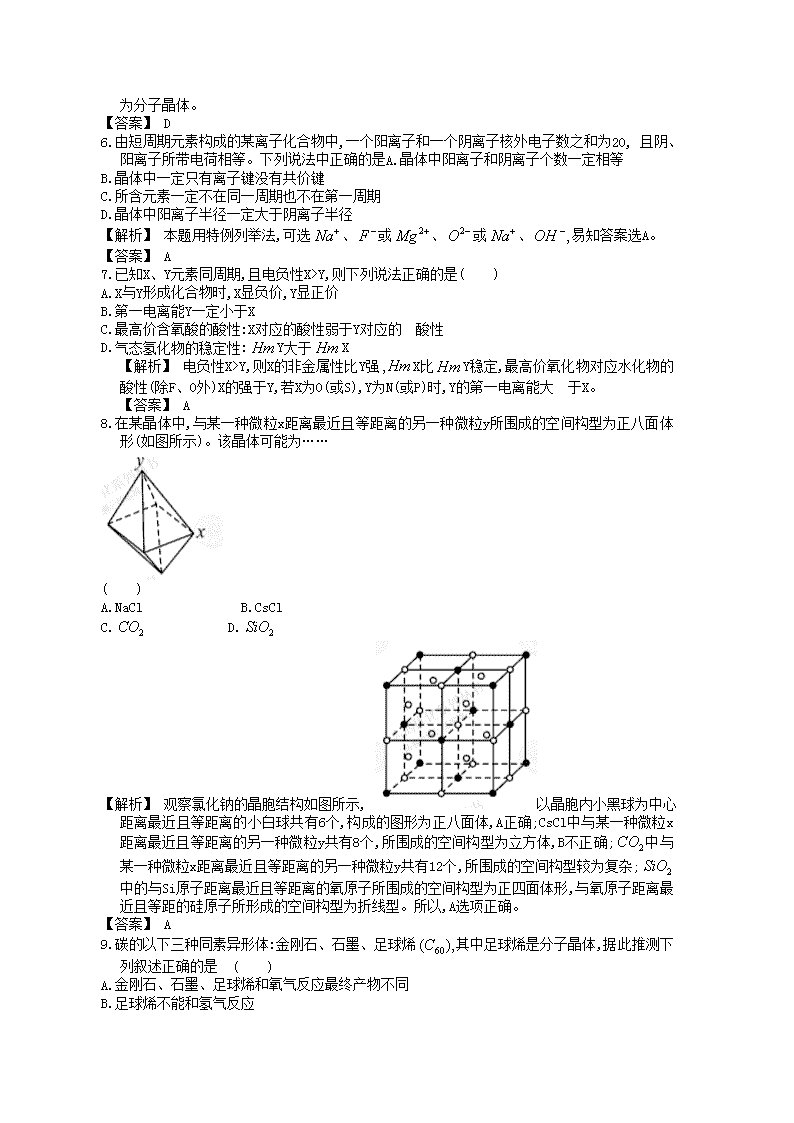
专题检测评估(十一) (时间:90分钟,满分:100分) 一、单项选择题(本题包括10小题,每小题3分,共30分,每小题只有一个选项符合题目要求) 1.关于晶体的下列说法正确的是( ) A.在晶体中只要有阳离子就一定有阴离子 B.在晶体中只要有阴离子就一定有阳离子 C.原子晶体的熔点一定比金属晶体的高 D.分子晶体的熔点一定比金属晶体的低 【解析】 金属晶体中只有阳离子,没有阴离子;离子晶体中既有阳离子,又有阴离子。由此可知A不正确、B正确。在金属晶体中,钨的熔点很高,比一般的原子晶体高,C不正确。金属晶体中,汞常温下呈液态,熔点很低,比常温下呈固态的分子晶体的熔点还低,D不正确。 【答案】 B 2.下列说法中,正确的是( ) A.冰融化时,分子中H—O键发生断裂 B.原子晶体中,共价键的键长越短,通常熔点就越高 C.分子晶体中,共价键键能越大,该分子的熔沸点就越高 D.分子晶体中,分子间作用力越大,则分子越稳定 【解析】 冰为分子晶体,融化时不破坏共价键,A不正确。在分子晶体中,熔沸点只取决于分子间作用力的大小,而与共价键键能无关;分子的稳定性,取决于分子内原子间的共价键键能的高低,而与分子间作用力大小无关,C、D不正确。 【答案】 B 3.下列说法中不正确的是( ) A. 键比键重叠程度大,形成的共价键强 B.两个原子之间形成共价键时,最多有一个键 C.气体单质中,一定有键,可能有键 D.分子中有一个键,2个键 【解析】 稀有气体为单原子分子,分子内不存在化学键。 【答案】 C 4.下列说法中错误的是( ) A.、都是极性分子 B.在和中都存在配位键 C.元素电负性越大的原子,吸引电子的能力越强 D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 【解析】 为V形结构,结构不对称,是极性分子;为平面正三角形结构,结构对称,是非极性分子。 【答案】 A 5.下列结构示意图所对应的晶体中,化学式为且属于分子晶体的是( ) 【解析】 D项晶胞中每个点都是由三个原子组成,可知三个原子先组成分子,再由分子组成晶体,为分子晶体。 【答案】 D 6.由短周期元素构成的某离子化合物中,一个阳离子和一个阴离子核外电子数之和为20, 且阴、阳离子所带电荷相等。下列说法中正确的是A.晶体中阳离子和阴离子个数一定相等 B.晶体中一定只有离子键没有共价键 C.所含元素一定不在同一周期也不在第一周期 D.晶体中阳离子半径一定大于阴离子半径 【解析】 本题用特例列举法,可选、或、或、易知答案选A。 【答案】 A 7.已知X、Y元素同周期,且电负性X>Y,则下列说法正确的是( ) A.X与Y形成化合物时,X显负价,Y显正价 B.第一电离能Y一定小于X C.最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性 D.气态氢化物的稳定性:Y大于X 【解析】 电负性X>Y,则X的非金属性比Y强X比Y稳定,最高价氧化物对应水化物的酸性(除F、O外)X的强于Y,若X为O(或S),Y为N(或P)时,Y的第一电离能大于X。 【答案】 A 8.在某晶体中,与某一种微粒x距离最近且等距离的另一种微粒y所围成的空间构型为正八面体形(如图所示)。该晶体可能为…… ( ) A.NaCl B.CsCl C. D. 【解析】 观察氯化钠的晶胞结构如图所示, 以晶胞内小黑球为中心距离最近且等距离的小白球共有6个,构成的图形为正八面体,A正确;CsCl中与某一种微粒x距离最近且等距离的另一种微粒y共有8个,所围成的空间构型为立方体,B不正确;中与某一种微粒x距离最近且等距离的另一种微粒y共有12个,所围成的空间构型较为复杂;中的与Si原子距离最近且等距离的氧原子所围成的空间构型为正四面体形,与氧原子距离最近且等距的硅原子所形成的空间构型为折线型。所以,A选项正确。 【答案】 A 9.碳的以下三种同素异形体:金刚石、石墨、足球烯其中足球烯是分子晶体,据此推测下列叙述正确的是 ( ) A.金刚石、石墨、足球烯和氧气反应最终产物不同 B.足球烯不能和氢气反应 C.石墨、足球烯均可作为生产耐高温润滑剂的原料 D.足球烯在苯中的溶解度比在乙醇中的溶解度小 【解析】 金刚石、石墨、足球烯分别与氧气反应最终产物都是;足球烯分子中有C=C,能和氢气反应;足球烯是非极性分子,易溶于非极性溶剂苯,在极性溶剂乙醇中溶解度小。 【答案】 C 10.已知晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于晶体的说法错误的是( ) A.该晶体属于原子晶体,其化学键比金刚石更牢固 B.该晶体中每个碳原子连接4个氮原子,每个氮原子连接3个碳原子 C.该晶体中碳原子和氮原子和最外层都满足8电子结构 D.该晶体与金刚石相似,都是原子间以非极性键形成空间网状结构 【解析】 氮原子的半径小于碳原子半径,该晶体中N—C键键能大于金刚石晶体中C—C键键能,A项正确;根据该晶体硬度比金刚石还大的性质可知为原子晶体,但化学键为极性共价键,D项错误;晶体中氮原子和碳原子间以共价键结合,每个原子最外层都达到了8电子稳定结构,C项正确;根据碳原子形成4个键,氮原子形成3个键,可知晶体内每个碳原子连接4个氮原子 、每个氮原子连接3个碳原子 【答案】 D 二、不定项选择题(本题包括6小题,每小题3分,共18分,每小题有一个或两个选项符合题目要求) 11.物质结构理论推出:金属晶体中金属离子与自由电子之间的强烈相互作用,叫金属键。金属键越强,其金属的硬度越大,熔沸点越高,且据研究表明,一般说来金属原子半径越小,价电子数越多,则金属键越强。由此判断下列说法错误的是( ) A.镁的硬度大于铝 B.镁的熔沸点低于钙 C.镁的硬度大于钾 D.钙的熔沸点高于钾 【解析】 半径大于半径,镁的金属键比铝的弱,所以镁的硬度比铝小,A不正确。的半径比小,镁的金属键比钙的强,所以镁的熔沸点大于钙,B不正确。、半径都小于而其所带电荷数又高于所以镁 ckslash ,钙的金属键比钾的强,硬度及熔沸点都比钾高,C、D正确。 【答案】 AB 12.(2011海南化学,19-Ⅰ)下列分子中,属于非极性的是… ( ) A. B. C. D. 【解析】 根据价层电子对互斥理论(VSEPR)可得四种分子的结构如下: 【答案】 BC 13.海底有大量天然气水合物,可满足人类1 000年的能源需要,天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个甲烷分子或1个游离水分子,若晶体中每8个笼中有6个容纳分子,另外2个笼被游离的分子填充,则天然气水合物的平均组成可表示为( ) A. B. C./ D. 【解析】 天然气水合物中分子是正四面体构型,结构对称,是非极性分子是V形结构,属于极性分子。由于晶体中每8个笼中有6个容纳分子,另外2个笼被游离的水分子填满。所以8个笼中有6个个与个数比为1∶8,即天然气水合物的平均组成为。 【答案】 B 14.下列说法正确的是( ) A.HF、HCl、HBr、HI的沸点依次升高 B.的熔点、沸点大于的是由于分子之间存在氢键 C.乙醇分子与水分子之间只存在范德华力 D.氯的各种含氧酸的酸性由强到弱排列为 【解析】 由于分子间存在氢键,HF的沸点在HX中最高,乙醇分子与水分子之间除存在范德华力,还存在氢键,D项中酸性由强到弱的顺序为HClO。 【答案】 B 15.在解释下列物质性质的变化规律与物质结构间的因果关系时,与化学键无关的变化规律是( ) A.HF、HCl、HBr、HI的热稳定性依次减弱 B.NaF、NaCl、NaBr、NaI的熔点依次降低 C.Na、K、Rb、Cs的熔、沸点逐渐降低 D.的熔、沸点小于的熔、沸点 【解析】 A中各物质形成分子晶体,分子的稳定性与化学键有关。B中,各物质都为离子晶体,其熔点的高低与离子键的强弱成正比。C中,各物质都形成金属晶体,其熔、沸点的高低与金属键的强弱成正比。D中和都形成分子晶体的熔、沸点高,主要是因分子间形成氢键所致。 【答案】 D 16.已知的立体结构如图,其中1 6处的小圆圈表示分子,且各相邻的分子间的距离相等(图中虚线长度相等)。位于八面体的中心,若其中三个被取代,所形成的的同分异构体的数目为( ) A.1 B.2 C.3 D.4 【答案】 B 三、非选择题(本题包括4小题,共52分) 17.(12分)(2011山东理综,32)氧是地壳中含量最多的元素。 (1)氧元素基态原子核外未成对电子数为 个。 (2)分子内的O—H键、分子间的范德华力和氢键从强到弱依次为 。 的沸点比高,原因是 。 (3)可与形成中O原子采用 杂化。中H—O—H键角比中H—O—H键角大,原因为 。 (4)CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为a N表示阿伏加德罗常数,则CaO晶胞体积为 。 【解析】 (1)氧元素核外有8个电子,其基态原子核外电子排布为所以氧元素基态原子核外未成对电子数为2个。 (2)O—H键属于共价键,键能最大;分子间的范德华力和氢键均属于分子间作用力的范畴,但氢键要强于分子间的范德华力,所以它们从强到弱的顺序依次为O—H键、氢键、范德华力;氢键不仅存在于分子之间,有时也存在于分子内。邻羟基苯甲醛在分子内形成氢键,对羟基苯甲醛在分子间形成氢键,所以对羟基苯甲醛的沸点比邻羟基苯甲醛的高。 (3)依据价层电子对互斥理论知中O上的孤电子对数目由于中心原子O的价层电子对数共有3+1=4对,所以价层电子对构型为四面体形,因此中O原子采用的是杂化;同理可以计算出中O原子上的孤电子对数目)=2,因此排斥力较大,水中H—O—H键角较小。 (4)氯化钠的晶胞如图所示,因此氯化钠晶胞中含有的氯离子个数为同样也可以计算出钠离子个数为4。由于CaO与NaCl的晶胞同为面心立方结构,所以CaO晶胞中含有4个钙离子和4个氧离子,因此CaO晶胞体积为 。 【答案】 (1)2 (2)O—H键、氢键、范德华力 邻羟基苯甲醛形成分子内氢键,而对羟基苯甲醛形成分子间氢键,分子间氢键使分子间作用力增大 中O原子有2个孤电子对只有1个孤电子对,排斥力较小 18.(14分)(2011海南化学,19-II)铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如溶液常用作电解液、电镀液等。请回答以下问题: (1)可由金属铜与浓硫酸反应制备,该反应的化学方程式为 ; (2)粉末常用来检验一些有机物中的微量水分,其原因是 ; (3)的立体构型是,其中S原子的杂化轨道类型是 ; (4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为 ;一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心、Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为 ;该晶体中,原子之间的作用力是 ; (5)上述晶体具有储氢功能,氢原子可进入到由 Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与的结构相似,该晶体储氢后的化学式应为 。 【解析】 (3)硫酸根中心原子的孤电子对数为+2)=0,成键电子对数为4,所以价层电子对构型为正四面体结构,故为正四面体结构,中心原子为杂化;(4)Au电子排布可类比Cu,只是电子层多两层。由于铜金合金是面心立方堆积,晶胞内NN(Au)=;的晶胞结构为,若将Cu原子与Au原子等同看待,则该晶体中储氢个数为8,所以该晶体储氢后的化学式为。 【答案】 ↑ (2)白色无水硫酸铜粉末可与水结合生成蓝色的显示水合铜离子特征蓝色 (3)正四面体形 杂化 3∶1 金属键 19.(14分)乙炔是有机合成工业的一种原料。工业上曾用与水反应生成乙炔。 (1)中与互为等电子体的电子式可表示为 ;1 mol 中含有的键数目为 。 (2)将乙炔通入溶液生成红棕色沉淀。基态核外电子排布式为 。 (3)乙炔与氢氰酸反应可得丙烯腈CH—。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。 晶体的晶胞结构与NaCl晶体的相似(如下图所示),但晶体中哑铃形的存在,使晶胞沿一个方向拉长。晶体中1个周围距离最近的数目为 。 【解析】 (1)根据等电子体原理可知的电子式,在1 mol三键中含有2 mol的键和1 mol的键,故1 mol 中,含有2N个键。 (2)Cu为29号元素,要注意3d轨道写在4s轨道的前面,同时还有就是它的3d结构的基态电子排布式为。 (3)通过丙烯氰的结构可以知道碳原子的杂化轨道类型为sp杂化和杂化,同一直线上最多有3个原子。 (4)从晶胞结构图中可以看出,1个周围距离最近的有4个,而不是6个,要特别主要题给的信息。 【答案】 (1) 2N (3)sp杂化 、sp杂化 3 (4)4 20.(12分)(2012江苏苏北四市模拟,21-A)原子序数小于36的X、Y、Z、W四种元素,原子序数依次增大。其中X元素的一种核素的质量数为12,中子数为6;Y是空气中含量最多的元素;Z的基态原子核外5个轨道上填充了电子,且有2个未成对电子;W的原子序数为22。 回答下列问题(答题时用对应元素符号表示): (1)分子中X原子轨道的杂化类型为 ,1mol 中含有键与键的数目之比为 。 (2)X、Y、Z三种元素的第一电离能由大到小的顺序为 。 与元素Y的一种含氢离子互为等电子体,元素Y的这种含氢离子的化学式是 。 (4)W的一种氧化物晶胞结构如图所示,该氧化物的化学式为 。 (5)在浓的的HCl溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为的绿色晶体,该晶体中两种配位体的物质的量之比为1∶5,则该配合物的化学式为 。 【解析】 由题意可知,X为C、Y为N、Z为O、W为Ti。的结构式为OCO,C原子与两个原子形成共价键,且不存在孤电子对,所以C原子发生sp杂化。在分子中键与键各为2个。N原子的p轨道半充满,因而第一电离能出现反常。在晶胞中,顶点上有8个Ti离子,中心有1个Ti离子;面心有4个O离子,体内还有2个O离子。所以晶胞内共含有Ti离子2个,O离子4个,二者的离子个数比为1∶2,因而化学式为。在配合物中,中心离子的配位数为6,且两种配位体的物质的量之比为1∶5,则该配合物6个配位体中只能含1个、5个。 【答案】 (1)sp杂化 1∶1 (2)N>O>C 查看更多