- 2021-04-17 发布 |
- 37.5 KB |
- 27页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习第5单元第2讲元素周期表元素周期律学案
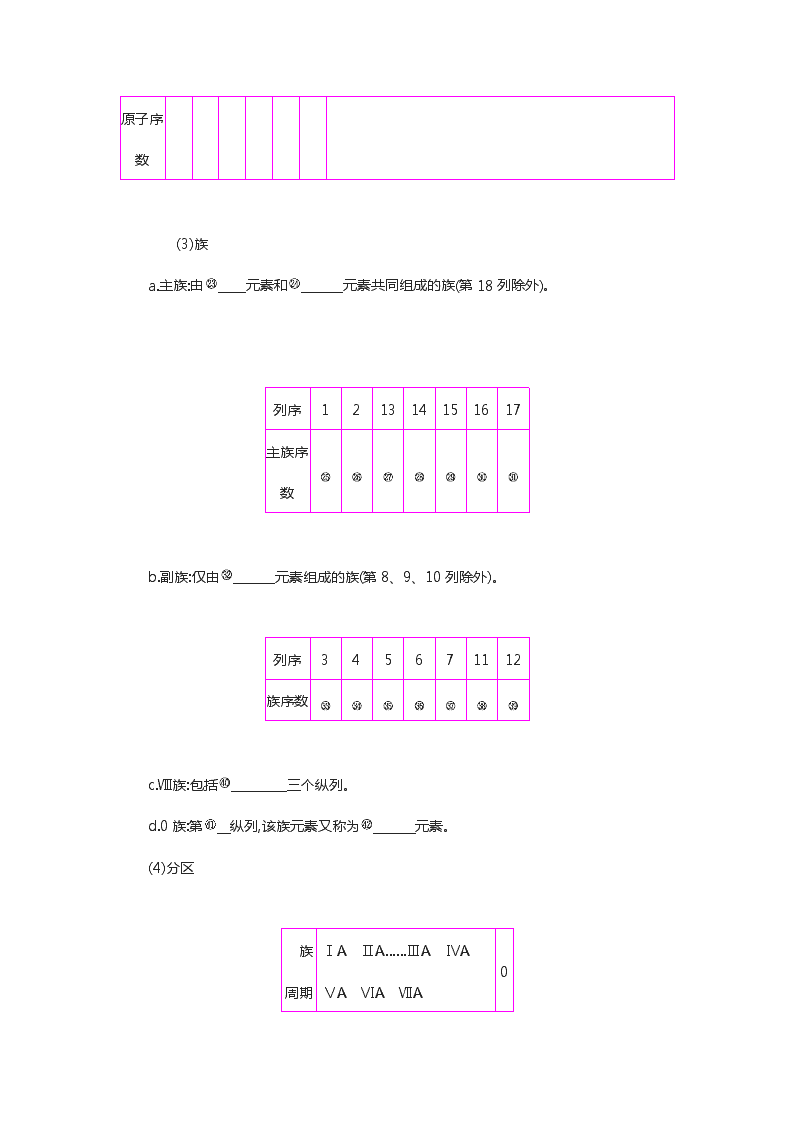
第2讲 元素周期表 元素周期律 见《自学听讲》P90 一、元素周期表 1.原子序数 对于一个原子:原子序数=① =② =③ =④ -⑤ 。 2.元素周期表 (1)编排原则 a.把⑥ 相同的元素按⑦ 递增的顺序从左到右排成一横行,共有⑧ 个横行。 b.把不同横行中⑨ 相同的元素按⑩ 递增的顺序从上到下排成一纵行,共有 个纵行。 (2)周期 短周期 长周期 序号 1 2 3 4 5 6 7 元素种数 不完全周期,最多容纳32种元素,目前排了26种元素 0族元素 86 原子序数 (3)族 a.主族:由 元素和 元素共同组成的族(第18列除外)。 列序 1 2 13 14 15 16 17 主族序数 b.副族:仅由 元素组成的族(第8、9、10列除外)。 列序 3 4 5 6 7 11 12 族序数 c.Ⅷ族:包括 三个纵列。 d.0族:第 纵列,该族元素又称为 元素。 (4)分区 族 周期 ⅠA ⅡA……ⅢA ⅣA ⅤA ⅥA ⅦA 0 1 2 3 4 5 6 7 稀有气体 a.原子失电子能力最强的元素是位于元素周期表左下角的 元素(不考虑放射性元素)。 b.原子得电子能力最强的元素是位于元素周期表右上角的 元素。 c.分界线附近元素的性质:既表现一定的元素原子得电子能力,又表现一定的元素原子失电子能力。 (5)元素周期表中的特殊位置 a.过渡元素:元素周期表中从 族到 族10个纵列共六十多种元素,这些元素都是金属元素。 b.镧系:元素周期表第 周期中,57号元素镧到71号元素镥共15种元素。 c.锕系:元素周期表第 周期中,89号元素锕到103号元素铹共15种元素。 d.超铀元素:在锕系元素中92号元素铀(U)以后的各种元素。 3.元素周期表和元素周期律应用的重要意义 (1)科学预测:为新元素的发现及预测它们的原子结构和性质提供线索。 (2)寻找新材料:在 的元素中寻找半导体;在 元素中寻找优良催化剂和耐高温、耐腐蚀的合金材料;用 等元素研制新型农药。 1.含元素种类最多的周期是第六周期,有32种元素;含元素种类最多的族是ⅢB族,共有32种元素。 2.过渡元素包括7个副族和第Ⅷ族的元素,全部都是金属元素,原子最外层电子数不超过2(1~2个)。 3.最外层电子数为3~7的原子一定属于主族元素,且最外层电子数等于主族的族序数。 4.最外层电子数相同的元素不一定在同一族中,如He与Mg。 二、元素周期律 1.定义: 随着原子序数的递增而呈 变化的规律。 2.实质:元素原子 的周期性变化。 3.元素周期表中主族元素性质的递变规律 内容 同周期(从左到右) 同主族(从上到下) 原子半径 电子层结构 电子层数 最外层电子数 电子层数 最外层电子数 (续表) 内容 同周期(从左到右) 同主族(从上到下) 得电子能力 失电子能力 金属性 非金属性 主要化合价 最高正价: (O、F除外) 最低负价= 最高正价=主族 序数(O、F除外) 最高价氧化物对应水化物的酸碱性 酸性 碱性 酸性 碱性 非金属元素气态氢化 气态氢化物的形成逐渐变易,气态氢化物的稳定性 气态氢化物的形成逐渐变难,气态氢化物稳定性 物的形成及稳定性 以上规律主要是针对主族元素而言的,副族和第Ⅷ族元素情况较复杂。 ①核电荷数 ②质子数 ③核外电子数 ④质量数 ⑤中子数 ⑥电子层数 ⑦原子序数 ⑧7 ⑨最外层电子数 ⑩电子层数 18 2 8 8 18 18 32 2 10 18 36 54 短周期 长周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 长周期 ⅢB ⅣB ⅤB ⅥB ⅦB ⅠB ⅡB 8、9、10 18 稀有气体 Cs F ⅢB ⅡB 六 七 分界线附近 过渡 氟、氯、硫、磷 元素的性质 周期性 核外电子排布 依次减小 依次增大 相同 依次增加 依次增加 相同 依次增强 依次减弱 依次减弱 依次增强 依次减弱 依次增强 依次增强 依次减弱 升高 主族序数-8 逐渐增强 逐渐减弱 逐渐减弱 逐渐增强 逐渐增强 逐渐减弱 1.牢记一~六周期的元素种类数分别为2、8、8、18、18、32。 2.掌握5个关系式 (1)质子数=原子序数。 (2)电子层数=周期序数。 (3)最外层电子数=主族序数。 (4)最高正价数=主族序数(O、F除外)。 (5)最低负价=主族序数-8。 3.理解元素性质的2个递变规律 (1)同周期(从左到右)原子半径逐渐减小金属性逐渐减弱,非金属性逐渐增强 (2)同主族(从上到下)原子半径逐渐增大金属性逐渐增强,非金属性逐渐减弱 4.周期表的结构记忆口诀 七横十八纵,横行叫周期,共有七周期,三四分长短,第七尚未满。 纵行叫作族,共有十六族,Ⅷ族最特殊,三纵为一族,一八依次现①,一零再一遍②。 二三分主副,遇三就变族,镧、锕③各十五,都属第三副。 注:①指ⅠA、ⅡA、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ;②指ⅠB、ⅡB、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、0;③指镧系和锕系元素,都有十五种元素,分别位于第六周期、第七周期的第ⅢB族。 见《自学听讲》P91 元素周期表的结构及其应用 1.请在下表中画出元素周期表的轮廓,并在表中按要求回答下列问题: (1)标出族序数。 (2)画出金属与非金属的分界线,并用阴影表示出过渡元素的位置。 (3)标出镧系、锕系的位置。 (4)写出各周期元素的种数。 (5)写出稀有气体元素的原子序数。 (6)标出113~118号元素的位置。 答案 2.(1)甲、乙是元素周期表中同一主族相邻周期的两种元素(其中甲在上一周期),若甲的原子序数为x,则乙的原子序数可能是 。 (2)若甲、乙分别是同一周期的第ⅡA族和第ⅦA族元素,原子序数分别为m和n,则m和n的关系可能为 。 (3)若A、B是相邻周期同主族元素(A在B的上一周期),A、B所在周期分别有m种和n种元素,A的原子序数为x,B的原子序数为y,则x、y的关系为 。 解析 (1)因前六周期中元素的数目分别为2、8、8、18、18、32;同一主族中乙的原子序数可以是x+2、x+8、x+18、x+32。(2)对于第一、二、三周期,同一周期的ⅡA族和ⅦA族元素的原子序数只相差5,而对于第四、五周期来说,由于存在过渡元素,同一周期的ⅡA族和ⅦA族元素的原子序数则相差15;而对于第六、七周期来说,由于存在镧系和锕系元素,同一周期的第ⅡA族和ⅦA族元素的原子序数则相差29。(3)当A、B在第 Ⅰ A族和第 Ⅱ A族时,y=x+m;当A、B在第ⅢA~ⅦA族时,y=x+n。 答案 (1)x+2、x+8、x+18、x+32 (2)n=m+5、n=m+15、n=m+29 (3)y=x+m或y=x+n 一、根据稀有气体元素的原子序数来确定元素在周期表中位置的方法 原子序数-最邻近的稀有气体元素的原子序数=ΔΖ。 若ΔΖ<0,则与稀有气体元素同周期,族序数为8-|ΔΖ| 若ΔΖ>0,则在稀有气体元素的下一周期,族序数为ΔΖ 例如:①35号元素(相邻近的是36Kr),则35-36=-1,故周期数为4,族序数为8-|-1|=7,即该元素为第四周期ⅦA族的溴元素。 ②87号元素(相邻近的是86Rn),则87-86=1,故周期数为7,族序数为1,即该元素为第七周期ⅠA族的钫元素。 二、元素周期表结构中隐含的两条规律 1.同周期,相邻主族元素原子序数差的关系 (1)短周期元素原子序数差=族序数差。 (2)两元素分布在过渡元素同侧时,原子序数差=族序数差。两元素分布在过渡元素两侧时,第二或第三周期元素的原子序数之差=族序数差;第四或五周期元素原子序数差=族序数差+10,第六周期元素原子序数差=族序数差+24。 2.同主族、相邻周期元素的原子序数差的关系 (1)第ⅠA族元素,随电子层数的增加,原子序数依次相差2、8、8、18、18、32。 (2)第ⅡA族和0族元素,随电子层数的增加,原子序数依次相差8、8、18、18、32。 (3)第ⅢA~ⅦA族元素,随电子层数的增加,原子序数依次相差8、18、18、32。 1.根据中学化学教材中所附元素周期表判断,下列叙述不正确的是( )。 ①两短周期元素原子序数相差8,则周期数一定相差1 ②L层电子数为奇数的所有元素所在族的序数与该元素原子的L层电子数相等 ③某元素原子的核电荷数为53,则该元素位于第五周期ⅦA族 ④除0族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 ⑤副族元素没有非金属元素 ⑥碱金属元素是指第ⅠA族的所有元素 ⑦元素周期表中的各主族元素都含有金属元素和非金属元素 A.①③④ B.④⑤⑦ C.④⑥⑦ D.②④⑦ 解析 ①在短周期里,除第一周期含两种元素外,其余两个周期所含元素都是8种。若两元素原子序数相差8,则不可能在同一周期也不可能相差两个周期,正确;②L层电子数为奇数,则L层电子一定是核外最外层电子,其所在族的序数与该元素原子的L层电子数相等,正确;③稀有气体元素Xe是54号元素,故核电荷数为53的元素位于第五周期ⅦA族,正确;④氧、 氟没有最高正价,错误;⑥ⅠA族中的氢元素不是碱金属元素,错误;⑦ⅦA族中没有金属元素,ⅡA族中没有非金属元素,错误。综上分析,C项正确。 答案 C 2.在元素周期表中,铂元素如图所示,下列有关说法正确的是( )。 A.铂是非金属元素,在常温下呈固态 B.78208Pt和 78198Pt的核外电子数相同,互为同位素 C.“195.1”是铂的质量数 D.由“78”可以推出Pt为第五周期元素 解析 铂为金属元素,A项错误;78208Pt和 78198Pt的质子数相同,中子数不同,是两种不同的核素,二者互为同位素,B项正确;“195.1”是铂元素的相对原子质量,C项错误;由“78”推出Pt为第六周期元素,D项错误。 答案 B 3.已知a、b、c、d四种短周期主族元素,在周期表中相对位置如图所示,下列说法正确的是( )。 a b c d A.a、c两元素的最高正价一定相等 B.d的原子序数不可能是b的原子序数的3倍 C.c的最高价氧化物对应的水化物可溶于d的最高价氧化物对应的水化物 D.若c元素最高价氧化物对应的水化物是强酸,则d元素的单质具有强氧化性 解析 a、b、c、d 四种短周期主族元素,由在周期表中相对位置可知,a、b位于第二周期,c、d位于第三周期。若a、c位于ⅥA族,a为O元素, O无最高正价,A项错误;若b为Be元素,d为Mg元素,原子序数分别为4、12,原子序数为3倍关系,B项错误;若c的最高价氧化物对应的水化物为氢氧化铝,d的最高价氧化物对应的水化物为硅酸,则二者不发生反应,C项错误;若c元素最高价氧化物对应的水化物是强酸,c为S元素,则d为Cl元素,Cl2具有强氧化性,D项正确。 答案 D 4.已知X、Y、Z三种主族元素在周期表中的位置如图所示,设X的原子序数为a。下列说法不正确的是( )。 Y X Z A.Y与Z的原子序数之和可能为2a B.Y的原子序数可能为a-17 C.Z的原子序数可能为a+31 D.X、Y、Z一定为短周期元素 解析 若X、Y、Z分别位于第四、三、五周期的右侧,则Y的原子序数为a-17,Z的原子序数为a+17,Y与Z的原子序数之和为2a;若X、Y、Z分别位于第五、四、六周期的右侧,Z的原子序数可能为a+31。X、Y、Z为主族元素,Y一定不在第一周期,D项错误。 答案 D 5.X、Y、Z三种短周期元素在周期表中的相对位置如图所示,Y原子的最外层电子数是次外层电子数的3倍,下列说法正确的是( )。 A.在三种元素形成的气态氢化物中,Y的气态氢化物最稳定 B.Z元素的氧化物对应的水化物一定是一种强酸 C.三种元素原子半径的大小顺序为X>Y>Z D.Z的单质与Fe反应生成的化合物中,铁元素显+3价 解析 Y是氧元素,X是氮元素,Z是硫元素。SO2对应的水化物H2SO3是弱酸,B项错误;三种元素原子半径的大小顺序为Z>X>Y,C项错误;S与Fe反应生成的是FeS,FeS中铁元素显+2价,D项错误。 答案 A 6.X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。若Z原子的最外层电子数是最内层电子数的3倍,则下列说法中正确的是( )。 A.X的最常见气态氢化物的水溶液呈酸性 B.最高价氧化物对应水化物的酸性:W>Z C.Z的单质与氢气反应比Y单质与氢气反应剧烈 D.X的原子半径小于Y 解析 根据图示元素的位置关系,结合Z原子的最外层电子数是最内层电子数的3倍,可以推出Z为S,从而可以确定X为N,Y为O,W为Cl。N的最常见气态氢化物NH3的水溶液呈碱性,A项错误;非金属性Cl强于S,因此最高价氧化物对应水化物的酸性HClO4>H2SO4,B 项正确;非金属性O强于S,因此O2与H2反应比S与H2反应剧烈,C项错误;同周期元素从左到右,原子半径逐渐减小,因此N的原子半径大于O,D项错误。 答案 B 7.结合如图所示的元素周期表,回答下列问题: (1)表中所列元素,属于短周期元素的有 (填字母,下同),属于主族元素的有 ;b元素位于第 周期 族;i元素位于第 周期 族。 (2)f元素位于第 周期 族,请按氦元素的样式写出该元素的原子序数、元素符号、元素名称、相对原子质量。 解析 (1)根据元素周期表的结构知:第一周期有2种元素,第二、三周期各有8种元素,分别位于第1、2、13~18纵行,第四、五、六、七周期为长周期,包含1~18纵行,由此可找出各元素在元素周期表中的位置。(2)第三周期ⅥA族元素为硫(S),原子序数为16,相对原子质量为32。 答案 (1)a、b、c、d、e、f、g;a、b、c、d、e、f;二;ⅣA;四;ⅡB (2)三;ⅥA; 元素周期律及其应用 1.判断正误(正确的打“√”,错误的打“×”)。 (1)同周期主族元素中,第ⅦA族元素的原子半径最小。( ) (2)第ⅦA族元素自上而下,原子半径逐渐减小。( ) (3)同周期主族元素形成的简单离子中,第ⅠA族元素的离子半径最小。( ) (4)离子半径由大到小的顺序:r(S2-)>r(Cl-)>r(Al3+)>r(Mg2+)>r(Na+)。( ) (5)第ⅤA族元素的最高正价与族序数相同。( ) (6)第二周期元素从左到右,最高正价从+1递增至+7。( ) (7)同周期金属元素的化合价越高,其原子失电子能力越强。( ) (8)金属性由强到弱的顺序:Li>Na>K。( ) (9)非金属性由强到弱的顺序:F>Cl>Br>I。( ) 答案 (1)√ (2)× (3)× (4)× (5)√ (6)× (7)× (8)× (9)√ 2.下列实验不能达到实验目的的是( )。 选项 实验操作 实验目的 A Cl2、Br2分别与H2反应 比较氯、溴的非金属性强弱 B 向MgCl2、AlCl3溶液中分别通入氨 比较镁、铝的金属性强弱 C 测定相同物质的量浓度的Na2CO3、 比较碳、硫的非金属性强弱 Na2SO4溶液的pH D Fe、Cu分别与稀盐酸反应 比较铁、铜的金属性强弱 解析 A项,Cl2、Br2分别与H2反应,根据反应条件的难易和反应剧烈程度可判断出氯、溴的非金属性强弱;B项,向MgCl2、AlCl3溶液中分别通入氨,MgCl2与AlCl3均生成相应的沉淀,不能比较二者的金属性强弱;C项,测定相同物质的量浓度的Na2CO3、Na2SO4溶液的pH,根据pH可判断出Na2CO3与Na2SO4水解程度的大小,即判断出酸性H2CO3查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档