- 2021-04-16 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习化学计量在实验中的应用学案(1)
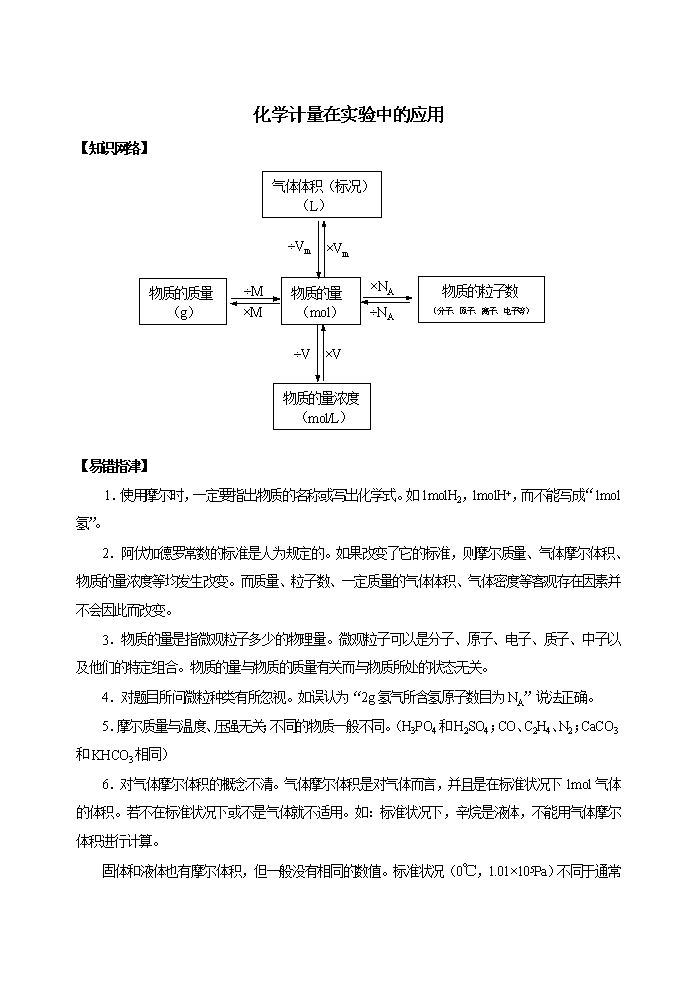
化学计量在实验中的应用 【知识网络】 ×Vm ÷Vm ÷NA ×NA ×M ÷M ×V ÷V 物质的量 (mol) 物质的质量 (g) 物质的粒子数 (分子、原子、离子、电子等) 气体体积(标况) (L) 物质的量浓度 (mol/L) 【易错指津】 1.使用摩尔时,一定要指出物质的名称或写出化学式。如1molH2,1molH+,而不能写成“1mol氢”。 2.阿伏加德罗常数的标准是人为规定的。如果改变了它的标准,则摩尔质量、气体摩尔体积、物质的量浓度等均发生改变。而质量、粒子数、一定质量的气体体积、气体密度等客观存在因素并不会因此而改变。 3.物质的量是指微观粒子多少的物理量。微观粒子可以是分子、原子、电子、质子、中子以及他们的特定组合。物质的量与物质的质量有关而与物质所处的状态无关。 4.对题目所问微粒种类有所忽视。如误认为“2g氢气所含氢原子数目为NA”说法正确。 5.摩尔质量与温度、压强无关;不同的物质一般不同。(H3PO4和H2SO4;CO、C2H4、N2;CaCO3和KHCO3相同) 6.对气体摩尔体积的概念不清。气体摩尔体积是对气体而言,并且是在标准状况下1mol气体的体积。若不在标准状况下或不是气体就不适用。如:标准状况下,辛烷是液体,不能用气体摩尔体积进行计算。 固体和液体也有摩尔体积,但一般没有相同的数值。标准状况(0℃,1.01×105Pa )不同于通常状况(25℃,1.01×105Pa)。 7.物质的量的大小,可衡定物质所含微粒的多少,但物质的量的数值并不是微粒的个数,它的个数应该是物质的量乘以6.02×1023mol-`。 8.气体摩尔体积使用的条件是:前提——标准状况;是指气体本身的状况,而不是外界条件的状况,因此就不能说“1mol水蒸气在标准状况下所占的体积是22.4L”。研究对象是——气体(包括混合气体),但概念中的“任何气体”却不包括一些易挥发性物质的蒸气,如水蒸气、溴蒸气、碘蒸气等。量的标准是——1mol,结论——约是22.4L,此外还应注意:并非只有标准状况下,1mol气体的体积才约是22.4L。 9.外界温度和压强影响气体体积的大小,但气体的质量和物质的量的多少则不受其影响。 10.对阿伏加德罗常数的判断题: (1)若给出物质的体积:一看是否为标准状况下----不为标准状况无法求n;二看物质在标准状况下是否为气体---不为气态无法求n; (2)若给出气体的物质的量或质量:粒子数与外界条件无关; (3)若是惰性气体,注意为单原子分子; (4)若是气体单质,不一定是双原子分子; (5)其他:联系水解、电解、P4(6个P-P键)、SiO2(Si-O四键)等。 【典型例题评析】 例1 下列说法正确的是(N表示阿伏加德罗常数的值)(1999年全国高考题) A.28g氮气所含的原子数目为N B.4g金属钙变成钙离子时所失去的电子数目为0.1N C.1mol甲烷的质量与N个甲烷分子的质量之和相等 D.标准状况下,22.4L甲烷与乙炔混合物所含的分子数为N 思路分析:28g氮气(双原子分子)物质的量为1mol,其氮原子数目为2N而不是N;4g金属钙即0.1mol,因Ca-2e-=Ca2+,钙失去的电子数目为0.2N;1mol甲烷含N个甲烷分子,C对;D项考查了气体摩尔体积的一个要点:“任何气体”,其中也包括混合气,也对。 答案:C、D 方法要领: 1.阿伏加德罗常数的运用是高考考查和命题的热点。如:已知物质的质量,物质的量,物质的体积,求粒子的数目或比较其粒子的数目大小;已知溶液的体积和浓度,求溶液中溶质的粒子的数目,或比较其粒子的数目大小;已知粒子的数目,求物质的质量,物质的量,物质的体积,溶液中溶质的粒子的浓度或溶液的浓度;物质在发生氧化还原反应时电子转移的数目。 2.解题时要特别注意所给的条件,求什么粒子数,审题要仔细,这种题型高考年年考,但失分者依然较多,主要失误在审题不够仔细。审题时应注意如下细节: (1)物质的状态:水在标准状况下时为液态或固态;SO3在标准状况下为固态,常温常压下为液态;在标准状况下,碳原子数大于4而小于16的烃为液态,大于等于16的烃为固态。 (2)某些物质的分子中的原子个数,如惰性气体、臭氧(O3)、白磷(P4)等。 (3)一些物质结构中化学键的数目,如SiO2(Si-O四键)、Si、P4(6个P-P键) 等。 (4)特别物质的摩尔质量,如D2O,T2O,18O2等。 (5)较复杂的氧化还原反应中,求算转移电子数,如Na2O2+H2O、电解Cu(NO3)2溶液等。 (6)在用到气体摩尔体积22.4L/mol时,必须注意所给物质是否为气体,如是气体看是否处于标况。 (7)某些离子或原子团水溶液中能发生水解反应,离子数目要改变。 例2 设阿伏加德罗常数的符号为NA,标准状况下某种O2和N2的混合气体mg含有b个分子,则ng该混合气体在相同状况下所占的体积(L)应是(1998年上海市高考题) A.22.4nb/mNA B.22.4mb/nNA C.22.4nNA/mb D.nbNA/22.4m 思路分析:气体体积等于气体物质的量乘以气体摩尔体积:V=n×Vm,本题只要求出n即可.气体的摩尔质量为mNA/b g.mol-1,n=m/M=n g/[mNA/b g.mol-1]=nb/mNA mol。 答案:A 一题多解:法二:n g该混合气体所含有的分子数为nb/m个,则在标准状况下所占体积为22.4nb/mNA。 法三:m g混合气体的n=b/NA,而对相同的混合气体,其质量之比等于物质的量之比:m/n=[b/NA]/x,x=nb/mNA mol,V= nb/mNA mol×22.4L/mol。 法四:根据选项特点,利用比例求解. mg b ng x x=bn/m,结对照选项b、m、n的组合方式,只有A符合。 例3 根据阿伏加德罗定律判断,下列叙述中正确的是(1998年全国高考题) A.同温同压下两种气体的体积之比等于摩尔质量之比 B.同温同压下两种气体的物质的量之比等于密度之比 C.同温同压下两种气体的摩尔质量之比等于密度之比 D.同温同体积下两种气体的物质的量之比等于压强之比 思路分析:根据阿伏加德罗定律,在同温同压下,相同体积的气体其分子数相等,说明在该条件下两种气体的n与它们的V成正比,而体积与摩尔质量的大小无关,A错;同理,n与密度也不成正比关系,B项错;对C项,故C项对。D项显然对。 答案:C、D 引申发散:这类试题以阿伏加德罗定律为基点,向摩尔质量、密度、气体摩尔体积等常见的物理量外延,运用阿伏加德罗定律进行推论,阿伏加德罗定律推论(可由PV=nRT推出) ①同T P:V1/V2=n1/n2 ②同T V:P1/P2=n1/n2 ③同T :M1/M2=/ ④同T P m:V1/V2=M2/M1 ⑤同T V m:P1/P2=M2/M1 ⑥同T :P1/P2=M2/M1 例4 在一定体积的密闭容器中放入3L气体R和5L气体Q,在一定条件下发生反应: 2R(气)+5Q(气)=4X(气)+nY(气)。反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中n值是(1998年全国高考题) A.2 B.3 C.4 D.5 思路分析: 2R(气)+5Q(气)=4X(气)+nY(气) 起始量 3L 5L 变化量 2L 5L 4L nL 最终量 1L 0L 4L nL 根据阿伏加德罗定律知:同温同体积下,压强与物质的量成正比: 。 一题多解:本题看上去为一化学计算题,实际上根据反应后混合气体的压强是原来的87.5%可知,反应为体积缩小的反应。由于反应物化学计量数之和为2+5=7,故反应后的化学计量数4+n<7,n<3,对照选项只有A符合题意。 答案:A 方法要领:据阿伏加德罗定律的推论,结合题中数据求解。在高考选择的计算题中,一般都有巧解。若用常规解法也能完成,但会浪费很多时间,在平时答卷中应尽量挖掘巧解计算的方法。 例5 为了测定某烷烃样品(丁烷,并含有少量丙烷等气态烃)的平均相对分子质量,设计了下面的实验:(2000年高考试测题) ①取一个配有合适胶塞的洁净、干燥的锥形瓶,准确称量,得到质量m1。 ②往锥形瓶中通入干燥的该烷烃样品,塞好胶塞,准确称量;重复操作,直到前后两种次称量结果基本相同,得到质量m2。 ③往锥形瓶加满水,塞好胶塞,称量得到质量m3。 已知实验时的温度T(K),压强p(kPa),水的密度(g/L),空气的平均相对分子质量29.0,空气的密度(g/L),回答下面问题: (1)本实验的原理是(具体说明) 。 (2)步骤②中为什么要重复操作,直到前后两次称量结果基本相同? (3)具体说明本实验中怎样做到每次测量都是在相同的体积下进行的? (4)本实验中收集气体样品的操作,可选用的方法是 (填图中标号)。 (5)锥形瓶内空气的质量(m空气)是 (列出算式)。 (6)瓶中样品的质量(m样品)是 (列出算式)。 (7)由实验测得该烷烃的平均相对分子质量是 (列出算式)。 思路分析:(1)根据阿伏加德罗定律, 同温同压下,两种体积相同的气体的质量之比等于它们的相对分子质量之比。 (2)要使前后两种次称量结果基本相同,从操作角度看,是要使瓶内充满样品气体,或通入样品气体要有足够长的时间。所以答案是“为了保证瓶内的空气已完全被排出,并充满了样品气”。 (3)抓住题中“一个配有合适胶塞的锥形瓶”可知,要做到每次测量都是在相同体积下进行,关键是要控制每次胶塞插入瓶口的深浅相同。所以答案是“第一次称量前塞紧胶塞后,在瓶口处作一记号,以后每次测量,胶塞塞入瓶口的位置都以此为准”。 (4)要根据定量实验要求来选择气体的收集方法,如果是定性实验显然可以用向下排空气法或排水法两种方法收集,但由于本实验中收集完后,还要连瓶一起称量,且由于瓶内气体的质量的绝对值较小,稍有误差就会对实验结果产生较大的影响,所以不能选排水法,只能选用向下排空气法。答案是D。 (5)~(7):根据物理学中有关浮力的原理,在空气中称量时,称量物体必定要受到空气的浮力,由此可得出(这是各小题中列计算式的关键)①m1=m瓶+m空气,②m2=m瓶+m样品,③m3=m瓶+m水,明确了这几个测定量的物理意义后,就容易获得后几个小题的答案: ③-①得:m3-m1=m水-m空气 因为m水>>m空气,所以m水=m3-m1 V瓶=m水/水=(m3-m1)/水,m空气=空气×V瓶= 空气×(m3-m1)/水 ②-①得:m样品=(m2-m1)+m空气 因为M样品/M空气=m样品/m空气,所以M样品=M空气×m样品/m空气=29×m样品/m空气 答案:(1)(2)(3)见划线;(4)D;(5)(m3-m1)/(-);(6)m2-m1+m空气[或答(m2-m1)+(m3-m1)/(-)];(7) 方法要领 :运用气体摩尔体积知识和实验知识分析。根据阿伏加德罗定律,同温同压下,同体积的各气体都含有相同的分子数。所以同温同压下,两种同体积的不同气体的质量之比等于它们的相对分子质量之比。这样,如果已知其中一种气体的相对分子质量,就可以测定另一种气体的相对分子质量。本实验是在同温同压下,分别测定同体积含杂质的丁烷气体和空气的质量来求得样品的平均相对分子质量。为保证锥形瓶中的空气完全排出,并充满样品气体,本实验中采取了化学分析(如酸碱中和滴定)中常用的测平行数据的方法,即重复操作,直到两次称量结果基本相同为止。在实验中,为了保证每次测量都是在相同体积下进行的,最简单的做法是,在第一次称量前,塞好胶塞后,在瓶口处的胶塞上作一记号,以后每次测量,胶塞塞入瓶口的位置都以此为准。由于短时间要求准确称量锥形瓶中样品的质量,因此样品必须是干燥的,不能选排水法收集。又因样品气体比空气重,所以只能选用向上排气法来收集样品气体,而且必须把导管插入瓶底才能把瓶内的空气赶尽。 例6 将a g含NaOH的样品溶解在b mL0.1mol/L硫酸中,再加入c mL0.1mol/L的氢氧化钡溶液,反应后所得溶液恰好呈中性,样品中NaOH的纯度是(NaOH式量为40)(2001年理科综合题) A.[(b-c)/125a]×100% B.[(b-2c)/125a]×100% C.[(b-c)/250a]×100% D.[(8b-8c)/a]×100% 思路分析:由题意NaOH和Ba(OH)2提供的OH-与H2SO4提供的H+恰好完全反应,则有n(NaOH)+0.001c L×0.1mol/L×2=0.001b L×(0.1mol/L×2),n(NaOH)=2×10-4(b-c) mol,(NaOH)=[2×10-4(b-c)mol×40g/mol]÷ag=(b-c)/125a 答案:A 方法要领:审题中抓住“反应后所得溶液恰好呈中性”,据H+~OH-关系计算。 例7 在某温度时,一定量的元素A的氢化物AH3,在一定体积的密闭容器中可以完全分解成两种气态单质,此时压强增加了75%。则A单质的一个分子中有 个A原子,分解反应的化学方程式是 。(1992年三南高考题) 思路分析:AH3分解成两种气态单质后,在密闭容器内压强增加了75%,是本题给出的唯一的条件。在考虑解题途径时,要想到题目的要求是确定单质A的分子中原子数。微观的粒子与物质的量有联系,而联系物质的量或粒子与压强之间的关系是阿伏加德罗定律。这样,就决定了应用阿伏加德罗定律,结合题目所给出的压强改变,就成为解出此题的基本理论依据。 按照阿伏加德罗定律,在温度、体积都不变的条件下,气态物质的压强与其物质的量成正比。 ?AH3=?A?+?H2 反应生压强增加了75% 1 1+75%=7/4 反应前AH3与反应后两种单质的物质的量 4 7 反应前后原子的种类和个数必相等 4AH3=A4+6H2 答案:4、4AH3=A4+6H2 方法要领:本题通过无机化合价的分解反应,来考查考生确定无机物的能力,比较灵活,有新意。题目中所给出的条件只是反应后压强增大了75%这个唯一的数据,要挖掘出隐藏在这个条件之后的是阿伏加德罗定律,并灵活运用阿伏加德罗定律解决新情境下的问题。 例8 标准状况下,用一定量的水吸收氨气后制得浓度为12.0mol/L、密度为0.915g/cm-3的氨水.试计算1体积水吸收多少体积的氨气可制得上述氨水。(2001年全国高考题) (本题中氨的式量以17.0计,水的密度以1.00 g/cm3计) 思路分析:1.00L该氨水中含氨的质量为 12.0mol×17.0g/mol 其体积在标准状况下为12.0mol×22.4L/mol 1.00L该氨水中含水的质量为1.00L×915g/L-12.0mol×17.0g/mol 其体积为(1.00L×915g/L-12.0mol×17.0g/mol)/1000g/L V(NH3)/V(H2O) =(12.0mol×22.4L/mol)÷[(1.00915g/L×1。00L-12.0mol×17.0g/mol/1000g/L)=378 1体积水吸收378体积NH3气(标准状况) 答案:378L 一题多解:解法二——直接列出总式 1体积水吸收378体积NH3气(标准状况) 解法三: V=378L 方法要领:本题以应用物质的量浓度通算式为基点,考查考生的思维敏捷性、严谨性。解题中一是注意“单位”,防止相差1000倍;二是分清“一体积水”与一体积溶液。 此题提示我们应注重化学基础知识基本计算方法的学习与理解。 例9 在120℃时分别进行如下四个反应:(2001的全国高考题) (A)2H2S+O2=2H2O+2S (B)2H2S+3O2=2H2O+2SO2 (C)C2H4+3O2=2H2O+2CO2 (D)C4H8+6O2=4H2O+4CO2 (1)若反应在容积固定的容器内进行,反应前后气体密度(d)和气体总压强(p)分别符合关系式d前=d后和p前>p后的是 ;符合关系式d前=d后和p前=p后的是 (请填写反应的代号). (2)若反应在压强恒定、容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和V前查看更多