- 2021-04-17 发布 |
- 37.5 KB |
- 13页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习人教版实验室常见气体的制备学案
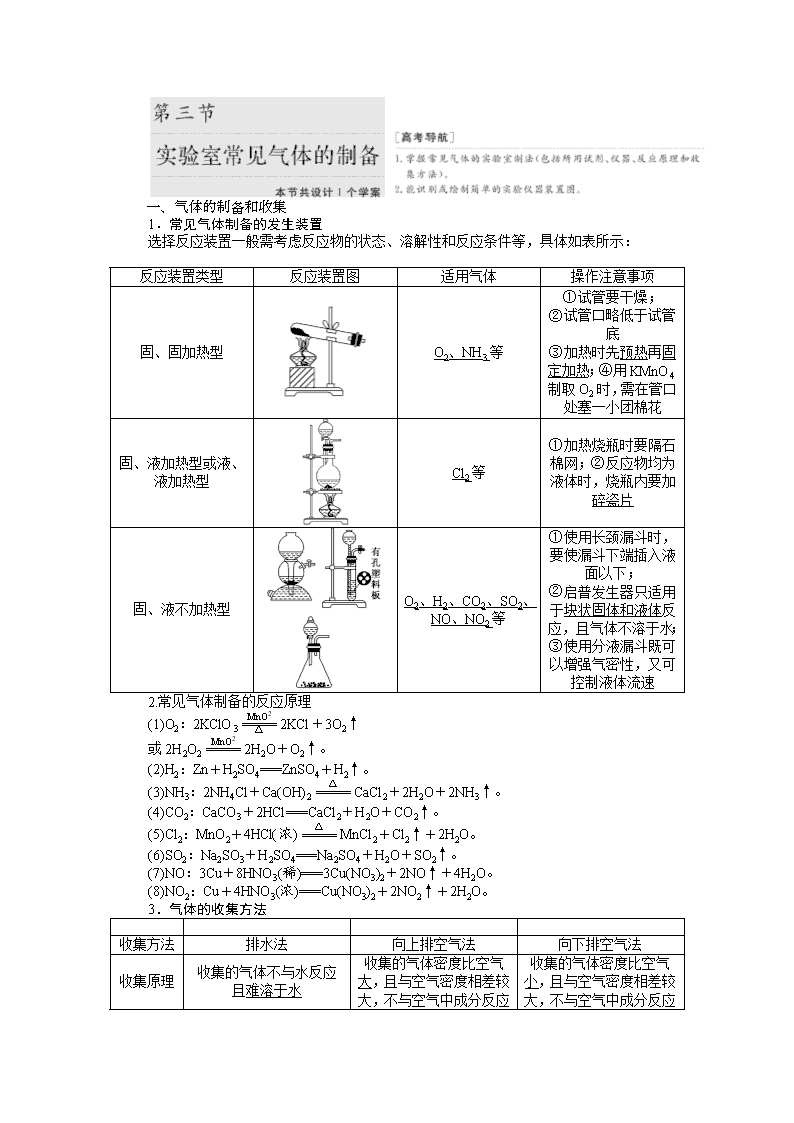
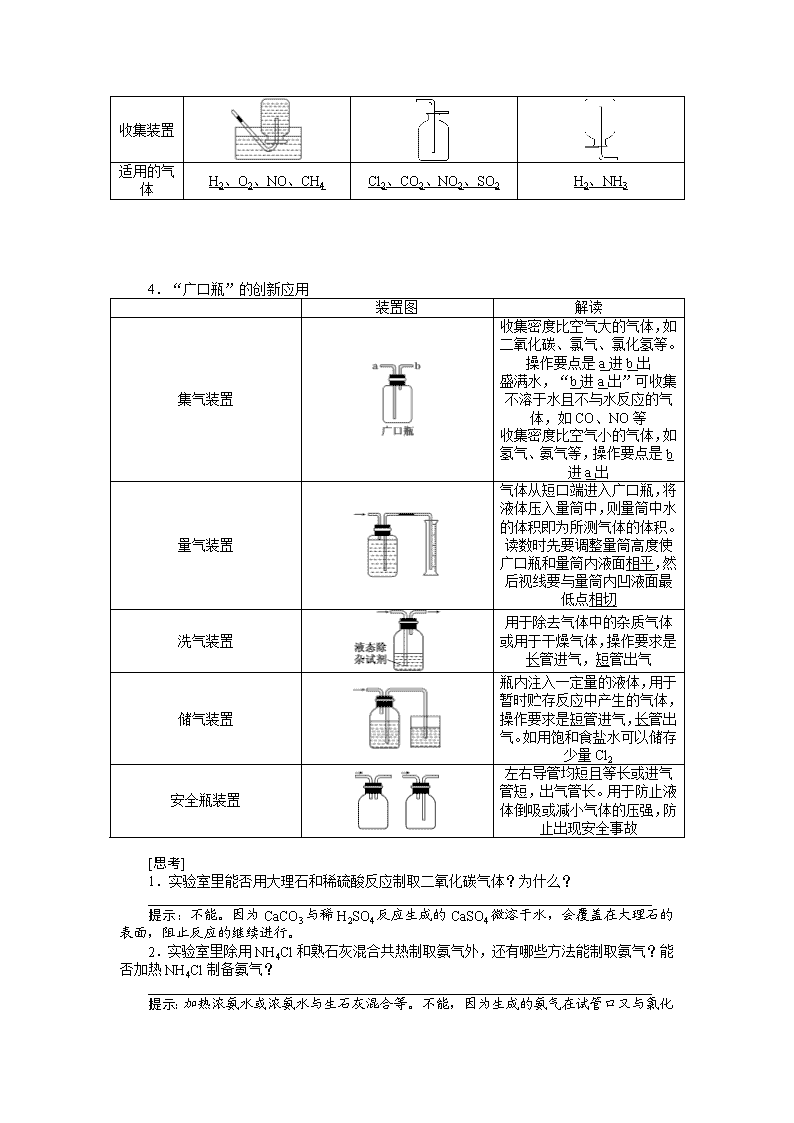
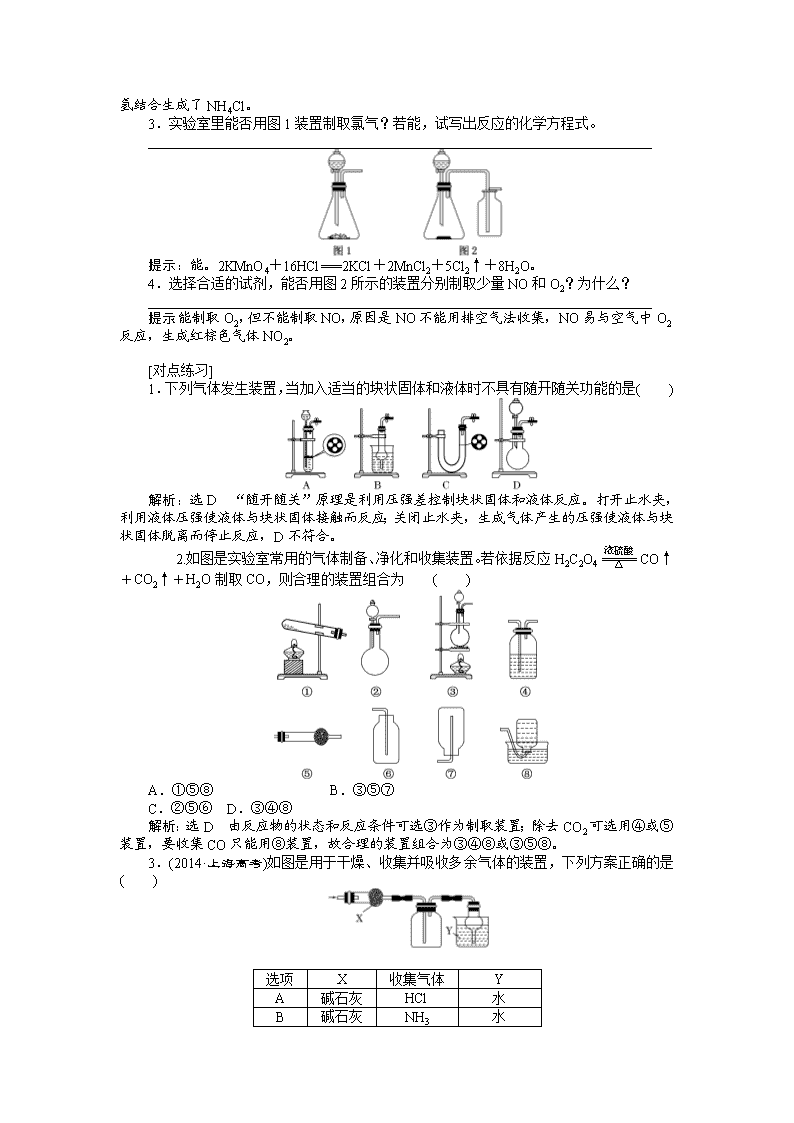
1.常见气体制备的发生装置 选择反应装置一般需考虑反应物的状态、溶解性和反应条件等,具体如表所示: 反应装置类型 反应装置图 适用气体 操作注意事项 固、固加热型 O2、NH3等 ①试管要干燥; ②试管口略低于试管底 ③加热时先预热再固定加热;④用KMnO4制取O2时,需在管口处塞一小团棉花 固、液加热型或液、液加热型 Cl2等 ①加热烧瓶时要隔石棉网;②反应物均为液体时,烧瓶内要加碎瓷片 固、液不加热型 O2、H2、CO2、SO2、NO、NO2等 ①使用长颈漏斗时,要使漏斗下端插入液面以下; ②启普发生器只适用于块状固体和液体反应,且气体不溶于水; ③使用分液漏斗既可以增强气密性,又可控制液体流速 2.常见气体制备的反应原理 (1)O2:2KClO32KCl+3O2↑ 或2H2O22H2O+O2↑。 (2)H2:Zn+H2SO4===ZnSO4+H2↑。 (3)NH3:2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑。 (4)CO2:CaCO3+2HCl===CaCl2+H2O+CO2↑。 (5)Cl2:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O。 (6)SO2:Na2SO3+H2SO4===Na2SO4+H2O+SO2↑。 (7)NO:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O。 (8)NO2:Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O。 3.气体的收集方法 收集方法 排水法 向上排空气法 向下排空气法 收集原理 收集的气体不与水反应且难溶于水 收集的气体密度比空气大,且与空气密度相差较大,不与空气中成分反应 收集的气体密度比空气小,且与空气密度相差较大,不与空气中成分反应 收集装置 适用的气体 H2、O2、NO、CH4 Cl2、CO2、NO2、SO2 H2、NH3 4.“广口瓶”的创新应用 装置图 解读 集气装置 收集密度比空气大的气体,如二氧化碳、氯气、氯化氢等。操作要点是a进b出 盛满水,“b进a出”可收集不溶于水且不与水反应的气体,如CO、NO等 收集密度比空气小的气体,如氢气、氨气等,操作要点是b进a出 量气装置 气体从短口端进入广口瓶,将液体压入量筒中,则量筒中水的体积即为所测气体的体积。读数时先要调整量筒高度使广口瓶和量筒内液面相平,然后视线要与量筒内凹液面最低点相切 洗气装置 用于除去气体中的杂质气体或用于干燥气体,操作要求是长管进气,短管出气 储气装置 瓶内注入一定量的液体,用于暂时贮存反应中产生的气体,操作要求是短管进气,长管出气。如用饱和食盐水可以储存少量Cl2 安全瓶装置 左右导管均短且等长或进气管短,出气管长。用于防止液体倒吸或减小气体的压强,防止出现安全事故 [思考] 1.实验室里能否用大理石和稀硫酸反应制取二氧化碳气体?为什么? ________________________________________________________________________ 提示:不能。因为CaCO3与稀H2SO4反应生成的CaSO4微溶于水,会覆盖在大理石的表面,阻止反应的继续进行。 2.实验室里除用NH4Cl和熟石灰混合共热制取氨气外,还有哪些方法能制取氨气?能否加热NH4Cl制备氨气? ________________________________________________________________________ 提示: 加热浓氨水或浓氨水与生石灰混合等。不能,因为生成的氨气在试管口又与氯化氢结合生成了NH4Cl。 3.实验室里能否用图1装置制取氯气?若能,试写出反应的化学方程式。 ________________________________________________________________________ 提示:能。2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O。 4.选择合适的试剂,能否用图2所示的装置分别制取少量NO和O2?为什么? ________________________________________________________________________ 提示:能制取O2,但不能制取NO,原因是NO不能用排空气法收集,NO易与空气中O2反应,生成红棕色气体NO2。 [对点练习] 1.下列气体发生装置,当加入适当的块状固体和液体时不具有随开随关功能的是( ) 解析:选D “随开随关”原理是利用压强差控制块状固体和液体反应。打开止水夹,利用液体压强使液体与块状固体接触而反应;关闭止水夹,生成气体产生的压强使液体与块状固体脱离而停止反应,D不符合。 2.如图是实验室常用的气体制备、净化和收集装置。若依据反应H2C2O4CO↑+CO2↑+H2O制取CO,则合理的装置组合为 ( ) A.①⑤⑧ B.③⑤⑦ C.②⑤⑥ D.③④⑧ 解析:选D 由反应物的状态和反应条件可选③作为制取装置;除去CO2可选用④或⑤装置,要收集CO只能用⑧装置,故合理的装置组合为③④⑧或③⑤⑧。 3.(2014·上海高考)如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( ) 选项 X 收集气体 Y A 碱石灰 HCl 水 B 碱石灰 NH3 水 C 氯化钙 SO2 氢氧化钠 D 氯化钙 NO 氢氧化钠 解析:选C 该装置中采用向上排空气法收集,说明该气体密度大于空气,且该气体和空气中成分不反应,用固体干燥剂干燥,则该气体和干燥剂不反应。碱石灰呈碱性,能和HCl反应,所以HCl不能用碱石灰干燥,A错误;NH3密度小于空气,应该采用向下排空气法收集,B错误;SO2密度大于空气且常温下和空气中成分不反应,氯化钙和SO2不反应,所以能用氯化钙干燥,C正确; 常温下NO和空气中O2反应生成红棕色气体NO2,D错误。 4.下列制备和收集气体的实验装置合理的是( ) 解析:选D A中加热的大试管管口应略向下倾斜;B中NO很容易被空气中的O2氧化,所以采用B装置得不到NO;C中H2的密度比空气小,所以集气瓶中的进气导管应比出气导管短,C错误。 5.铵明矾[NH4Al(SO4)2·12H2O]是分析化学常用的基准试剂,其制备过程如图所示。下列分析不正确的是( ) 2NH4HCO3+Na2SO4===2NaHCO3↓+(NH4)2SO4 B.检验溶液B中阴离子的试剂仅需BaCl2溶液 C.若省略过程Ⅱ,则铵明矾的产率明显降低 D.向铵明矾溶液中逐滴加入NaOH溶液,先后观察到:刺激性气体逸出→白色沉淀生成→白色沉淀消失 解析:选D NaHCO3的溶解度较小,过程Ⅰ可以产生NaHCO3沉淀,符合离子反应的条件,A项正确;过程Ⅱ调节溶液的pH=2,溶液中不含有CO,故仅需BaCl2溶液即可鉴别SO,B项正确;若省略过程Ⅱ,因CO与Al3+的水解相互促进,导致铵明矾的产率降低,C项正确;向铵明矾溶液中加入NaOH溶液,Al3+结合OH-的能力比NH强,应先产生白色沉淀,后产生有刺激性气味的气体,再加入过量的NaOH溶液,白色沉淀逐渐溶解并消失,D项错误。 二、气体的净化与尾气处理 1.常见气体的净化方法和净化装置 (1)常见气体的净化方法 (2)常见净化装置 a装置为加热固态试剂以除去气体中杂质的装置,为防止固体“流动”,两端用石棉或玻璃棉堵住,但要使气流通畅。b装置一般盛液体试剂,用于洗液。c装置一般盛固体试剂,用于气体除杂和定量计算。 (3)常见干燥剂 液态干燥剂 固态干燥剂 装置 事例 浓硫酸 (酸性、强氧化性) 无水氯化钙 (中性) 碱石灰 (碱性) 不可干燥的气体 H2S、HBr、HI等还原性气体及NH3 NH3 Cl2、H2S、HCl、SO2、CO2等酸性气体 (4)除去下列气体中的杂质,完成表格 序号 原物质 所含杂质 除杂质试剂 主要操作方法 ① N2 O2 灼热的铜网 用固体转化气体 ② CO CO2 NaOH溶液 洗气 ③ CO2 CO 灼热的CuO 用固体转化气体 ④ CO2 HCl 饱和NaHCO3溶液 洗气 ⑤ Cl2 HCl、H2O 饱和食盐水、浓硫酸 洗气 ⑥ CO2 SO2 饱和NaHCO3溶液 洗气 ⑦ CH4 乙烯 溴水 洗气 ⑧ NH3 CO2、H2O 碱石灰 用固体转化气体 2.尾气的处理 (1)转化处理 对有毒、有害的气体必须用适当的方法予以吸收或点燃变为无毒、无害的气体,再排放到空气中。实验室中常见有毒气体的处理方法如表所示: (2)直接排入空气中 主要是针对无毒、无害气体的处理,如N2、O2、CO2等。 (3)尾气处理装置 ①在水中溶解度较小的有毒气体,多数可通入烧杯中的溶液中,用某些试剂吸收除去(如图甲),如Cl2、NO2均可通入NaOH溶液中除去;对于溶解度很大、吸收速率很快的气体,吸收时应防止倒吸(如图乙)。 ②某些可燃性气体可用点燃或转化的方法(如图丙)。如CO、H2可点燃或通过灼热的CuO除去。 ③收集法(如图丁)。尾气也可以采用收集的方法,如CH4、C2H4、H2、CO等。 [对点练习] 1.如图是常见的气体制取、干燥和收集装置。若用H2O2和催化剂MnO2制取干燥的O2,合理的装置组合为( ) A.①⑤⑧ B.③④⑦ C.②⑤⑥ D.②④⑧ 解析:选C 用H2O2制O2的反应原理为2H2O22H2O+O2↑,由反应物的状态和反应条件可选②作为制取装置。干燥O2可选用④或⑤装置,要收集干燥的O2只能用⑥装置,故合理的装置组合为②⑤⑥或②④⑥。 2.下列有关各实验的叙述中正确的是( ) A.①利用氯仿(CHCl3)密度大于乙醇,进行氯仿与乙醇混合物的分离 B.②进行H2、NH3、CO2、Cl2、HCl、NO2等气体收集,但不能用于NO气体收集 C.③当X选用苯时可进行NH3和HCl的吸收,并防止倒吸 D.④可用于SO2气体的干燥,收集并吸收多余SO2气体,防止SO2逸出污染空气并防止倒吸 解析:选B 氯仿和乙醇互溶,不能用分液漏斗分离,A项错误;密度大于空气的气体(如CO2、Cl2、HCl、NO2),可长进短出来收集气体,密度小于空气的气体(如H2、NH3),可短进长出来收集气体,NO能与空气中的O2反应,不能用排空气法收集,B项正确;苯的密度小于水的密度,应在上层,不能防止倒吸,C项错误;SO2气体不能用碱石灰干燥,D项错误。 3.可用如图所示装置干燥、收集及尾气处理的气体是( ) ①H2S ②HCl ③NH3 ④Cl2 ⑤SO2 ⑥NO A.①和② B.②和⑤ C.③和④ D.⑤和⑥ 解析:选B H2S和NH3不能用浓H2SO4干燥,NO不能用排空气法收集,Cl2不能用水吸收。 4.(2017·山西五校联考)某学习小组拟利用如图装置制备氮化钙(化学式为Ca3N2,极易与H2O反应)。下列说法正确的是( ) A.打开活塞K通入N2,试管A内有气泡产生,说明装置气密性良好 B.U形管中盛放的干燥剂既可以是碱石灰,也可以是浓硫酸 C.将产物Ca3N2放入盐酸中,只能得到一种盐 D.反应结束后,先熄灭酒精灯,待反应管冷却至室温后再关闭活塞K 解析:选D 若通入N2的气流较大,即使装置气密性不好,也能在试管A内产生气泡,A项错误;U形管中不能盛放液体干燥剂,B项错误;将Ca3N2放入盐酸中可得到两种盐:CaCl2和NH4Cl,C项错误;如果先关闭活塞K,再熄灭酒精灯,有可能引起倒吸,D项正确。 5.为了净化和收集由盐酸和大理石制得的CO2气体,从图中选择合适的装置并连接。 其中连接顺序合理的是 ( ) A.a—a′→d′—d→e B.c—c′→d—d′→g C.b—b′→d—d′→g D.d—d′→c—c′→f 解析:选B 盐酸和大理石制得的CO2气体含有氯化氢和水蒸气,除氯化氢用饱和NaHCO3溶液,除水蒸气用浓硫酸,CO2比空气密度大,所以用向上排空气法收集CO2气体。 [特别提醒] 气体除杂的原则和注意事项 1.气体除杂的原则 (1)不引入新的杂质。如除去甲烷中的乙烯不能用酸性高锰酸钾溶液,因为酸性高锰酸钾溶液氧化乙烯会生成二氧化碳,从而甲烷中又引入了新的杂质。 (2)不减少被净化气体的量,尽可能增加被净化气体的量。如除去二氧化碳中的二氧化硫气体,如果使用氢氧化钠溶液,二氧化碳也会与氢氧化钠反应,因此选用饱和碳酸氢钠溶液,既能除去二氧化硫,同时又能增加二氧化碳的量。 2.气体除杂注意的问题 (1)需净化的气体中含有多种杂质时,除杂顺序:一般先除去酸性气体,如HCl、CO2、SO2等,水蒸气要在最后除去。 (2)选用除杂方法时要保证杂质完全除掉,如除CO2最好用NaOH不用Ca(OH)2溶液,因为Ca(OH)2是微溶物,石灰水中Ca(OH)2浓度小,不易完全吸收CO2。有时候为了保证气体除尽,还要验证一步,如验证混合气体中既有CO2,又有SO2,通常用品红溶液检验SO2,然后用溴水或酸性KMnO4溶液除去SO2,再用品红溶液检验是否除尽,最后用澄清石灰水检验CO2。 [课时小测试] 1.下列实验方案不能达到实验目的的是( ) A.图甲装置用Cu和浓硝酸可制取NO B.图乙装置可用于实验室制备Cl2 C.图丙装置可用于实验室制取乙酸乙酯 D.图丁装置可用于实验室分离CO和CO2 解析:选C Cu和浓硝酸反应生成NO2,NO2可以与水反应生成NO,故可以用甲装置制取NO,A正确;KMnO4具有强氧化性,在常温下就可以把浓盐酸氧化为Cl2,故乙装置可用于实验室制备Cl2,B正确;乙酸乙酯在强碱性溶液中可以完全水解,故不能用烧碱溶液吸收,C错误;CO2 可以先被碱液吸收,在球胆中收集CO气体,再通过分液漏斗向试剂瓶中加入酸液,CO2即可放出,故丁装置可用于实验室分离CO和CO2,D正确。 2.(2017·湖北四地七市联考)下列有关实验装置的说法,正确的是( ) A.用图甲装置制取干燥纯净的NH3 B.用图乙装置制备Fe(OH)2并能较长时间观察其颜色 C.用图丙装置可以完成“喷泉”实验 D.用图丁装置测量Cu与浓硝酸反应产生气体的体积 解析:选C 收集NH3应用向下排空气法,A错误;接电源负极的金属作阴极,被保护,用图乙装置不可能制备Fe(OH)2,B错误;Cl2能被NaOH溶液完全吸收,C正确;Cu与浓硝酸反应产生的气体为NO2,NO2能与水发生反应:3NO2+H2O===2HNO3+NO,D错误。 3. 用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( ) A.若A为浓盐酸,B为MnO2,C中盛石蕊试液,则C中溶液先变红后褪色 B.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 C.若A为浓硫酸,B为炭,C中盛有苯酚钠溶液,则C中出现白色浑浊 D.若A为浓硝酸,B为金属铜,C中盛有淀粉KI溶液,则C中溶液变蓝 解析:选D 浓盐酸和MnO2、浓硫酸和炭反应都需要加热,选项A、C错误;选项B中白色沉淀不溶解,错误。 4.图中装置可以用来制备、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于( ) A.锌和盐酸生成氢气 B.亚硫酸钠和浓硫酸生成二氧化硫 C.碳酸钙和盐酸生成二氧化碳 D.浓氨水和烧碱制取氨气 解析: 选A A项,此装置可用于锌和盐酸生成氢气,正确;B项,二氧化硫能溶于水,且密度比空气大,错误;C项,二氧化碳能溶于水且密度比空气大,错误;D项,氨气极易溶于水,错误。 5.下列实验装置图正确的是( ) 解析:选C A项中应用酒精灯加热,集气装置中导气管长度应左长右短;B项中Na2O2为粉末状,且溶于水,该装置无法随开随用,随关随停;D项中导气管末端靠近液面但不能伸入液面以下,否则会倒吸。 6.草酸晶体(H2C2O4·2H2O)100 ℃开始失水,101.5 ℃熔化,150 ℃左右分解产生H2O、CO和CO2。用加热草酸晶体的方法获取某些气体,应该选择的气体发生装置是(图中加热装置已略去)( ) 解析:选D 草酸晶体加热过程中有水生成,不能采用装置A、B,否则生成的水冷凝后会使仪器炸裂;因草酸晶体在 101.5 ℃熔化,而150 ℃才分解,使用装置C会使液态草酸流出,不合适,装置D符合题意。 7.(2017·河南中原名校联考)用如图所示装置制取表格中的四种干燥、纯净的气体(必要时可以加热:a、b、c、d表示相应仪器中加入的试剂)。其中正确的是( ) 选项 气体 a b c d A SO2 浓硫酸 Cu H2O 浓硫酸 B Cl2 浓盐酸 MnO2 NaOH溶液 浓硫酸 C NH3 饱和NH4Cl溶液 消石灰 空集气瓶 固体NaOH D NO 稀硝酸 铜屑 H2O 浓硫酸 解析:选D A项,浓硫酸与Cu在加热时能发生反应产生SO2,SO2能溶于水,所以不能使用水来作为除杂试剂,错误;B项,浓盐酸与MnO2在加热时能发生反应产生Cl2,由于Cl2与HCl都能与NaOH发生反应,所以不能用NaOH溶液除去杂质,错误;C项,应该使用固体NH4Cl和消石灰混合加热来制取氨气,而且氨气的密度比空气小,要用向下排空气法收集,错误;D项,稀硝酸与Cu反应产生NO,NO不溶于水,可以用水来除去杂质,而且浓硫酸与NO不反应,所以可以用于干燥该气体,正确。 8.下列装置及实验设计中合理的是 ( ) A.① B.②③ C.①②③ D.②③④ 解析:选B ①忽略CO2与炭粉的反应是气体体积增大的反应,该实验设计不能实施;②、③可以达到实验目的;④中气体应从左边通入。 9.化学课外活动小组设计如图所示的一套气体发生、收集和尾气吸收装置(从左到右依次连接),以探究该装置的多功能性。 (1)甲同学认为利用装置Ⅱ可直接收集NH3、H2,但不能收集O2,其理由是________________________________________________________________________。 (2)乙同学认为装置Ⅰ可作为实验室制氧气的快速发生器,对装置Ⅱ稍作改进后即可作为O2的收集装置,乙同学对装置Ⅱ的改进方法是______________________________________;制O2时在装置Ⅰ中的a中加入________,b仪器中加入________。 (3)丁同学认为利用装置Ⅰ和装置Ⅲ可进行验证Cl2的氧化性比Br2强的实验,进行此项实验时在装置Ⅰ中的a仪器中加入________,b仪器中加入__________,装置Ⅲ中应加入________,根据装置Ⅲ中观察到的____________实验现象即可得出Cl2的氧化性比Br2强的结论。 解析:解答本题可以从如下三个方面展开思路:①由装置Ⅰ可知该气体发生装置为液固或液液反应装置,利用本装置可制备CO2、H2、O2(由H2O2和MnO2为原料)、SO2、H2S、NO等。②装置Ⅱ为气体收集装置,若该装置导气管“短进长出”可收集H2、NH3、CH4等比空气密度小的气体;若将导气管改为“长进短出”则可收集比空气密度大的气体如O2、SO2、Cl2等。③装置Ⅲ可作尾气吸收装置。解题时抓住上述三点,再紧扣“探究该装置的多功能性”进行思考则全题可解。 答案:(1)因为H2、NH3比空气密度小,而O2比空气密度大 (2)把装置Ⅱ中的进气导管改为长导管插至试管底部,出气导管管口应与胶塞相平 H2O2溶液 少量MnO2粉末 (3)浓盐酸 KMnO4 NaBr溶液 溶液由无色变橙色 10.某学生利用以下装置探究Cl2与NH3之间的反应。其中A、F分别为NH3和Cl2的发生装置,C为纯净干燥的Cl2与NH3反应的装置。 请回答下列问题: (1)装置A中的烧瓶内固体不可以选用______(填字母)。 A.生石灰 B.碱石灰 C.五氧化二磷 D.烧碱 (2)装置B的作用是_________________;装置E的作用是 ________________________________________________________________________。 (3)通入装置C的两根导管左边较长、右边较短,目的是 ________________________________________________________________________。 (4)装置F中发生反应的化学方程式是__________________________________。 (5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:______________________________________________。 (6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?______________________________________________________________________。 解析:(1)装置A制取NH3,可用浓氨水与碱石灰(或烧碱或生石灰等),但不能用P2O5,因其与水反应后生成磷酸,能与NH3反应。(2)装置B中盛放的碱石灰,用来干燥NH3;装置E中盛放的饱和食盐水,用来除去Cl2中混有的HCl气体。(3)由于NH3的密度小,Cl2的密度大,密度小的NH3从长管进入向上扩散,密度大的Cl2从短管进入向下扩散,这样能较快地混合均匀。(6)黄绿色的气体是Cl2,依据Cl2的性质,可用烧碱溶液吸收。 答案:(1)C (2)干燥NH3 除去Cl2中的HCl气体 (3)使密度较大的Cl2和密度较小的NH3能较快地混合均匀 (4)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O (5)3Cl2+8NH3===N2+6NH4Cl (6)在G处连接导管,直接把尾气通入盛有烧碱溶液的烧杯中 11.N2在诸多领域用途广泛。某化学兴趣小组为探究在实验室制备较为纯净N2的方法,进行了认真的准备。请你参与交流与讨论。 [查阅资料]N2的制法有下列三种方案: 方案1:加热NaNO2和NH4Cl的浓溶液制得N2。 方案2:加热条件下,以NH3还原CuO可制得N2,同时获得活性铜粉。 方案3:将空气缓缓通过灼热的铜粉获得较纯的N2。 [实验准备]以实验室常见仪器(药品)等设计的部分装置如图所示(有的夹持和加热仪器未画出)。 [分析交流] (1)若以方案1制得N2,应选择的发生装置是_____________________________________ (填字母)。 (2)若按方案2制得干燥、纯净的N2,且需要的NH3以生石灰和浓氨水作原料制取,整套制气装置按气流从左到右的连接顺序是________(填字母)。获得N2的反应原理是______________________________________________________________(写化学方程式)。 (3)若以排水法收集N2,其中会混入水蒸气。但也不宜用排空气法,其原因是______________________________________________________________________________。 你提出的收集方法是____________________________________________________。 (4)上述三个方案中,制得的N2纯度最差的是____________________________________。 在N2纯度要求不甚严格的情况下,有人建议将方案2和方案3结合使用,你认为其优点是________________________________________________________________________。 解析:(1)选择发生装置具备的特点与反应物的状态以及反应条件有关,方案1为加热两种液态物质,符合此条件的只有装置A。(2)方案2为固体和气体的反应,反应器应选择B,但要求通入的NH3干燥且纯净,利用浓氨水和生石灰反应制取NH3为固液不加热的装置,选择E,但同时有水蒸气生成,因此利用碱石灰来干燥,反应完毕后产生的水蒸气与没有参与反应的NH3与N2一同导出,利用浓硫酸既可以除去水,又可以除去NH3。(3)排气法收集气体主要是利用气体密度的差别,而N2与空气的密度相近。因此可以直接利用已排空内部空气的装置来收集N2。(4)方案3利用了除去空气中的O2即得N2的原理,空气中除了O2和N2外还有CO2和稀有气体,因此纯度最差。 答案:(1)A (2)E→D→B→C 2NH3+3CuO3Cu+N2+3H2O (3)N2的相对分子质量为28,与空气的平均相对分子质量相近(用气体密度大小比较回答问题也可) 用气囊收集(其他答案合理也可) (4)方案3 CuO和Cu可循环利用,节省药品查看更多