- 2021-04-17 发布 |
- 37.5 KB |
- 2页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考复习专题讲练 技巧型化学计算专题复习
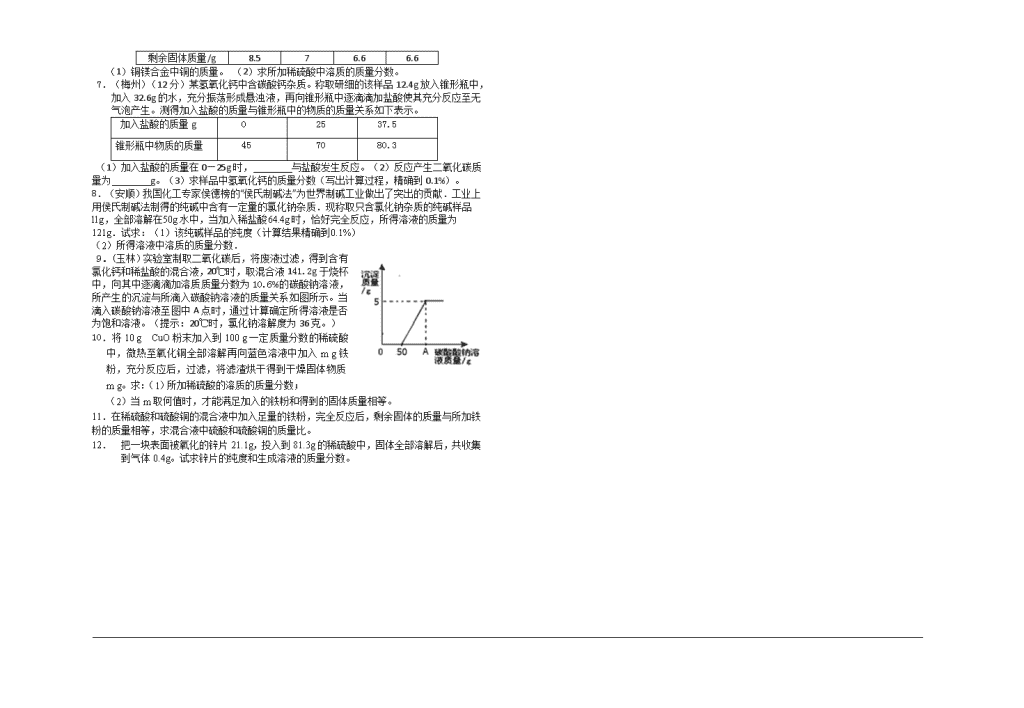
第18讲 技巧型化学计算专题复习 一、学习目标与方法指导 中考化学计算部分主要以结合方程式的质量计算为主,增大难度的方式大致有三种,与溶液结合,综合溶质的质量分数的计算;与实验结合,成为实验方案中解决定量问题的关键环节;与实际问题相结合,计算结果是解决实际问题的依据。总结近些年来中考化学计算题目,至少在五个方面发生了变化: 背景 从简单的实验操作转变为工业生产环境保护等实际应用问题 涉及反应 不限于所学重要反应,给出反应信息 变化过程 从固液混合产生气体或沉淀变为多种形式,比如溶液吸收气体,析出晶体等 反应结果 从单一溶质的溶液变为混合溶液,固体混合物等 解题模式 从根据化学方程式计算质量整体法分析质量变化转变为用未知数表示质量,结合反应结果列方程 我们对化学计算题进行了收集整理,希望这些题目能够帮助同学们解决中考化学计算 1、化学计算的常用方法 (1)守恒法:包括原子个数守恒、得失电子守恒、电荷守恒法、质量守恒法等。 (2)极值法:从问题的极端去思考、去推理、判断,使问题得到解决。 (3)讨论法:当题中含有不确定的因素时,对每一种可能情况进行的讨论。 (4)十字交叉法:已知混合中某一量的平均值,求混合物中两物质的质量比。 (5)差量法:运用前后量的差,根据方程式中的计量数的关系直接求解。 2、化学计算的常用技巧 (1)定量问题定性化;(2)近似估算;(3)运用整体思维,化繁为简;(4)利用图象解题等等。例1(根据镁元素质量守恒).由Mg(OH)2和MgO组成的混合物,测得其中含镁元素的质量分数为48%。取该混合物10g,将其投入110g的稀硫酸中恰好完全反应,所得溶液中溶质的质量分数为( ) A、12% B、24% C、20% D、30% 例2(平均值法).锌、铁、镁三种金属中的两种混合物13g,与足量的盐酸反应产生的氢气在标准状况下为1g,则混合物中一定含有的金属是( )。(A)锌(B)铁(C)镁(D)无法推断 例3.将5克含碳元素的质量分数为36%的CO和CO2混合气体通过足量灼热的氧化铜,再将产生的气体全部被石灰水吸收,则最多能生成多少碳酸钙沉淀?(元素质量守恒法) 例4.将一定质量的Cu和C的混合物置于空气中充分灼烧,冷却后衡量其固体质量未发生改变,求原混合物中铜的质量分数。(差量法) 例5.某FeSO4、Fe2(SO4)3的混合物中已知S%=23%,则Fe%= 。(转换法) 例6把22.4g铁片投入到500gCuSO4溶液中,充分反应后取出铁片,洗涤、干燥后称其质量为22.8g,计算 (1)析出多少克铜? (2)反应后溶液的质量分数多大? 例题7:现有FeCl2和FeCl3样品各一份,已经测定它们中所含氯元素的质量相同,则FeCl2和FeCl3样品的质量比为多少?所含铁元素的质量比是多少? 例题8 现有13.5g氯化铜样品,当它与足量的硝酸银充分反应后,得到AgCl 29g,则此样品中可能混有的物质是( ) A、BaCl2 B、KCl C、ZnCl2 D、CaCl2 例题9、利用95%的浓H2SO4和5%的稀硫酸制30%的H2SO42019g,需这两种酸各多少克?(十字交叉法) 二、实践运用与中考链接 1. (重庆)日常使用的金属材料,大多数属于合金。黄铜是以锌作主要添加元素的铜合金。(1)赤铜(Cu2O)是我国古代制取黄铜的一种原料。Cu2O中铜元素与氧元素的质量比是 .(2)弹壳的黄铜只含有锌和铜。将22 g弹壳放在盛有100 g稀硫酸的烧杯中(硫酸足量),当弹壳不再溶解后,烧杯中混合物的质量是121. 8 g。计算: ①产生氢气的质量。 ②弹壳中铜的质量。 ③反应后所得溶液中ZnSO4的质量分数(计算结果保留一位小数)。 2.(内江)利用沉淀法可测定某粗盐样品的纯度(假定粗盐中的杂质全部是MgCl2)。每次取1000g样品配制成溶液,向其中加入10%的氢氧化钠溶液,测得生成沉淀的质量与所加氢氧化钠溶液的质量关系如下表所示: 测定次数 第一次 第二次 第三次 第四次 样品质量(g) 1000 1000 1000 1000 氢氧化钠溶液质量(g) 320 640 820 900 沉淀质量(g) 23.2 46.4 58 58 ⑴求粗盐的纯度(写出解题过程)。 ⑵当样品与所加氢氧化钠溶液恰好完全反应时溶液中氯化钠的质量为 。 (3)求最终所得溶液的溶质质量分数。 3.(达州)请根据下图所示的实验过程和提供的数据计算 (1)生成氢气 g;(2)合金中铜的质量分数是 ; (3)所用稀硫酸的溶质质量分数是多少?(写出计算过程,计算结果保留到0.1%) 4(泰安)兴趣小组的同学为测定某一铁铜合金中含铁的质量分数,将6g该合金粉末样品,加入溶质质量分数为10%的硫酸铜溶液160g中,二者恰好完全反应。同时为了充分利用资源,还对反应后的物质进行回收处理。请结合下列图示计算: (1)该合金样品中含铁的质量分数;(计算结果精确至0.1%)(2)所的固体铜的质量a为多少g?(3)向不饱和滤液中加入多少g水,能得到5%的硫酸亚铁溶液,用于花卉的营养液。((2)(3)中计算结果精确至0.1g) 5.(娄底)硅钢是变压器、充电器中的核心材料,其主要成份是Fe和Si。某学生用硅钢样品做了如下实验:取4.2g硅钢样品,将60g稀硫酸分6次加入样品中(其中稀硫酸与硅及其它杂质不反应),充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下: 稀硫酸的用量 剩余固体的质量 第一次加入10g mg 第二次加入10g 2.8g 第三次加入10g 2.1g 第四次加入10g 1.4g 第五次加入10g 0.7g 第六次加入10g 0.7g (1)从以上数据可知,稀硫酸加入第 次充分反应后,铁恰好完全反应。 (2)表格中m= 。 (3)计算所用稀硫酸中溶质的质量分数。 6(咸宁)铜镁合金常用作飞机天线等导电材料。欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜镁合金10g放入烧杯,将200g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下。请计算:com 次 数 1 2 3 4 加入稀硫酸质量/g 50 50 50 50 剩余固体质量/g 8.5 7 6.6 6.6 (1)铜镁合金中铜的质量。 (2)求所加稀硫酸中溶质的质量分数。 7.(梅州)(12分) 某氢氧化钙中含碳酸钙杂质。称取研细的该样品12.4g放入锥形瓶中,加入32.6g的水,充分振荡形成悬浊液,再向锥形瓶中逐滴滴加盐酸使其充分反应至无气泡产生。测得加入盐酸的质量与锥形瓶中的物质的质量关系如下表示。 加入盐酸的质量g 0 25 37.5 锥形瓶中物质的质量 45 70 80.3 (1)加入盐酸的质量在0—25g时, 与盐酸发生反应。(2)反应产生二氧化碳质量为 g。(3)求样品中氢氧化钙的质量分数(写出计算过程,精确到0.1%)。 8.(安顺)我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献.工业上用侯氏制碱法制得的纯碱中含有一定量的氯化钠杂质.现称取只含氯化钠杂质的纯碱样品l1g,全部溶解在50g水中,当加入稀盐酸64.4g时,恰好完全反应,所得溶液的质量为121g.试求:(1)该纯碱样品的纯度(计算结果精确到0.1%) (2)所得溶液中溶质的质量分数. 9.(玉林)实验室制取二氧化碳后,将废液过滤,得到含有氯化钙和稀盐酸的混合液,20℃时,取混合液141.2g于烧杯中,向其中逐滴滴加溶质质量分数为10.6%的碳酸钠溶液,所产生的沉淀与所滴入碳酸钠溶液的质量关系如图所示。当滴入碳酸钠溶液至图中A点时,通过计算确定所得溶液是否为饱和溶液。(提示:20℃时,氯化钠溶解度为36克。) 10.将10 g CuO粉末加入到100 g一定质量分数的稀硫酸中,微热至氧化铜全部溶解再向蓝色溶液中加入m g铁粉,充分反应后,过滤,将滤渣烘干得到干燥固体物质m g。求:(1)所加稀硫酸的溶质的质量分数; (2)当m取何值时,才能满足加入的铁粉和得到的固体质量相等。 11.在稀硫酸和硫酸铜的混合液中加入足量的铁粉,完全反应后,剩余固体的质量与所加铁粉的质量相等,求混合液中硫酸和硫酸铜的质量比。 12. 把一块表面被氧化的锌片21.1g,投入到81.3g的稀硫酸中,固体全部溶解后,共收集到气体0.4g。试求锌片的纯度和生成溶液的质量分数。查看更多