- 2021-04-16 发布 |
- 37.5 KB |
- 14页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考理综专项训练化学大题一
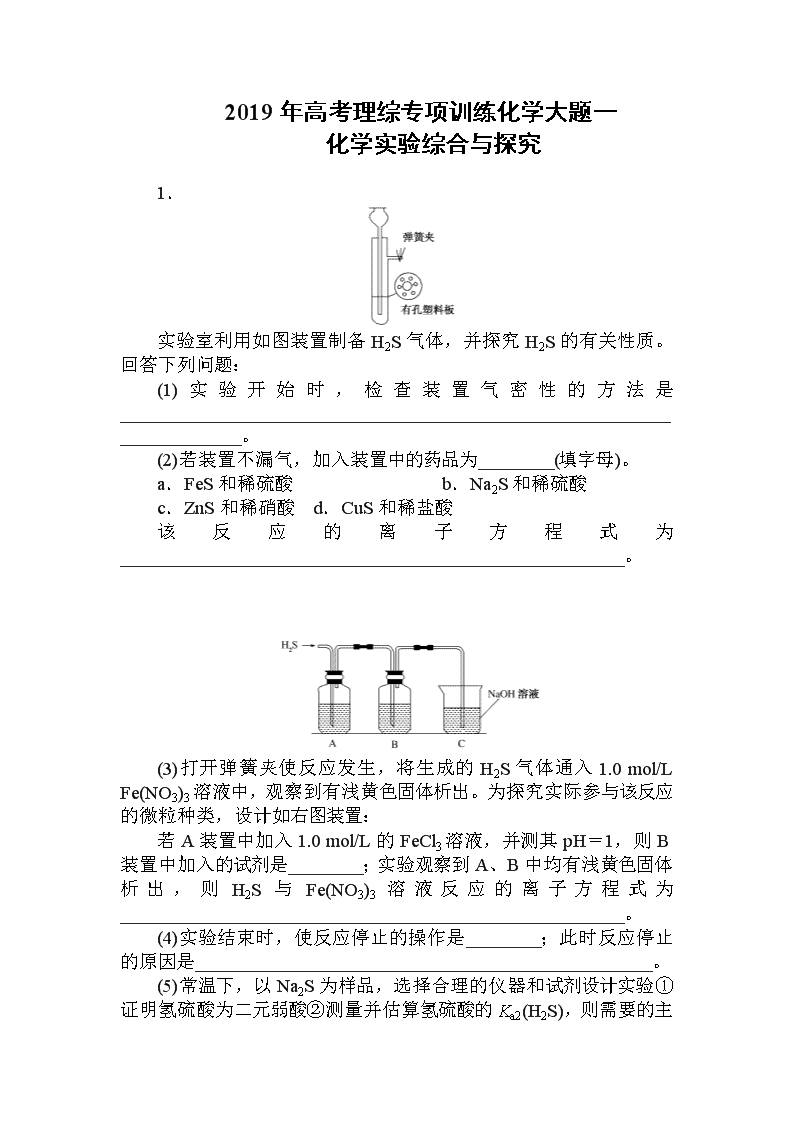
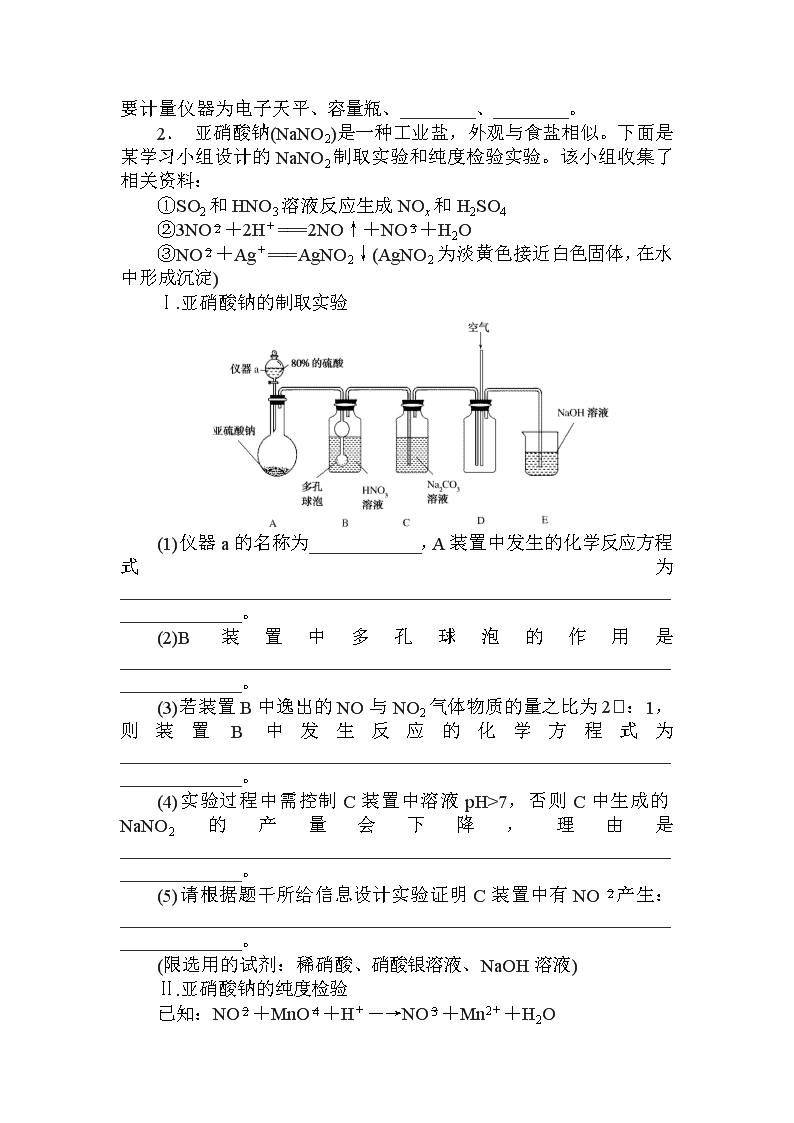
2019年高考理综专项训练化学大题一 化学实验综合与探究 1. 实验室利用如图装置制备H2S气体,并探究H2S的有关性质。回答下列问题: (1)实验开始时,检查装置气密性的方法是________________________________________________________________________。 (2)若装置不漏气,加入装置中的药品为________(填字母)。 a.FeS和稀硫酸 b.Na2S和稀硫酸 c.ZnS和稀硝酸 d.CuS和稀盐酸 该反应的离子方程式为______________________________________________________。 (3)打开弹簧夹使反应发生,将生成的H2S气体通入1.0 mol/L Fe(NO3)3溶液中,观察到有浅黄色固体析出。为探究实际参与该反应的微粒种类,设计如右图装置: 若A装置中加入1.0 mol/L的FeCl3溶液,并测其pH=1,则B装置中加入的试剂是________;实验观察到A、B中均有浅黄色固体析出,则H2S与Fe(NO3)3溶液反应的离子方程式为______________________________________________________。 (4)实验结束时,使反应停止的操作是________;此时反应停止的原因是_________________________________________________。 (5)常温下,以Na2S为样品,选择合理的仪器和试剂设计实验①证明氢硫酸为二元弱酸②测量并估算氢硫酸的Ka2(H2 S),则需要的主要计量仪器为电子天平、容量瓶、________、________。 2. 亚硝酸钠(NaNO2)是一种工业盐,外观与食盐相似。下面是某学习小组设计的NaNO2制取实验和纯度检验实验。该小组收集了相关资料: ①SO2和HNO3溶液反应生成NOx和H2SO4 ②3NO+2H+===2NO↑+NO+H2O ③NO+Ag+===AgNO2↓(AgNO2为淡黄色接近白色固体,在水中形成沉淀) Ⅰ.亚硝酸钠的制取实验 (1)仪器a的名称为____________,A装置中发生的化学反应方程式为________________________________________________________________________。 (2)B装置中多孔球泡的作用是________________________________________________________________________。 (3)若装置B中逸出的NO与NO2气体物质的量之比为2:1,则装置B中发生反应的化学方程式为________________________________________________________________________。 (4)实验过程中需控制C装置中溶液pH>7,否则C中生成的NaNO2的产量会下降,理由是________________________________________________________________________。 (5)请根据题干所给信息设计实验证明C装置中有NO产生:________________________________________________________________________。 (限选用的试剂:稀硝酸、硝酸银溶液、NaOH溶液) Ⅱ.亚硝酸钠的纯度检验 已知:NO+MnO+H+―→NO+Mn2++H2O (6)反应结束后C中溶液通过结晶获得NaNO2粗产品m g,溶解后稀释至250 mL,分别取25.00 mL用c mol/L的酸性KMnO4溶液平行滴定三次,平均每次消耗酸性KMnO4溶液的体积为V mL。则粗产品中NaNO2的质量分数为________(用含c、V、m的式子表示)。 3.[2018·南昌市高三第二次模拟]某实验小组模拟受热时H2与Ca3N2反应制取CaH2。回答下列问题。 已知:Ca3N2、CaH2都可以与水反应。 (1)启普发生器中发生的化学反应方程式是____________________。利用该装置制取气体的优点是____________________。 (2)实验中,先通入氢气,然后________,再加热。 (3)装置连接顺序为a、________、h(某些装置可以重复使用)。其中干燥管的作用是干燥氢气、________________________________________________________________________。 (4)H2与Ca3N2制取CaH2随着温度不同,生成的气体也不同。若取集气瓶中的水溶液,滴加酚酞显红色,则制取CaH2的反应方程式为______________________。 (5)反应后,设计实验证明试管中的固体有CaH2:__________________。 4.[2018·天津市第一中学月考]煤气中主要的含硫杂质有H2S以及COS(羰基硫),煤气燃烧后含硫杂质会转化成SO2从而引起大气污染,因此煤气中H2S的脱出程度已成为煤气洁净度的一个重要指标。请回答下列问题: (1)脱除煤气中COS的方法有Br2的KOH溶液氧化法、H2还原法、水解法等。 ①COS的分子结构与CO2相似,COS的结构式为________________________________________________________________________。 ②Br2的KOH溶液将COS氧化为硫酸盐的离子方程式为________________________________________________________________________。 ③已知:H2、COS、H2S、CO燃烧热依次为-285 kJ/mol、-299 kJ/mol、-586 kJ/mol、-283 kJ/mol:H2还原COS发生的反应为H2 (g)+COS(g)===H2S(g)+CO(g),该反应的ΔH=________ kJ/mol。恒温恒容条件下,密闭容器中将气体按n(H2):n(COS)=2:1混合发生上述反应,下列事实能说明反应达到平衡状态的是________(填字母)。 a.混合气体的平均相对分子质量不再改变 b.n(H2)与n(COS)的比值不变 c.CO的体积分数不变 d.形成2 mol H—S键的同时形成1 mol H—H键 ④用活性α-Al2O3催化COS水解反应为COS(g)+H2O(g)CO2(g)+H2S(g) ΔH<0,相同流量且在催化剂表面停留相同时间时,不同温度下H2S的产率(未达到平衡)如图所示; 由图可知,催化剂活性最大时对应的温度约为________,H2S的产率在后期下降的原因是__________________。 (2)煤气燃烧后含硫杂质转化成的SO2,可以被氨水吸收。已知25 ℃时,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。将SO2通入氨水中,当溶液呈中性时溶液中的=________。此时溶液中各离子浓度大小顺序为:__________________。 5.[2018·武汉市模拟]硼酸三甲酯用作柠檬类水果的熏蒸剂。实验室合成硼酸三甲酯的原理及装置如下: 硼酸三甲酯 甲醇 溶解性 与乙醚、甲醇混溶,能水解 与水混溶 沸点/℃ 68 64 硼酸三甲酯与甲醇混合物的共沸点为54℃ Na2B4O7·10H2O+2H2SO4+16CH3OH2NaHSO4+4[(CH3O)3B+CH3OH]+17H2O 实验步骤如下: ①在圆底烧瓶中加入44.8 g甲醇和19.1 g Na2B4O7·10H2O (硼砂,式量为382),然后缓慢加入浓H2SO4并振荡;加热烧瓶中的液体;通过分馏柱回流一段时间。 ②先接收51~55 ℃的馏分,再接收55~60 ℃的馏分。 ③将两次馏分合并,加入氯化钙进行盐析分层,上层为硼酸三甲酯,分离。 ④精馏得高纯硼酸三甲酯19.2 g。 回答下列问题: (1)图中仪器a的名称为________;直形冷凝管冷却水应从________(填“b”或“c”)接口进入。 (2)本实验加热方式为________,优点是____________________。 (3)加入氯化钙盐析分层的主要目的是________________________________________________________________________。 (4)U型管中P2O5的作用是________________________________________________________________________。 (5)步骤④的仪器选择及安装都正确的是________(填标号),应收集________ ℃的馏分。 (6)本次实验的产率是________。 6.[2018·邯郸市第二次模拟]某合作学习小组的同学验证文献上用乙烯气脱除氮氧化物。回答下列问题: (1)甲组同学设计实验制取纯净的乙烯气体和NO。 ①设计的制备C2H4装置如下图所示: 装置B中盛放的试剂为________(填小写字母)。 a.KMnO4溶液 b.Br2/CCl4溶液 c.浓NaOH溶液 d.浓硫酸 装置C的作用是__________________________________。 ②设计右图装置制备NO气体 装置D烧瓶中发生反应的离子方程式为________________________________________________________________________; 装置E盛放的常见试剂是______________。 (2)乙组利用甲组制得的C2H4和NO并选用下列装置进行催化反应,并检验乙烯的氧化产物CO和CO2(部分装置可重复使用,已知C2H4可被热的CuO氧化为碳的氧化物,酸性高锰酸钾可氧化NO和C2H4,不氧化CO)。 ①各装置的连接顺序为→________→H→G→________→M。(按顺序填一个或多个字母) ②酸性高锰酸钾溶液的作用是__________________________________。 ③证明乙烯的氧化产物中有CO的现象是________________________________________________________________________; 若NO还原为N2,乙烯氧化为CO,则其反应的化学方程式为________________________________________________________________________。 7.[2018·山东第三次模拟]某课外活动小组根据镁与CO2的反应设计实验探究镁与NO2的反应。甲同学推测产物是MgO和N2;乙同学推测产物除了MgO和N2外,固体中还可能含有Y。该小组同学设计了如图所示装置探究镁与NO2反应的固体产物,并测定其组成。 (1)实验开始时,先关闭止水夹后打开弹簧夹,再打开分液漏斗活塞,当硬质玻璃管充满红棕色气体后,打开止水夹,关闭弹簧夹,最后点燃酒精灯。这样做的目的是________________________________________________________________________。 (2)装置B中的试剂可以选用________(填字母序号)。 A.浓硫酸 B.无水氯化钙 C.五氧化二磷 D.碱石灰 (3)装置C中盛装氢氧化钠溶液的作用是:__________________________。 (4)为保证生成体体积的准确性,读取量筒刻度时应注意的问题是:①气体恢复至室温再读数;②________________________;③__________________________。 (5)实验结束后,同学们将固体产物取出与水反应,发现有刺激性气味的气体产生,该气体能使湿润的石蕊试纸变蓝。说明乙组同学推测正确,请写出Y与水反应的化学方程式:________________________________________________________________________。 (6)若初始加入镁粉质量为3.6 g,在足量的NO2中充分反应后,收集到N2体积为448 mL(标准状况),则产物中MgO的质量是________。 8.[2018·唐山市第一中学模拟]苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理: 实验方法:一定量的甲苯和适量的KMnO4溶液在100 ℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。 已知:苯甲酸相对分子质量122 ,熔点122.4 ℃,在25 ℃和95 ℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物一般都有固定熔点。 (1)操作Ⅰ 为________,需要用到的主要玻璃仪器为________;操作Ⅱ为________。 (2)无色液体A是________,定性验证A的试剂是________,现象是__________________________。 (3)测定白色固体B的熔点,发现其在115 ℃开始熔化,达到130 ℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请在答题卡上完成表中内容。 序号 实验方案 实验现象 结论 ① 将白色固体B加入水中,加热溶解,________________ 得到白色晶体和无色溶液 ② 取少量滤液于试管中,________________ 生成白色沉淀 滤液含Cl- ③ 干燥白色晶体,____________ ________________ 白色晶体是苯甲酸 (4)纯度测定:称取1.220 g产品溶解在甲醇中配成100 mL溶液,移取25.00 mL溶液,滴定,消耗KOH的物质的量为2.40×10-3 mol,产品中苯甲酸质量分数为________________。 大题一 化学实验综合与探究 1.答案:(1)夹紧弹簧夹,往长颈漏斗中加水至漏斗管内液面高于试管内液面,一段时间后,液面差保持不变,证明气密性良好,否则气密性不好 (2)a FeS+2H+=H2S↑+Fe2+ (3)浓度分别为3.0 mol·L-1和0.1 mol·L-1的KNO3—HCl混合溶液 2H2S+Fe3++NO=2S↓+Fe2++NO↑+2H2O (4)用弹簧夹夹紧橡皮管 夹紧弹簧夹后,装置中产生的H2S难溶于稀硫酸,使试管内气体压强增大,将稀硫酸压回长颈漏斗使FeS固体和稀硫酸分离而停止反应 (5)酸式滴定管 pH计 解析:(1)检查装置的气密性原理通常是想办法造成装置不同部位有压强差,并产生某种明显现象,如气泡的生成,水柱生成,液面升降。对本装置检查气密性方法是:用弹簧夹夹紧橡皮管,往长颈漏斗中加水至漏斗管内液面高于试管内液面,一段时间后,液面差保持不变,证明气密性良好,否则气密性不好;(2)制取硫化氢气体,FeS和稀硫酸反应生成硫化氢气体,且硫化亚铁不溶于水,a可以;Na2S和稀硫酸也能反应生成硫化氢气体,但硫化钠易溶于水,无法控制硫化氢气体产生的速度,所以b不符合实验装置要求;稀硝酸具有强氧化性,可以将-2价的硫氧化,不产生硫化氢气体,所以c不可以;CuS与稀盐酸不反应,所以d不可以;FeS和稀硫酸反应的离子方程式为:FeS+2H+===Fe2++H2S↑;(3)H2S气体通入1.0 mol/L Fe(NO3)3溶液中,观察到有浅黄色固体析出,Fe3+与NO都能够与H2S反应产生S沉淀,Fe3+与NO有氧化性,A装置中加入1.0 mol/L的FeCl3溶液,并使溶液的pH=1,确定是否是Fe3+引起的,因此B中应该验证是否是NO在酸性(pH=1)条件下引起的,B中可以加入浓度分别为3.0 mol·L-1和0.1 mol·L-1的KNO3—HCl混合溶液,即:B装置中加入的试剂是浓度分别为3.0 mol·L-1和0.1 mol·L-1的KNO3—HCl混合溶液;A、B中均有浅黄色固体析出,则H2S与Fe(NO3)3溶液反应的离子方程式为2H2S+Fe3++NO===2S↓+Fe2++NO↑+2H2O;(4)利用启普发生器制取气体的原理,关闭启普发生器的活塞,产生的气体将液体压回漏斗中,固体与液体分离,反应停止,所以本实验结束时,使反应停止的操作:用弹簧夹夹紧橡皮管;此时反应停止的原因是:夹紧弹簧夹后,装置中产生的H2S难溶于稀硫酸,使试管内气体压强增大,将稀硫酸压回长颈漏斗使FeS固体和稀硫酸分离而停止反应;(5)用电子天平称取一定质量的Na2 S样品,配制成0.001 mol/L溶液,用pH计测定其溶液的pH,pH大于7,说明溶液呈碱性,证明Na2S发生水解反应,根据:S2-+H2OHS-+OH-说明H2S是弱酸;再配制0.001 mol/L H2SO4的稀溶液,取0.001 mol/L Na2S溶液20.00 mL于锥形瓶中,用0.001 mol/L H2SO4溶液进行滴定,当滴入5 mL 0.001 mol/L硫酸溶液时,此时溶液中S2-与HS-的浓度基本相同,用pH计测定溶液的pH,通过换算确定Ka2,Ka2=c(S2-)c(H+)/c(HS-)≈c(H+),因此,以Na2S为样品,选择合理的仪器和试剂设计实验①证明氢硫酸为二元弱酸②测量并估算氢硫酸的Ka2(H2S),则需要的主要计量仪器为电子天平、容量瓶、酸式滴定管和pH计。 2.答案:(1)分液漏斗 Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O (2)增大气体与溶液的接触面积,让反应充分进行 (3)7SO2+6HNO3+4H2O===4NO+2NO2+7H2SO4 (4)如果pH<7,亚硝酸盐会转化为硝酸盐和NO气体,使其产量下降 (5)取C中溶液少量于试管中,加足量稀硝酸有气体生成,遇空气变红棕色,则证明C中有NO生成 (6)(345cV/2m)%或3.45cV/2m 解析:(1)仪器a的名称为分液漏斗,A装置中利用浓硫酸与亚硫酸钠反应生成硫酸钠、二氧化硫和水制备二氧化硫,发生的化学反应方程式为Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O;(2)B装置中多孔球泡的作用是增大气体与溶液的接触面积,让反应充分进行;(3)若装置B中逸出的NO与NO2气体物质的量之比为2:1,则装置B中发生反应的化学方程式为7SO2+6HNO3+4H2O===4NO+2NO2+7H2SO4;(4)根据已知信息可知如果pH<7,亚硝酸盐会转化为硝酸盐和NO气体,使NaNO2的产量会下降;(5)取C中溶液少量于试管中,加足量稀硝酸有气体生成,遇空气变红棕色,则证明C中有NO生成;(6)消耗酸性KMnO4是0.001cV mol,根据方程式可知亚硝酸钠是0.0025cV mol,因此粗产品中NaNO2的质量分数为×100%=%。 3.答案:(1)Zn+2HCl===ZnCl2+H2↑ 可随时控制反应的发生和停止 (2)检验氢气纯度 (3)c-b-g-f-d-e-g-f 防止Ca3N2和CaH2水解 (4)6H2+Ca3N23CaH2+2NH3 (5)灼烧固体,若有水珠生成,则含有固体CaH2 解析:(1)启普发生器制备氢气,其中发生的化学反应方程式是Zn+2HCl===ZnCl2+H2↑。利用该装置制取气体的优点是可随时控制反应的发生和停止。(2)由于氢气是可燃性气体,需要验纯,则实验中,先通入氢气,然后检验氢气纯度,再加热。(3)根据以上分析可知装置连接顺序为a-c-b-g-f-d-e-g-f-h,其中干燥管的作用是干燥氢气,同时也防止Ca3N2和CaH2水解。(4)若取集气瓶中的水溶液,滴加酚酞显红色,说明生成物是氨气,则制取CaH2的反应方程式为6H2+Ca3N23CaH2+2NH3。(5)CaH2中含有氢元素,固体灼烧时会产生水,所以反应后证明试管中固体有CaH2的实验方法是灼烧固体,若有水珠生成,则含有固体CaH2。 4.答案:(1)①O===C===S ②COS+4Br2+12OH-===CO+SO+8Br-+6H2O ③+285 bcd ④140~150 ℃均可 催化剂中毒或发生副反应(平衡逆向移动相关描述一律不给分) (2)2.24 c(NH)>c(HSO)>c(SO)>c(H+)=c(OH-) 解析:(1)①COS的结构式为O===C===S。②Br2的KOH溶液将COS氧化为硫酸盐的离子方程式为COS+4Br2+12OH-===CO+SO+8Br-+6H2O。③H2还原COS发生的反应为H2(g)+COS(g)=H2S(g)+CO(g),该反应的ΔH=-285-299-(-586)-(-283)=+285 kJ/mol。恒温恒容条件下,密闭容器中将气体按n(H2):n(COS)=21混合,混合气体的平均相对分子质量始终不变,无法说明反应达到平衡状态,a项错误;n(H2)与n(COS)的比值不变,说明各物质的浓度不再发生变化,可以证明反应达到平衡状态,b项正确;CO的体积分数不变,说明各物质的浓度不再发生变化,可以说明反应达到平衡状态,c项正确;形成2 mol H-S键同时形成1 mol H-H键,表明正、逆反应速率相等,可以说明反应达到平衡状态,d项正确。④由图可知,催化剂活性最大时对应的温度处于140℃~150℃之间,H2S的产率在后期下降是由于催化剂中毒或发生副反应。(2)当将SO2通入氨水中,当溶液呈中性时,c(H+)=c(OH-),而根据溶液中电荷守恒有,c(H+)+c(NH)=2c(SO)+c(HSO)+c(OH-),由于溶液呈中性,c(H+)=c(OH-)代入电荷守恒有c(NH)=2c(SO)+c(HSO),即==+1,而====0.62,因此=2× 0.62+1=2.24,此时溶液中各离子浓度大小为c(NH)>c(HSO)>c(SO)>c(H+)=c(OH-)。 5.答案:(1)分馏柱 c (2)水浴加热 使物体受热均匀,便于控制反应温度 (3)除去甲醇,避免精馏时形成恒沸物 (4)防止空气中的水蒸气进入,导致硼酸三甲酯水解 (5)b 68 (6)92.3% 解析:(1)图中仪器a的名称为分馏柱;为保证冷凝效果,采用逆流原理,因此直形冷凝管冷却水应从c接口进入。(2)根据题给信息可知,硼酸三甲酯、甲醇的沸点均小于100 ℃,因此可以采用水浴加热;其优点是使物体受热均匀,便于控制反应温度。(3)根据题给信息可知,加入氯化钙进行盐析分层,上层为硼酸三甲酯,这样就除去了甲醇,避免精馏时形成恒沸物。(4)硼酸三甲酯能够发生水解,要避免和水接触,因此U型管中P2O5的作用是防止空气中的水蒸气进入锥形瓶内,导致硼酸三甲酯水解。(5)蒸馏装置中,温度计测蒸汽的温度,温度计水银球在蒸馏烧瓶的支管口处,要用直形冷凝管进行冷凝,要用牛角管连接冷凝管,因此步骤④的仪器选择及安装都正确的是b;要提纯的是硼酸三甲酯,硼酸三甲酯沸点为68 ℃,所以温度控制在68 ℃进行馏分的收集。(6)44.8 g甲醇的量为1.4 mol,19.1 g Na2B4O7·10H2O 的物质的量为19.1/382=0.05 mol;根据Na2B4O7·10H2O+2H2SO4+16CH3OH2NaHSO4+4[(CH3O)3B+CH3OH]+17H2O反应可知,甲醇过量,按Na2B4O7·10H2O进行计算,根据反应关系可知;得到硼酸三甲酯的量为0.2 mol,质量为0.2×104=20.8 g,本次实验的产率是19.2/20.8×100%=92.3%。 6.答案:(1)①c 干燥乙烯气体 ②3Cu+8H++2NO===3Cu2++2NO↑+4H2O H2O(或水) (2)①G→I J→L→G ②除去未反应的C2H4和NO ③L中黑色粉末变为红色,其后的澄清石灰水变浑浊 4NO+C2H42N2+2CO+2H2O 解析:(1)①由于乙醇与浓硫酸反应还可能生成SO2或CO2,因此,装置B中盛放浓NaOH溶液用来吸收CO2以及SO2,装置C则用来干燥乙烯气体。②制备NO气体,装置D烧瓶中发生反应,离子方程式为3Cu+8H++2NO===3Cu2++2NO↑+4H2O,装置E中盛放试剂为H2O。(2)①各装置的连接顺序为。② 酸性高锰酸钾溶液的作用是除去未反应的C2H4和NO。③证明乙烯的氧化产物中有CO的现象是L中黑色粉末变为红色其后的澄清石灰水变浑浊;若NO还原为N2,乙烯氧化为CO,则根据质量守恒以及电子守恒,4NO+C2H42N2+2CO+2H2O。 7.答案:(1)排除装置中空气,避免空气干扰 (2)D (3)吸收剩余NO2 (4)②调整量筒中液面与D中水平 ③视线与液体凹液面相切 (5)Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑ (6)4.8g 解析:(1)实验开始时,先关闭止水夹后打开弹簧夹,再打开分液漏斗活塞,当硬质玻璃充满红棕色气体后,打开止水夹,关闭弹簧夹,最后点燃酒精灯,这样做是为了排除装置中空气,避免空气干扰。(2)装置B用来吸收NO2,选用碱石灰。(3)装置C中盛放氢氧化钠溶液用于吸收剩余NO2。(4)为保证生成体积准确读取量筒刻度应使气体恢复至室温再读数,调整量筒中液面与D中水平,视线与液体凹液面相切。(5)由于生成气体具有刺激性气味且能使湿润的石蕊试纸变蓝,则生成气体为NH3,化学方程式为Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑。(6)初始加入镁粉3.6 g,n(Mg)==0.15 mol,生成N2的体积为448 mL(标准状况),n(N2)==0.02 mol,根据得失电子守恒,有Mg→Mg2+,失电子0.15×2=0.3 mol,NO2→N2,得电子0.02×2×4=0.16 mol,则NO2→Mg3N2,得电子0.3-0.16=0.14 mol,n(Mg3N2)=0.01 mol,根据Mg原子守恒n(MgO)=n(Mg)-3×n(Mg3N2)=0.12 mol,m(MgO)=0.12 mol×40 g/mol=4.8 g。 8.答案:(1)分液 分液漏斗、烧杯等 蒸馏 (2)甲苯 酸性KMnO4溶液 溶液褪色 (3)①冷却结晶、过滤 ②滴入2~3滴硝酸酸化的AgNO3溶液 ③加热使其融化,测其熔点 熔点为122.4℃ (4)96% 解析:(1)有机物和水不互溶,分离操作是分液,互溶的有机物要得到纯净物一般方法为蒸馏。(2)从题干信息可知,A为甲苯,B为苯甲酸,检验苯的同系物可以利用酸性高锰酸钾来定性检验。(3)由实验现象得白色晶体和无色滤液可知,①中操作为固液分离操作;②检验Cl-应用硝酸酸化的硝酸银溶液;③ 由题干信息,应该用检测熔点来检验物质成分。(4) ,n()=2.4×10-3mol×=9.6×10-3mol,则苯甲酸的质量分数为×100%=96%。查看更多