高中化学第3章物质在水溶液中的行为第2节弱电解质的电离盐类的水解3水解反应的应用课件鲁科版选择性必修1
第
3
课时 水解反应的应用
一、实验探究盐类水解的应用
必备知识
·
素养奠基
实验
序号
实验
名称
实验用品
实验方案
现象及结论
药品
仪器
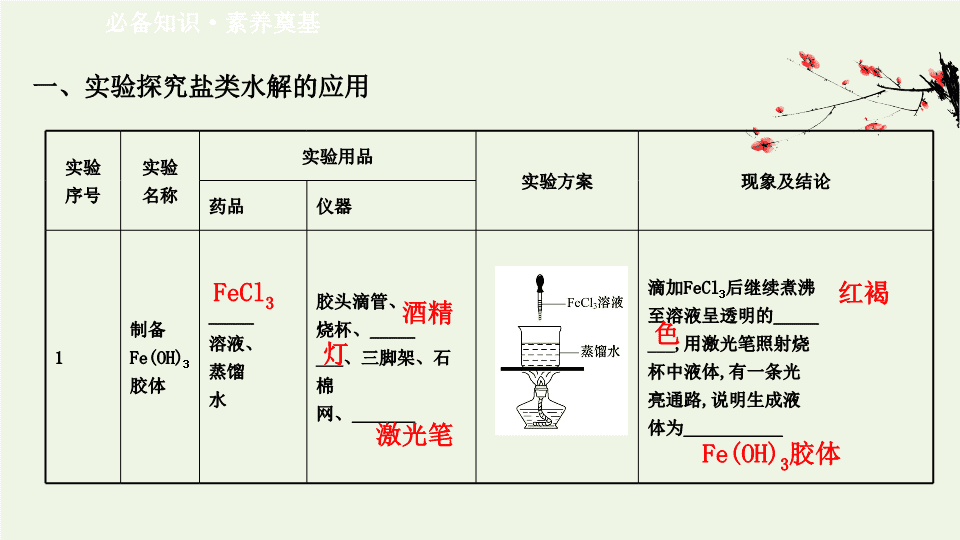
1
制备
Fe(OH)
3
胶体
_____
溶液、
蒸馏
水
胶头滴管、
烧杯、
_____
___
、三脚架、石棉
网、
_______
滴加
FeCl
3
后继续煮沸
至溶液呈透明的
_____
___,
用激光笔照射烧
杯中液体
,
有一条光
亮通路
,
说明生成液
体为
___________
FeCl
3
酒精
灯
激光笔
红褐
色
Fe(OH)
3
胶体
实验
序号
实验
名称
实验用品
实验方案
现象及结论
药品
仪器
2
除去略浑浊天然水中的悬浮颗粒物
略浑浊的
天然水、
_________
溶液
胶头滴管、烧杯
滴加
Al
2
(SO
4
)
3
后产生
_____
沉淀和少量
_____,
静置一段时间后
,
待完
全沉淀后
,
浑浊天然水
变
_____
。说明
Al
3+
水解
产生的
___________
吸
附杂质
,
起到净水作用
Al
2
(SO
4
)
3
白色
气泡
澄清
Al(OH)
3
胶体
实验
序号
实验
名称
实验用品
实验方案
现象及结论
药品
仪器
3
清除厨房的油污
______
溶液、
植物
油
试管、胶头滴管、酒精灯
开始滴入植物油后
,
液体分成上下两层
,
加热后静置一段时
间
,
溶液不再
_____
。
说明 加热水解
产生的
___
促进了油
脂的水解
Na
2
CO
3
分层
OH
-
二、分析复杂液体体系的一般思路
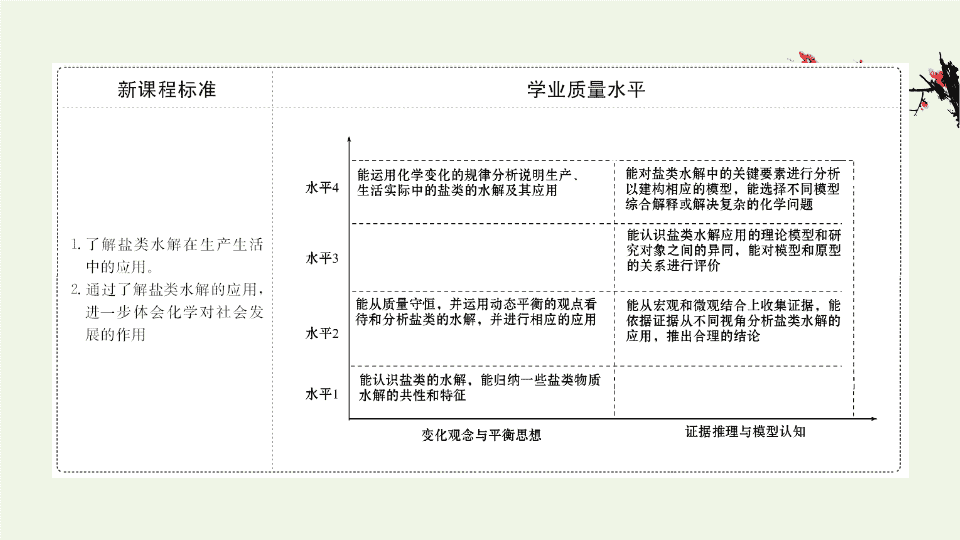
三、日常生活中盐类水解的应用总结
1.
泡沫灭火器
(1)
试剂
:_________
溶液和
______
溶液。
(2)
原理
:Al
3+
和 的水解相互促进
,
生成
___
气体和
_______
沉淀
,
产生大量
泡沫
,
隔绝可燃物和空气。反应的离子方程式为
__________________________
______
。
Al
2
(SO
4
)
3
NaHCO
3
CO
2
Al(OH)
3
Al
3+
+3 ====Al(OH)
3
↓+
3CO
2
↑
2.
盐溶液的配制
配制、保存易水解的盐溶液时
,
加入相应的酸
(
或碱
)
抑制水解。如配制
SnCl
2
溶
液时
,
加入适量
_____
抑制
Sn
2+
的水解
,
得到澄清的溶液。
3.
盐类作净水剂
硫酸铝钾或硫酸铝中的
Al
3+
水解生成的
Al(OH)
3
胶体
,
反应的离子方程式为
________________________________,Al(OH)
3
胶体有较强的吸附能力
,
常用
作净水剂。
盐酸
Al
3+
+3H
2
O Al(OH)
3
(
胶体
)+3H
+
4.
热碱水清洗油污
纯碱在水中发生水解
:_______________________,
加热促进水解平衡
_____,
溶
液的碱性增强
,
去污能力增强。
+H
2
O +OH
-
右移
【
想一想
】
蒸干
AlCl
3
水溶液并灼烧
,
得到的固体物质主要是什么
?
蒸干并灼烧
Al
2
(SO
4
)
3
溶
液呢
?
提示
:
AlCl
3
溶液中存在
:AlCl
3
+3H
2
O Al(OH)
3
+3HCl,
加热
,HCl
挥发
,
平衡右
移
,
得到
Al(OH)
3
,
再灼烧
Al(OH)
3
分解
,
最终得到
Al
2
O
3
。蒸干并灼烧
Al
2
(SO
4
)
3
溶
液得到
Al
2
(SO
4
)
3
。
关键能力
·
素养形成
知识点 盐类水解的应用
【
重点释疑
】
应用
举例
判断溶液的酸碱性
FeCl
3
溶液显酸性
,
原因是
Fe
3+
+3H
2
O Fe(OH)
3
+3H
+
配制或贮存易水解的盐溶液
配制
CuSO
4
溶液时
,
加入少量
H
2
SO
4
,
抑制
Cu
2+
水解
判断盐溶液蒸干灼烧后的产物
AlCl
3
溶液蒸干灼烧后的产物为
Al
2
O
3
应用
举例
胶体的制取
将饱和
FeCl
3
溶液滴入沸水中制取
Fe(OH)
3
胶体
,
离子
反应
:Fe
3+
+3H
2
O Fe(OH)
3
(
胶体
)+3H
+
物质的提纯
除去
MgCl
2
溶液中的
Fe
3+
,
可加入
MgO
、
Mg(OH)
2
或
MgCO
3
,
使
Fe
3+
沉淀后过滤
离子共存的判断
Al
3+
与 、 、 、
S
2-
、
HS
-
等因水解相
互促进而不能大量共存
应用
举例
泡沫灭火器原理
成分为
NaHCO
3
与
Al
2
(SO
4
)
3
,
发生反应
Al
3+
+3 ====Al(OH)
3
↓+3CO
2
↑
净水原理
明矾可做净水剂
,
原理为
Al
3+
+3H
2
O Al(OH)
3
(
胶
体
)+3H
+
化肥的使用
铵态氮肥与草木灰不得混用
,
原因是 与 的
水解相互促进降低肥效
【
思考
·
讨论
】
(1)
实验室里配制
FeCl
3
溶液
,
常将
FeCl
3
固体溶解在稀盐酸中
,
而不是直接溶解在蒸馏水中
,
为什么
?
提示
:
盐酸能抑制
Fe
3+
的水解。
(2)
如何除去
MgCl
2
溶液中混有的少量
Fe
3+
?
提示
:
Fe
3+
水解溶液呈酸性
,
加入过量
MgO
搅拌后过滤即可。
【
拓展深化
】
1.
能水解的盐溶液蒸干灼烧产物的判定
:
(1)
强酸强碱盐溶液和水解生成难挥发性酸的盐溶液
,
蒸干后一般得到原物质
,
如
CuSO
4
溶液蒸干得
CuSO
4
固体
,Na
2
SO
4
溶液蒸干得
Na
2
SO
4
固体。
(2)
盐溶液水解生成易挥发性酸时
,
蒸干后一般得到对应的弱碱
,
如
AlCl
3
、
FeCl
3
溶液蒸干后一般得到
Al(OH)
3
、
Fe(OH)
3
,
若灼烧则会生成
A1
2
O
3
、
Fe
2
O
3
。
(3)
其他需要考虑的方面。
例如
,
蒸干
Na
2
CO
3
溶液时
,
由于 分两步水解
,
第二步水解非常微弱
,
所以蒸
干
Na
2
CO
3
溶液所得固体仍为
Na
2
CO
3
。蒸干
NaHCO
3
溶液时
,
析出
NaHCO
3
固体
,
继续
灼烧
,NaHCO
3
分解为
Na
2
CO
3
固体。
2.
弱酸、弱碱盐溶液酸碱性的判断方法
:
弱酸弱碱盐的阴、阳离子都水解
,
其溶液的酸碱性取决于弱酸和弱碱的相对强弱
,
即比较两者电离常数的大小
,
电离常数大的相对要强一些
,
溶液就显相对强的物质的性质。当
K
酸
=K
碱
时
,
溶液显中性
,
如
CH
3
COONH
4
;
当
K
酸
>K
碱
时
,
溶液显酸性
,
如
HCOONH
4
;
当
K
酸
b
B.a=10
-4
b
C.b=10
-4
a
D.a=b
【
解析
】
选
B
。水的电离方程式
:H
2
O H
+
+OH
-
,
在
pH=9
的
NaOH
溶液中
,c
平
(H
+
)
=10
-9
mol
·
L
-1
,
且这些
H
+
全部来自于水的电离
;
又因为水电离时
c
平
(H
+
)
水
=
c
平
(OH
-
)
水
,
所以由水电离产生的
c
平
(OH
-
)=a mol
·
L
-1
=10
-9
mol
·
L
-1
。在
CH
3
COONa
溶液里
,
由于
CH
3
COO
-
结合了溶液中水电离出的
H
+
,
生成弱酸
CH
3
COOH,
会
使水的电离平衡被破坏
,
并向右移动
,
即促进了水的电离
,
这样
c
平
(OH
-
)
增大
,
在
pH=9
的
CH
3
COONa
溶液中
,c
平
(H
+
)=10
-9
mol
·
L
-1
,
而水电离出来的
c
平
(OH
-
)=
mol
·
L
-1
=10
-5
mol
·
L
-1
=b mol
·
L
-1
。综合上述分析
,a
与
b
的关系正确
的是
=10
-4
,
即
a=10
-4
b
。
3.(2020·
泰安高二检测
)
如图所示三个烧瓶中分别装入含酚酞的
0.01mol·L
-1
CH
3
COONa
溶液
,
并分别放置在盛有水的烧杯中
,
然后向烧杯①中加入生石灰
,
向烧杯③中加入
NH
4
NO
3
晶体
,
烧杯②中不加任何物质。
(1)
含酚酞的
0.01mol·L
-1
CH
3
COONa
溶液显红色的原因是什么
?
(2)
实验过程中发现烧杯①中溶液红色变深
,
烧瓶③中溶液红色变浅
,
则可以说明哪些问题
?
(3)
向
0.01mol·L
-1
CH
3
COONa
溶液中分别加入少量浓盐酸、
NaOH
固体、
Na
2
CO
3
固体、
FeSO
4
固体
,
使
CH
3
COO
-
水解平衡移动的方向分别是什么
?(
填“左” “右”或“不移动”
)
。
【
解析
】
(1)CH
3
COONa
中
CH
3
COO
-
水解使溶液显碱性
,
碱性溶液使酚酞显红色。
(2)
生石灰与水反应放出大量的热
,
根据烧瓶①中溶液的红色变深
,
判断水解平
衡向右移动
,
说明水解反应是吸热的
,
同时烧瓶③中溶液红色变浅
,
则
NH
4
NO
3
溶
于水时吸收热量。
(3)
酸促进
CH
3
COO
-
的水解
;
碱抑制
CH
3
COO
-
的水解
;
与
CH
3
COO
-
水解相互抑制
;Fe
2+
与
CH
3
COO
-
水解相互促进。
答案
:
(1)CH
3
COO
-
+H
2
O CH
3
COOH+OH
-
,
使溶液显碱性
(2)
水解反应为吸热反
应
,NH
4
NO
3
溶于水时吸收热量
(3)
右 左 左 右
【
核心整合
】
1.
盐类水解的规律
知识关联
·
素养应用
2.
用盐类水解原理分析解答实际应用问题的方法思路
(1)
认真审题
,
找出题目给定的盐类
,
确定能水解的离子。
(2)
写出水解平衡方程式
,
分析题给条件对水解的影响及结果。
(3)
联系题目要求
,
写出合理答案。
3.
电解质溶液中的三个守恒关系
(1)
电荷守恒关系
电解质溶液中
,
不论存在多少种离子
,
溶液总是呈电中性
,
即阴离子所带负电荷
总数一定等于阳离子所带正电荷总数
,
如
Na
2
CO
3
溶液中存在着
Na
+
、 、
H
+
、
OH
-
、
,n(
正电荷
)=n(
负电荷
),
即
:n(Na
+
)+n(H
+
)=2n( )+n( )
+n(OH
-
),
两边同时除以体积
,
有
c
平
(Na
+
)+c
平
(H
+
)=2c
平
( )+c
平
( )+
c
平
(OH
-
)
。
(2)
物料守恒关系
电解质溶液中
,
由于某些离子能水解或电离
,
离子种类增多
,
但原子总数是守恒
的
,
如
Na
2
CO
3
溶液中
n(Na
+
)
与
n(C)
的比为
2∶1,
水解后碳元素以 、
、
H
2
CO
3
三种形式存在
,
它们之间的守恒关系为
c
平
(Na
+
)=2c
平
( )+
2c
平
(H
2
CO
3
)+2c
平
( )
。
(3)
质子守恒关系
质子守恒是根据水电离出的
c
平
(OH
-
)=c
平
(H
+
),
溶液中的
H
+
或
OH
-
虽与其他离子结
合而以不同的形式存在
,
但其总量相同。如在
Na
2
CO
3
溶液中有关系式
:c
平
(OH
-
)
=c
平
(H
+
)+c
平
( )+2c
平
(H
2
CO
3
)
。
【
素养迁移
】
1.
侯氏制碱法的副产物之一就是
NH
4
Cl
。氯化铵
,
简称氯铵
,
含氮
24%
~
26%,
呈白色或略带黄色的方形或八面体小结晶
,
有粉状和粒状两种剂型
,
粒状氯化铵不易吸湿
,
易储存
,
而粉状氯化铵较多用作生产复肥的基础肥料。氯化铵用于稻田肥效较高而且稳定
,
因为
Cl
既可抑制稻田硝化作用
,
又有利于水稻茎秆纤维形成
,
增加韧性
,
减少水稻倒伏和病虫侵袭。
已知
,
把
NH
4
Cl
晶体溶入水中
,
得到饱和
NH
4
Cl
溶液。
(1)
若在该溶液中加入镁条
,
观察到有气泡产生
,
点燃气体有爆鸣声
,
此气体是什么
?
产生该气体的原因是什么
?(
用离子方程式表示
)
提示
:
H
2
。
+H
2
O NH
3
·H
2
O+H
+
、
Mg+2H
+
====Mg
2+
+H
2
↑
(2)
微热后
,
能放出有刺激性气味的气体
,
它能使湿润的红色石蕊试纸变蓝
,
该气体是什么
?
产生该气体的原因是什么
?
提示
:
NH
3
。因为
c
平
(H
+
)
减小
,
使水解平衡右移
,
产生的
NH
3
·H
2
O
增多
,
加热使
NH
3
·H
2
O
分解放出
NH
3
。
(3)
总反应的离子方程式为什么
?
提示
:
Mg+2 Mg
2+
+H
2
↑+2NH
3
↑
2.
判断下列电解质溶液中的守恒关系哪些正确
,
哪些错误
?(
已知
H
2
C
2
O
4
为二元
弱酸
)
。
(1)0.1 mol·L
-1
Na
2
SO
3
溶液中
,
c
平
(Na
+
)=2c
平
( )+c
平
( )+c
平
(H
2
SO
3
)
。
(2)0.1 mol·L
-1
Na
2
S
溶液中
,
c
平
(H
+
)=c
平
(OH
-
)-2c
平
(H
2
S)-c
平
(HS
-
)
。
(3)0.1 mol·L
-1
Na
2
C
2
O
4
溶液与
0.1 mol·L
-1
HCl
溶液等体积混合
(H
2
C
2
O
4
为弱酸
),
2c
平
( )+c
平
( )+c
平
(OH
-
)=c
平
(Na
+
)+c
平
(H
+
)
。
(4)pH=1
的
NaHSO
4
溶液中
,
c
平
(H
+
)=c
平
( )+c
平
(OH
-
)
。
(5)0.1 mol·L
-1
NaHC
2
O
4
溶液中
,
c
平
(Na
+
)=c
平
(
)+c
平
(
)
。
(6)0.1 mol·L
-1
Na
2
CO
3
溶液与
0.1 mol·L
-1
NaHCO
3
溶液等体积混合
,
c
平
(Na
+
)=c
平
(
)+c
平
(
)+c
平
(H
2
CO
3
)
。
(7)0.1 mol·L
-1
CH
3
COOH
溶液与
0.1 mol·L
-1
NaOH
溶液等体积混合后的溶液中
,
c
平
(OH
-
)>c
平
(H
+
)+c
平
(CH
3
COOH)
。
【
解析
】
(1)
不符合物料守恒
,
正确的关系式为
c
平
(Na
+
)=2c
平
(
)+
2c
平
(
)+2c
平
(H
2
SO
3
)
。
(2)
符合质子守恒
,c
平
(OH
-
)=c
平
(H
+
)+2c
平
(H
2
S)+c
平
(HS
-
),
移项即可。
(3)
不符合电荷守恒
,
漏写
c
平
(Cl
-
),
正确的关系式是
c
平
(Cl
-
)+2c
平
(
)+
c
平
(
)+c
平
(OH
-
)=c
平
(Na
+
)+c
平
(H
+
)
。
(4)
符合电荷守恒
,c
平
(Na
+
)+c
平
(H
+
)=2c
平
(
)+c
平
(OH
-
),
因
c
平
(Na
+
)=
c
平
(
),
故成立。
(5)
不符合物料守恒。正确的关系式为
c
平
(Na
+
)=c
平
(
)+c
平
(H
2
C
2
O
4
)
+c
平
(
)
。
(6)
符合物料守恒。
c
平
(Na
+
)=0.15 mol
·
L
-1
,c
平
(
)+c
平
(
)+
c
平
(H
2
CO
3
)=0.1 mol
·
L
-1
,
故
c
平
(Na
+
)=c
平
(
)+c
平
(
)+c
平
(H
2
CO
3
)
。
(7)
不符合质子守恒
,
正确的关系式为
c
平
(OH
-
)=c
平
(H
+
)+c
平
(CH
3
COOH)
。
答案
:
正确的有
(2)(4)(6),
其余不正确。