化学卷·2019届湖北省公安县车胤中学高二下学期3月月考(2018
公安县车胤中学2017-2018学年度下学期高二(2016级)
三月月考化学试卷
考试时间:90分钟 试卷分值:100分
可能用到的相对原子质量:H-1 C-12 O-16 Ca-40 Br-80
第Ⅰ卷(单项选择题,16小题。共48分。注意内容1-5题选修4, 6-16题选修5)
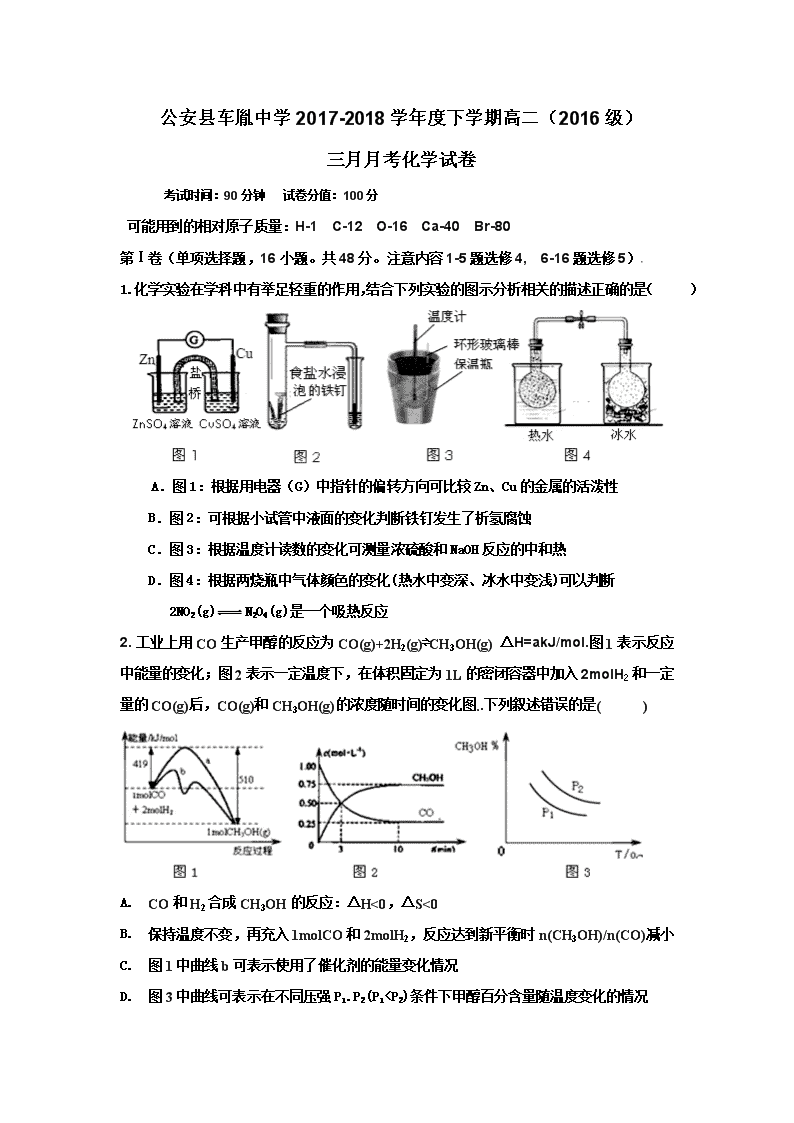
1.化学实验在学科中有举足轻重的作用,结合下列实验的图示分析相关的描述正确的是( )
A.图1:根据用电器(G)中指针的偏转方向可比较Zn、Cu的金属的活泼性
B.图2:可根据小试管中液面的变化判断铁钉发生了析氢腐蚀
C.图3:根据温度计读数的变化可测量浓硫酸和NaOH反应的中和热
D.图4:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)可以判断
2NO2(g)N2O4(g)是一个吸热反应
2. 工业上用CO生产甲醇的反应为CO(g)+2H2(g)⇌CH3OH(g) △H=akJ/mol.图1表示反应中能量的变化;图2表示一定温度下,在体积固定为1L的密闭容器中加入2molH2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图..下列叙述错误的是( )
A. CO和H2合成CH3OH的反应:△H<0,△S<0
B. 保持温度不变,再充入1molCO和2molH2,反应达到新平衡时n(CH3OH)/n(CO)减小
C. 图1中曲线b可表示使用了催化剂的能量变化情况
D. 图3中曲线可表示在不同压强P1.P2(P1
c(HA-)>c(H+)>c(A2-)>c(OH-)
C.当V(NaOH)=30 mL时,溶液中存在以下关系:
2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
D.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
6. 《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,
令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之..”文中涉及的操作方法是( )
A. 蒸馏
B. 干馏
C. 升华
D. 萃取
7. 当前在人类已知的化合物中,种类最多的是( )
A.ⅠA族元素的化合物 B. ⅣA族元素的化合物
C.ⅥA族元素的化合物 D.ⅥB族元素的化合物
8. 相同质量的下列各种烃,完全燃烧消耗V(O2)【同温同压】最多的是( )
A.CH4 B.C2H4 C.C2H2 D.C6H6
9.烷烃CH3CH2CH(CH2CH2CH3)CH(CH3)CH3的命名正确的是( )
A. 4−甲基−3−丙基戊烷 B. 3−异丙基己烷
C. 2−甲基−3−丙基戊烷 D. 2−甲基−3−乙基己烷
10.不能直接用乙烯为原料制取的物质是( )
A. CH3CH2Cl B. CH2Cl-CH2Cl C. D.
11. 某烃有两种或两种以上的同分异构体,其同分异构体中的某一种的一氯代物只有
一种,则这种烃可能是( )
① 分子中具有7个碳原子的芳香烃 ② 分子中具有4个碳原子的烷烃
③ 分子中具有l2个氢原子的烷烃 ④ 分子中具有6个碳原子的烷烃
⑤ 分子中具有8个碳原子的烷烃
A.①②③ B.③⑤ C.③④⑤ D.②③④⑤
12. 已知烯烃经臭氧氧化后,在Zn存在下水解,可得醛或酮..如: , 现有化学式为C10H20的烯烃,它经臭氧氧化后在Zn存在下水解只生成一种有机物,符合该条件的结构 共有( )种
A.4 B.5 C.6 D.7
13.已知甲苯的结构简式为 ,其二氯代物的同分异构体有( )
A. 7种
B. 8种
C. 9种
D. 10种
14.X、Y两种有机物的分子式不同,但均含有C、H或C、H、O元素,将X、Y以任意
比例混合,只要物质的量之和不变,完全燃烧时耗氧量和生成水的物质的量也不变.
则下列有关判断正确的是( )
A. X、Y分子式中氢原子数不一定相同,碳原子数一定不同
B. X、Y分子式中碳原子数一定相同,氢原子数一定不同
C. 若X为CH4,则相对分子质量最小的Y是乙酸或甲酸甲酯
D. 若X为C2H6,则相对分子质量最小的Y的同分异构体只有2种
15.有三种有机物的分子式均为C8H8,其键线式分别表示为 X:,Y:,Z:。下列说法正确的是:
A. X、Y、Z都能发生氧化反应,X和Z还能发生加聚反应
B. X、Z分子中所有原子一定在同一平面内
C. X、Y、Z互为同分异构体,它们二氯代物的同分异构体数目相同
D. X、Y、Z都能使溴的四氯化碳溶液褪色
16. 现拟分离乙酸乙酯、乙酸、乙醇的混合物,如图是分离操作步骤流程图..下列有关
说法错误的是( )
A. 操作①用到的玻璃仪器主要有分液漏斗、烧杯
B. 工业制备无水E物质的方法是在E中加生石灰后进行操作②
C. 试剂b可用硫酸
D. 操作③用到的仪器和用品主要有漏斗、烧杯、玻璃棒、滤纸
第Ⅱ卷(5大题,共52分)
17.(10分)按要求完成下列问题:
(1)甲基的电子式___________。
(2)写出由丙烯制备聚丙烯的化学反应方程式__________ _。
(3)反式2 -丁烯的结构简式__________ _
(4)与H2加成生成2,5 - 二甲基己烷的炔烃的系统命名__________ _
(5)的系统命名_________ __。
18.(10分) 如图是由4个碳原子结合成的6种有机物(氢原子没有画出)
(1)有机物(a)有一种同分异构体,试写出其结构简式 ______ .
(2)上述有机物中与(c)互为同分异构体的是 ______ (填代号).
(3)任写一种与(e)互为同系物的最简单有机物的结构简式 ______ .
(4)上述有机物中不能使酸性高锰酸钾溶液褪色的有 ______ (填代号).
(5)(a)(b)(c)(d)四种物质中,4个碳原子一定处于同一平面的有 ______ (填代号).
19.(14分) 已知CO是工业上重要的原料,可作燃料、冶炼金属、合成液体酒精等。
(1)研究表明:反应CO(g)+H2O(g) H2(g)+CO2(g) ⊿H = ?
平衡常数随温度的变化如下表所示:
温度/℃
400
500
800
平衡常数K
9.94
9
1
Ⅰ.通过平衡常数随温度的变化情况,推断反应热⊿H 0 (填>、<、﹦ )
Ⅱ.若反应在500℃时进行,设起始的CO和H2O的浓度均为0.020 mol·L-1,在该
条件下CO的平衡转化率为________。
(2)用CO做燃料电池电解CuSO4溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D 均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。
①甲中通入CO的电极为 (填“正”、“负”、“阴”、“阳”)极,该电极反应方程式为
②若乙中A极析出的气体在标准状况下的体积为2.24L,此时要使乙中CuSO4溶液恢复到原来的浓度,需要加入的物质及其物质的量是( )。
A.0.1molCuO B.0.1molCu(OH)2 C.0.1molCu2(OH)2CO3
③丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示。完成丙装置C、D电极反应式
C: D: ;丙装置溶液中 C(Cl-)= mol/L 。
20.(10分)用电石(CaC2)制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量, 从而计算电石
(CaC2)的纯度。[
(1)完成甲装置发生的化学反应方程式
(2)进行实验时,所制气体从左向右流,仪器的正确连接顺序是_______ _
(填接口字母);
(3)为了使实验中气流平稳,甲中分液漏斗里的液体X通常用____________________;
(4)若在标准状况下溴水与乙炔完全反应生成C2H2Br4,已知称取电石m g,测得量筒内液体体积V mL,则电石纯度可表示为________ ;
⑸若没有除H2S的装置,测定结果将会________(填“偏高”、“偏低”或“不变”),理由是_______ (用化学方程式表示)
21,(8分)(1)某有机化合物A 6.8g,完全燃烧后生成3.6g水和8.96LCO2 (标准状况),已知该有机物的蒸汽对氢气的相对密度为68,则该有机物的分子式为 。
(2)该有机物A的核磁共振氢谱和红外光谱如下:
试推测有机物A的结构简式为 。
(3)与A属于同类有机物的同分异构体共 种,其结构简式分别为(不一定填满空格)
① ② ③
④ ⑤ ⑥ ……
车胤中学2017-2018学年度下学期高二(2016级)
三月月考化学试卷答案
1.A 2.B 3.D 4.B 5.B 6.C 7.B 8.A 9.D 10.D
11.B 12.D 13.D 14.C 15.A 16 .D
17.(10分)(1)(2) (3)(4)2,5-二甲基-3-己炔(5)4-甲基-2-乙基-1-戊烯
18.(10分)CH3CH2CH2CH3;(b)、(f);CH≡CH;(a)(f);(b)、(c)、(d)
19.(14分)(1)< 75﹪ (2) ①负 CO – 2e- +4OH- =CO32- + 2H2O ② B
③Cu – 2e- = Cu2+ 2Fe3+ +2e- =2Fe2+ 14
20.(10分)(1)(2)AHGEFDCB (3)饱和食盐水 (4)%(5)偏高 H2S+Br2===S↓+2HBr
21.(8分) (1)C8H8O2 (2) (3)5 其它同分异构体(略)