- 2021-02-26 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020版高中化学 第一章第1节课时2 蒸馏、萃取(分液)与Cl-、SO2-4的检验学案 新人教版必修1
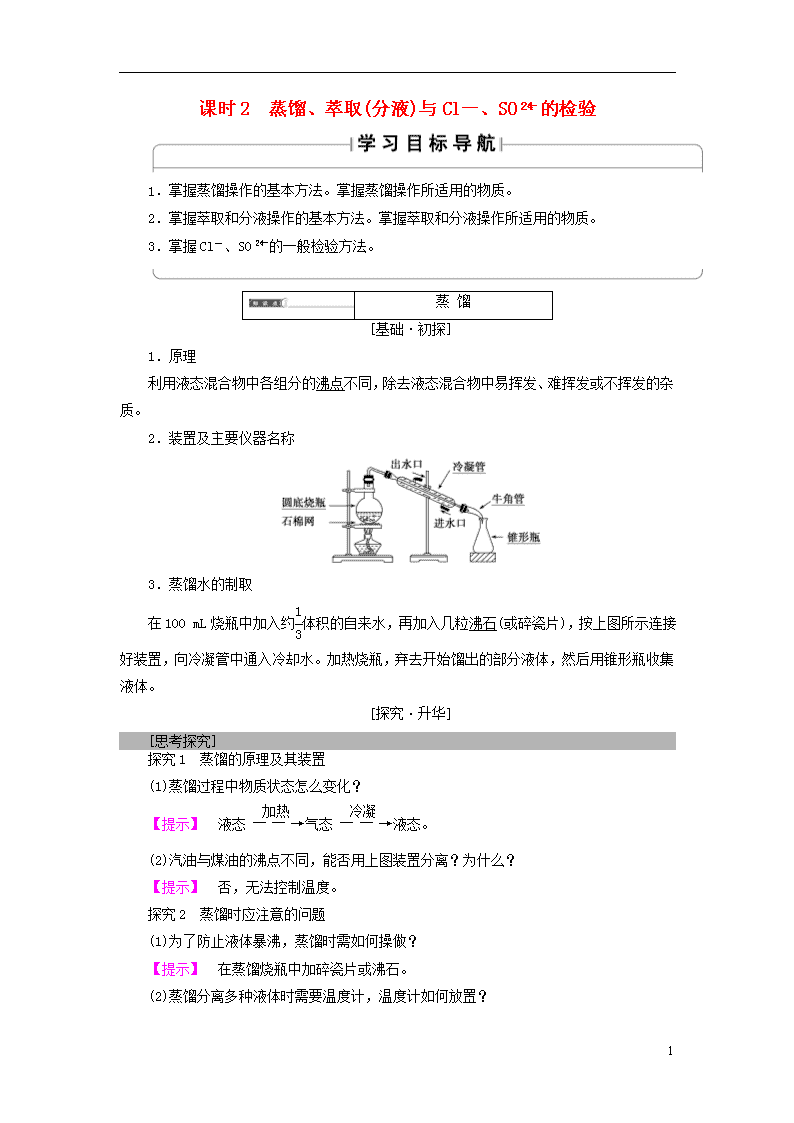
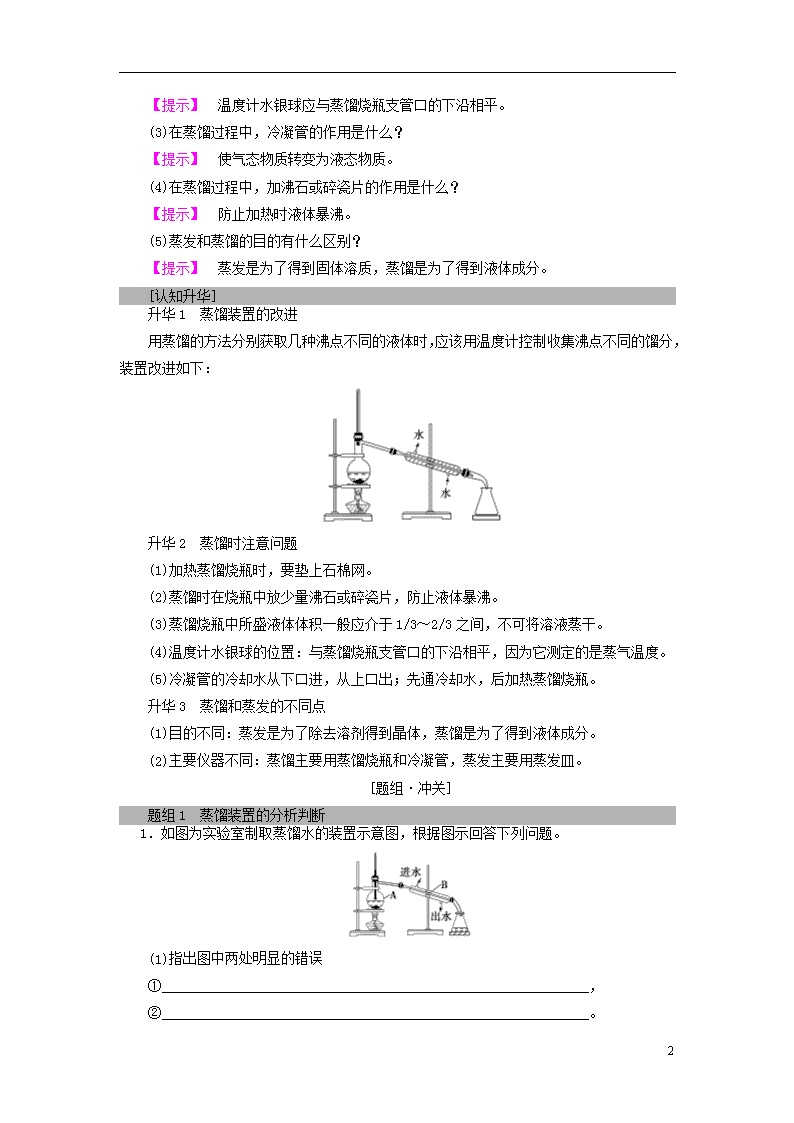
课时2 蒸馏、萃取(分液)与Cl-、SO的检验 1.掌握蒸馏操作的基本方法。掌握蒸馏操作所适用的物质。 2.掌握萃取和分液操作的基本方法。掌握萃取和分液操作所适用的物质。 3.掌握Cl-、SO的一般检验方法。 蒸 馏 [基础·初探] 1.原理 利用液态混合物中各组分的沸点不同,除去液态混合物中易挥发、难挥发或不挥发的杂质。 2.装置及主要仪器名称 3.蒸馏水的制取 在100 mL烧瓶中加入约体积的自来水,再加入几粒沸石(或碎瓷片),按上图所示连接好装置,向冷凝管中通入冷却水。加热烧瓶,弃去开始馏出的部分液体,然后用锥形瓶收集液体。 [探究·升华] [思考探究] 探究1 蒸馏的原理及其装置 (1)蒸馏过程中物质状态怎么变化? 【提示】 液态气态液态。 (2)汽油与煤油的沸点不同,能否用上图装置分离?为什么? 【提示】 否,无法控制温度。 探究2 蒸馏时应注意的问题 (1)为了防止液体暴沸,蒸馏时需如何操做? 【提示】 在蒸馏烧瓶中加碎瓷片或沸石。 (2)蒸馏分离多种液体时需要温度计,温度计如何放置? 7 【提示】 温度计水银球应与蒸馏烧瓶支管口的下沿相平。 (3)在蒸馏过程中,冷凝管的作用是什么? 【提示】 使气态物质转变为液态物质。 (4)在蒸馏过程中,加沸石或碎瓷片的作用是什么? 【提示】 防止加热时液体暴沸。 (5)蒸发和蒸馏的目的有什么区别? 【提示】 蒸发是为了得到固体溶质,蒸馏是为了得到液体成分。 [认知升华] 升华1 蒸馏装置的改进 用蒸馏的方法分别获取几种沸点不同的液体时,应该用温度计控制收集沸点不同的馏分,装置改进如下: 升华2 蒸馏时注意问题 (1)加热蒸馏烧瓶时,要垫上石棉网。 (2)蒸馏时在烧瓶中放少量沸石或碎瓷片,防止液体暴沸。 (3)蒸馏烧瓶中所盛液体体积一般应介于1/3~2/3之间,不可将溶液蒸干。 (4)温度计水银球的位置:与蒸馏烧瓶支管口的下沿相平,因为它测定的是蒸气温度。 (5)冷凝管的冷却水从下口进,从上口出;先通冷却水,后加热蒸馏烧瓶。 升华3 蒸馏和蒸发的不同点 (1)目的不同:蒸发是为了除去溶剂得到晶体,蒸馏是为了得到液体成分。 (2)主要仪器不同:蒸馏主要用蒸馏烧瓶和冷凝管,蒸发主要用蒸发皿。 [题组·冲关] 题组1 蒸馏装置的分析判断 1.如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。 (1)指出图中两处明显的错误 ①_____________________________________________________________, ②_____________________________________________________________。 7 (2)A仪器的名称是________,B仪器的名称是________。 (3)实验时A中除加入少量自来水外,还需加入少量________,其作用是防止加热时液体暴沸。 【解析】 对于蒸馏的实验装置,最重要的问题有:a.仪器的连接顺序,b.温度计的位置,c.冷却水的流向(进出口),d.防暴沸的措施。 【答案】 (1)①温度计水银球位置应处于蒸馏烧瓶支管口处 ②冷却水进出口反了 (2)蒸馏烧瓶 冷凝管 (3)沸石(或碎瓷片) 题组2 蒸馏应注意的问题及判断 2.下列对蒸馏实验操作的叙述正确的是( ) A.应使温度计的水银球靠近蒸馏烧瓶支管口处 B.加入碎瓷片的目的是防止加热时蒸馏烧瓶剧烈跳动 C.冷却水的方向应上进下出,这样水流比较畅通,冷却效果更好 D.当蒸馏到烧瓶内剩有少量液体时,停止加热,用余热蒸干,不能直接加热蒸干 【解析】 蒸馏时温度计水银球放在蒸馏烧瓶支管口处是为了准确掌握馏出气体的温度,A项正确;加入碎瓷片是为了防止过热时液体因暴沸而剧烈跳动,B项不正确;冷却水的方向应下进上出,C项不正确;任何时候都不能将蒸馏烧瓶中液体蒸干,D项不正确。 【答案】 A 3.下列混合物可采用蒸馏法分离的一组是( ) A.水和四氯化碳 B.溴的四氯化碳溶液 C.硝酸钾与氯化钾 D.食盐与泥沙 【解析】 蒸馏法分离液体混合物的要求是各互溶成分的沸点有较大的差别。 【答案】 B 萃 取 和 分 液 [基础·初探] 1.萃取 (1)利用物质在互不相溶的溶剂里溶解度的不同,用一种溶剂把物质从它与另一种溶剂所组成的溶液里提取出来的方法。 (2)从溶液中提取溶质的溶剂称为萃取剂。 2.分液 (1)把两种互不相溶、密度也不相同的液体分离开的操作。一般分液都是与萃取配合进行的。 (2)主要仪器:分液漏斗和烧杯。 7 [探究·升华] [思考探究] 用CCl4萃取碘水中的I2并且分液 (1)查漏:分液漏斗使用前必须查漏。 (2)装液方法:用量筒量取10 mL碘的饱和水溶液,倒入分液漏斗中, 然后再注入4 mL CCl4,盖好玻璃塞。 现象:液体分层,有色层在上层。 (3)振荡方法:用右手压住分液漏斗口部,左手握住活塞部分,把 分液漏斗倒转过来振荡,使两种液体充分混合。 (4)静置方法:将分液漏斗放在铁架台上,静置。 现象:液体分层,上层:无色,下层:紫红色。 (5)分液方法:将分液漏斗颈上的玻璃塞打开(或使塞上的凹槽或小孔对准漏斗上的小孔),再将分液漏斗下面的活塞拧开,使下层液体慢慢沿烧杯壁流下;上层液体从分液漏斗上口倒出。 [认知升华] 升华1 萃取剂的选择 (1)与另一种溶剂互不相溶。 (2)与被萃取的物质不发生反应。 (3)溶质在萃取剂中的溶解度远大于它在原溶剂中的溶解度。 升华2 分液操作的注意事项 (1)振荡:要不时旋开活塞放气,以防止分液漏斗内部压强过大引起危险。 (2)分液: ①分液漏斗下端要紧靠烧杯内壁,有利于液体流出,同时防止液体溅出。 ②分液时要打开玻璃塞(或使塞上的凹槽或小孔对准漏斗上的小孔),保证内外大气压强相等,有利于液体流出。 ③旋开下端活塞,用烧杯接收下层液体时,要注意待下层液体恰好流完时及时关闭活塞,不能让上层液体流出,上层液体应从上口倒出。 [题组·冲关] 题组1 萃取分液操作分析判断 1.用四氯化碳萃取碘的饱和水溶液中的碘,下列说法中不正确的是( ) 7 A.实验使用的主要仪器是分液漏斗 B.碘在四氯化碳中的溶解度比在水中的溶解度大 C.碘的四氯化碳溶液呈紫红色 D.萃取碘的饱和水溶液可用酒精代替CCl4 【解析】 酒精与水互溶,不可代替CCl4。 【答案】 D 2.在使用分液漏斗进行分液时,正确的操作是( ) A.上层液体经漏斗下口放出 B.分离液体时,将漏斗拿在手上进行分离 C.分离液体时,分液漏斗口上的小孔与大气相通时打开活塞 D.分液漏斗中盛装的是液体,振荡后不必扭开活塞把气体放出 【解析】 为确保分离效果,下层液体由漏斗下口放出,上层液体要经漏斗上口倒出;分离液体时,分液漏斗要固定在铁架台的铁圈上;分液时,磨口塞上的凹槽与漏斗口上的小孔要对准,这时漏斗内外的空气相通,压强相等,漏斗内的液体自然流下;振荡后由于溶液体积要发生变化,需旋开活塞放气。 【答案】 C 题组2 常见分离方法的选择 3.已知Br2易溶于有机溶剂(如CCl4等)而微溶于水,且易挥发。欲从溴水中提取溴单质,应进行的操作是( ) A.萃取 B.蒸馏 C.先萃取分液,后进行蒸馏 D.先萃取分液,后进行蒸发 【解析】 先利用萃取分液从溴水中提取Br2,得到Br2的CCl4溶液,再利用Br2易挥发,利用蒸馏法提取Br2。 【答案】 C 4.将下列分离物质的实例与所选择的分离方法连线。 7 【答案】 (1)-D (2)-C (3)-A (4)-B Cl-、SO的 检 验 [基础·初探] 1.Cl-的一般检验 (1)试剂:AgNO3溶液和稀硝酸。 2.SO的检验 [探究·升华] [思考探究] 有下列实验方案: 方案1:某溶液产生白色沉淀―→结论:溶液中含有SO 方案2:某溶液产生白色沉淀―→结论:溶液中含有SO 方案3:某溶液产生白色沉淀白色沉淀不溶解―→结论:溶液中含有SO 方案4:某溶液无现象产生白色沉淀―→结论:溶液中含有SO 方案5:某溶液产生白色沉淀―→结论:溶液中含有Cl- 问题思考: (1)上述5个方案中正确的是哪个方案? 【提示】 方案4正确。 (2)上述方案中不正确的有哪些方案?分析原因。 【提示】 方案1不正确,因为CO、Ag+等干扰SO检验; 方案2不正确,因为Ag+干扰SO检验; 7 方案3不正确,因为Ag+干扰SO检验; 方案5不正确,因为CO干扰Cl-检验。 [认知升华] 常见离子的检验 离子 操作、现象及结论 H+ 向待测液中加入紫色石蕊试液,溶液变红,证明溶液显酸性,有H+ OH- 向待测液中加入酚酞试液,溶液变红,证明溶液显碱性,有OH- CO 向待测液中加入盐酸,产生无色无味气体,气体通入澄清石灰水中产生白色沉淀,证明有CO或HCO SO 向待测液中加入稀盐酸,无沉淀生成,然后加入几滴BaCl2溶液,有白色沉淀产生,证明有SO Cl- 向待测液中加入几滴稀硝酸,然后加入几滴AgNO3溶液,有白色沉淀产生,证明有Cl- [题组·冲关] 1.下列对实验过程的评价正确的是( ) A.某固体中加入稀盐酸,产生了无色气体,证明该固体一定是CaCO3 B.某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含SO C.某无色溶液中滴入无色酚酞显红色,该溶液一定显碱性 D.验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加AgNO3溶液,有白色沉淀出现,证明含Cl- 【解析】 A项,Na2CO3、K2CO3等物质也可与稀盐酸反应产生无色气体CO2;B项,溶液中也可能含有Ag+;D项,加入稀盐酸时,引入了Cl-。 【答案】 C 2.某溶液中含有较大量的Cl-、CO、OH-3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( ) ①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液 A.①②④②③ B.④②①②③ C.①②③②④ D.④②③②① 【解析】 因Ag+与Cl-、CO、OH-均可生成沉淀,Mg2+与CO、OH-均可生成沉淀,Ba2+只与CO生成沉淀,故试剂的加入顺序为④①③。 【答案】 B 7查看更多