- 2021-04-16 发布 |
- 37.5 KB |
- 23页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
河南省商丘市第一高级中学2019-2020学年高二下学期期中考试化学试题 Word版含解析
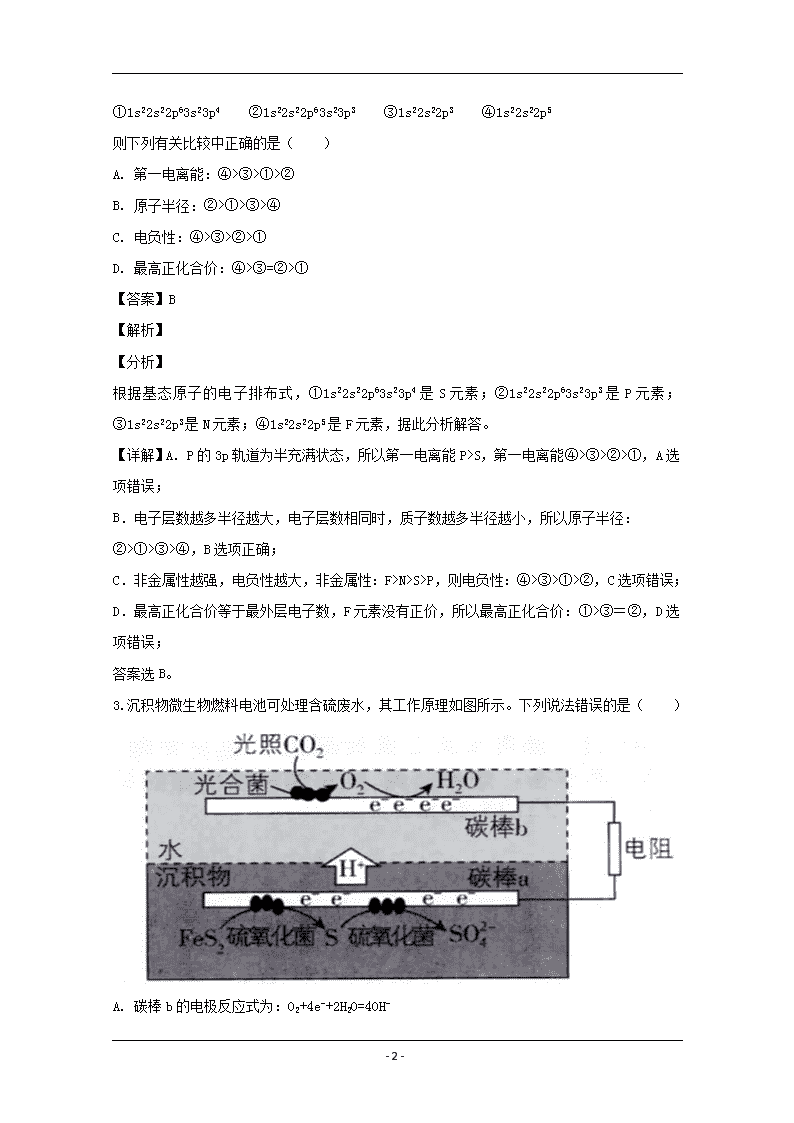
www.ks5u.com 商丘市第一高级中学2019-2020高二下学期期中考试 化学试卷 注意事项: 1.本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分; 2.答题前,考生务必将自己的姓名、学号填写在答题卡上。选择题使用2B铅笔填涂在答题卡上,非选择题部分使用0.5毫米的签字笔完成;考试结束后,只交答题卡,试卷考生保存。 用到的相对原子质量:H-1 C-12 O-16 Mg-24 Al-27 S-32 Cl-35.5 第I卷(共54分) 一、选择题(每小题只有一个正确答案,每小题3分) 1.下列对古文献内容理解错误的是( ) A. 《本草纲目》“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也”。这里所用的“法”是指蒸发 B. 《抱朴子·金丹篇》记载:“丹砂烧之成水银,积变又还成丹砂”。该过程发生了氧化还原反应 C. 《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之”。“瓦”,传统无机非金属材料,主要成分为硅酸盐 D. 《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了焰色反应 【答案】A 【解析】 【详解】A.“烧酒”利用的是蒸馏原理,这里所用的“法”是指蒸馏,A选项错误; B.丹砂的主要成分是HgS,高温分解生成Hg和S,积变后二者化合又变为丹砂,因此发生了氧化还原反应,B选项正确; C.“瓦”的主要成分为硅酸盐,属于传统无机非金属材料,C选项正确; D.钾元素的焰色反应显紫色,钠元素的焰色反应为黄色,故焰色反应可用于鉴别硝石(KNO3)和朴硝(Na2SO4),D选项正确。 答案选A。 【点睛】本题主要考查的是元素化合物的性质,题目的情景设计较新颖,予化学知识于古文字中,注意古文的理解和化学物质性质的分析判断。 2.现有四种元素的基态原子的电子排布式如下: - 23 - ①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5 则下列有关比较中正确的是( ) A. 第一电离能:④>③>①>② B. 原子半径:②>①>③>④ C. 电负性:④>③>②>① D. 最高正化合价:④>③=②>① 【答案】B 【解析】 【分析】 根据基态原子的电子排布式,①1s22s22p63s23p4是S元素;②1s22s22p63s23p3是P元素;③1s22s22p3是N元素;④1s22s22p5是F元素,据此分析解答。 【详解】A.P的3p轨道为半充满状态,所以第一电离能P>S,第一电离能④>③>②>①,A选项错误; B.电子层数越多半径越大,电子层数相同时,质子数越多半径越小,所以原子半径:②>①>③>④,B选项正确; C.非金属性越强,电负性越大,非金属性:F>N>S>P,则电负性:④>③>①>②,C选项错误; D.最高正化合价等于最外层电子数,F元素没有正价,所以最高正化合价:①>③=②,D选项错误; 答案选B。 3.沉积物微生物燃料电池可处理含硫废水,其工作原理如图所示。下列说法错误的是( ) A. 碳棒b的电极反应式为:O2+4e-+2H2O=4OH- - 23 - B. 光照强度对电池的输出功率有影响 C. 外电路的电子方向:碳棒a→碳棒b D. 酸性增强不利于菌落存活,故工作一段时间后,电池效率降低 【答案】A 【解析】 【分析】 由图可知,H+向b极移动,原电池中阳离子向正极移动,因此碳棒a失去电子,作负极,碳棒b得到电子作正极,据此分析解答问题。 【详解】A.碳棒b作正极,电极上O2得电子生成水,电极方程式为:O2+4e-+4H+=2H2O,A选项错误; B.碳棒b,CO2在光照和光合菌的作用下反应生成氧气,光照强度对电池的输出功率有影响,B选项正确; C.外电路电子由负极流向正极,即碳棒a→碳棒b,C选项正确; D.电池工作一段时间后,电解质溶液酸性增强,酸性增强会使菌落失活,故工作一段时间后,电池效率降低,D选项正确; 答案选A。 4.下列实验结论正确的是( ) 实验操作 现象 结论 A 淀粉溶液中加入碘水 溶液变蓝 说明淀粉没有水解 B 将乙醇与酸性重铬酸钾(K2Cr2O7)溶液混合 橙色溶液变为绿色 乙醇具有还原性 C 蔗糖溶液中加入稀硫酸,水解后加入银氨溶液,水浴加热 未出现银镜 水解的产物为非还原性糖 D 将新制Cu(OH)2与葡萄糖溶液混合加热 产生红色沉淀(Cu2O) 葡萄糖具有氧化性 A. A B. B C. C D. D 【答案】B - 23 - 【解析】 【详解】A.淀粉溶液中加入碘水,溶液变蓝,说明溶液中还存在淀粉,淀粉可能部分水解,不能说明淀粉没有水解,故A错误; B.乙醇具有还原性,能被橙色的酸性重铬酸钾溶液氧化生成绿色的Cr3+,故B正确; C.蔗糖溶液中加入稀硫酸水解后溶液呈酸性,在酸性条件下,葡萄糖与银氨溶液不能发生银镜反应,故C错误; D.葡萄糖与新制Cu(OH)2反应生成砖红色沉淀氧化亚铜,表现了葡萄糖的还原性,故D错误; 答案选B。 5.设NA为阿伏加德罗常数的值,下列说法正确的是( ) A. 7g14C中,含有3NA个中子 B. 3.2gCu与足量浓硝酸反应,生成的气体在标准状况下的体积为22.4L C. 25℃时,pH=4的CH3COOH溶液中H+的数目为10-4NA D. 标准状况下,5.6L丙烷中含有共价键的数目为2.5NA 【答案】D 【解析】 【详解】A.1个14C中含有8个中子,7g14C即0.5mol,含有中子数目为4NA,A选项错误; B.3.2gCu即0.05mol,与足量浓硝酸反应生成NO2气体,化学计量关系为:Cu—2NO2可知n(NO2)=0.1mol,但标况下NO2不气体,无法确定其体积,B选项错误; C.溶液的体积未知,所以无法计算相关微粒的个数,C选项错误; D.标况下,5.6L丙烷为0.25mol,一个丙烷分子含有10个共价键,0.25mol丙烷中含有2.5NA个共价键,D选项正确; 答案选D。 【点睛】易错点为C选项,pH值代表溶液中氢离子的浓度,要计算微粒数目必须要计算物质的量,题中没有给出体积,不能计算物质的量,也就无法计算微粒数目,另外,B选项中NO2在标况下不是气体也需要注意。 6.下列各反应对应的离子方程式正确的是( ) A. 向Ca(OH)2溶液中加入少量的NaHCO3溶液:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O B. 向100mL0.12mol·L-1的Ba(OH)2溶液中通入0.02molCO2:Ba2++3OH-+2CO2=HCO3-+BaCO3↓+H2O C. 硫酸氢钠与氢氧化钡溶液反应后pH恰好为7:H++SO42-+Ba2++OH-=BaSO4↓+H2O - 23 - D. 向含0.1molNaOH和0.1molNa2CO3的溶液中加入1L0.4mol·L-1稀盐酸:OH-+CO32-+3H+=CO2↑+2H2O 【答案】D 【解析】 【详解】A.根据定少为一的原则,将NaHCO3的系数定为1,则向Ca(OH)2溶液中加入少量的NaHCO3溶液,离子反应方程式应为:Ca2++OH-+HCO3-=CaCO3↓+H2O,A选项错误; B.先算出Ba(OH)2的物质的量为0.012mol,而CO2的物质的量为0.02mol,二者的物质的量为3:5,按照3:5的化学计量比来写方程式:3Ba2++6OH-+5CO2=4HCO3-+BaCO3↓+H2O,B选项错误; C.硫酸氢钠与氢氧化钡溶液反应后pH恰好为7,因此二者按2:1的系数来反应:2H++SO42-+Ba2++OH-=BaSO4↓+2H2O,C选项错误; D.首先三者的物质的量之比为1:1:4,稀盐酸先和烧碱中和,过量的稀盐酸再和纯碱反应,据此离子反应方程式为:OH-+CO32-+3H+=CO2↑+2H2O,D选项正确; 答案选D。 【点睛】本题考查了离子方程式的书写,侧重考查反应物用量不同发生反应不同的离子反应,题目难度较大,注意反应的顺序,尤其是某一种反应物过量时的后续反应。 7.下列关于有机化合物的说法正确的是( ) A. 聚四氟乙烯的单体属于不饱和烃 B. 异丁烯及甲苯均能使溴水褪色,且褪色原理相同 C. 苯乙烯()分子的所有原子不可能在同一平面上 D. 分子式为C4H10O且属于醇类的同分异构体有4种 【答案】D 【解析】 【详解】A.聚四氟乙烯的单体是CF2=CF2,该高聚物中含F原子,不属于不饱和烃,A选项错误; B.异丁烯及甲苯均能使溴水褪色,褪色原理不相同,前者发生的是加成反应,后者发生的是萃取,是物理变化,B选项错误; C.由于苯环和碳碳双键均是平面形结构,则苯乙烯分子的所有原子可能在同一平面上,C选项错误; D.由于-C4H9有4种结构,则分子式为C4H10O属于醇的同分异构体也有4种,D选项正确。 - 23 - 答案选D。 8.A、B、C、D四种主族元素,已知A元素是地壳中含量最多元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C是第三周期元素中第一电离能最小的元素;D元素在第三周期元素中第一电离能最大。下列有关叙述错误的是( ) A. 元素D为氯元素 B. 元素A、B、C两两组合形成的化合物有CaO、CaO2、Na2O、Na2O2等 C. 元素A、D电负性的大小关系:A查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档