- 2021-04-16 发布 |
- 37.5 KB |
- 16页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
山东专用2020届高考化学二轮复习专题十二化学实验基础练习含解析
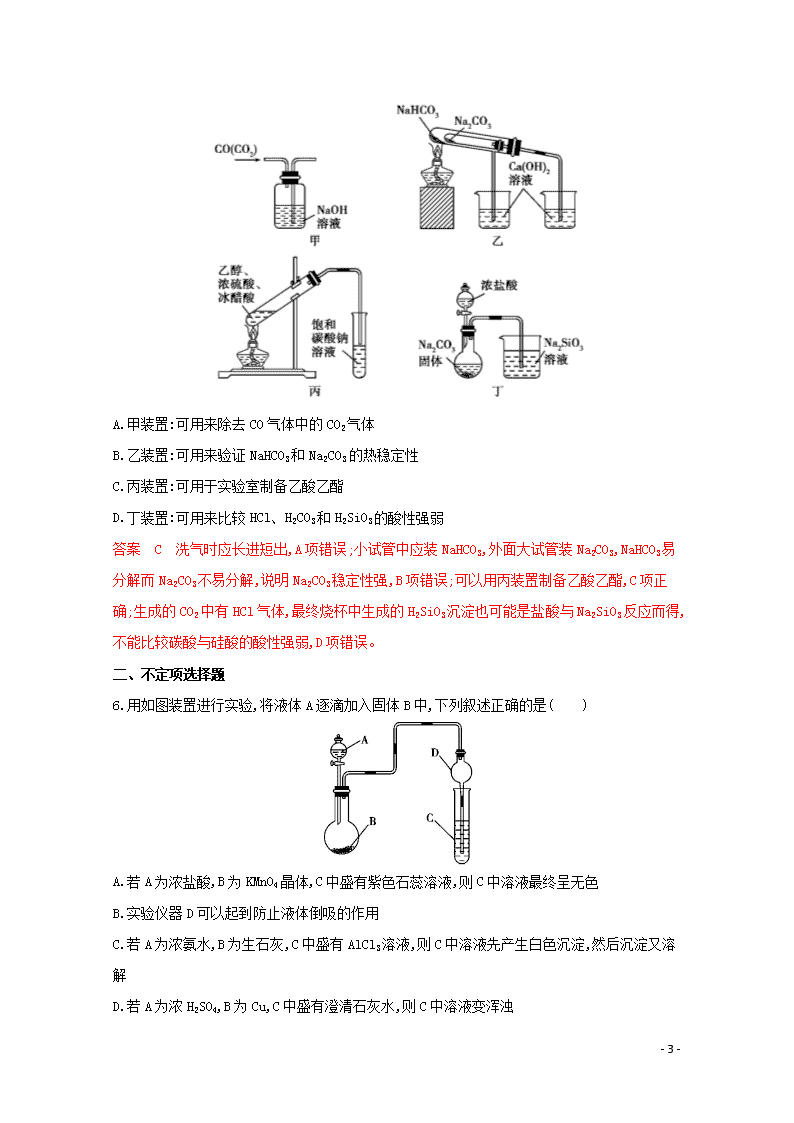
专题十二 化学实验基础 一、单项选择题 1.(2019山东聊城一模)下列实验室制取乙烯、除杂质、性质检验、收集的装置正确的是( ) 答案 C 乙醇制取乙烯需控制反应混合液的温度为170 ℃,故温度计的水银球应插入液面下,A项错误;实验室制取乙烯时会产生杂质SO2,乙烯与SO2均可以使酸性高锰酸钾溶液褪色,应用NaOH溶液除SO2杂质,B项错误;乙烯能使溴的四氯化碳溶液褪色,可检验乙烯的性质,C项正确;乙烯的密度和空气的相近,不能用排空气法收集,D项错误。 2.(2019山东济南期末)某学习小组拟探究CO2和锌粒反应是否生成CO,已知CO能与银氨溶液反应产生黑色固体。实验装置如图所示: 下列说法正确的是( ) A.实验开始时,先点燃酒精灯,后打开活塞K B.b、c、f中试剂依次为氢氧化钠溶液、浓硫酸、银氨溶液 C.装置e的作用是收集一氧化碳气体 D.用上述装置(另选试剂)可以制备氢气并探究其还原性 答案 D 探究CO2和锌粒反应是否生成CO,a装置是二氧化碳气体发生装置,生成的二氧化碳气体含有氯化氢和水蒸气,通过b中饱和碳酸氢钠溶液除去氯化氢,c中浓硫酸除去水蒸气,通过d加热使CO2 - 16 - 和锌发生反应,生成的气体通过装置e分离二氧化碳和一氧化碳,一氧化碳进入装置f中使银氨溶液产生黑色固体,验证一氧化碳的存在。实验开始时,装置内含有空气,若先点燃酒精灯,锌与空气中的O2反应生成ZnO,所以应该先打开活塞K,使CO2充满整个装置后再点燃酒精灯,A项错误。根据以上分析可知b中试剂为饱和碳酸氢钠溶液,用来除去杂质氯化氢;c中试剂为浓硫酸,用来干燥CO2气体;f中试剂为银氨溶液,验证一氧化碳的存在,B项错误。装置e的作用是分离二氧化碳与一氧化碳的混合气体,C项错误。在实验室中用稀盐酸与Zn粒反应制取氢气,反应不需要加热,因此可以使用启普发生器制取H2,然后用饱和食盐水或水除HCl杂质,用浓硫酸干燥氢气,再通过盛有CuO的干燥管来验证H2的还原性,e作安全瓶,可以防止倒吸现象的发生,氢气是可燃性气体,排放时要进行尾气处理,D项正确。 3.(2019河南开封一模)下列有关实验操作,说法正确的是( ) A.配制一定物质的量浓度的溶液时,容量瓶中有少量的水会导致溶液浓度偏低 B.用盐酸标准溶液滴定未知浓度的氨水,选用酚酞作指示剂的结果比甲基橙更准确 C.测定硫酸铜晶体中结晶水含量时,加热后的坩埚应直接放置在石棉网上冷却 D.测定中和热时,应迅速将酸、碱稀溶液在有保温措施的容器内混合、搅拌,记录最高温度 答案 D 配制一定物质的量浓度的溶液时,容量瓶中有少量的水不会干扰实验结果,故A错误;用盐酸标准溶液滴定未知浓度的氨水,滴定终点显酸性,利用酚酞作指示剂误差大,应选甲基橙作指示剂,故B错误;加热后的坩埚须在干燥器中冷却,再称量,故C错误;测定中和热实验的关键是保温工作,应迅速将酸、碱稀溶液在有保温措施的容器内混合、搅拌,记录最高温度,故D正确。 4.(2019河南平顶山一模)文献报道,H2能还原FeCl2。某学习小组设计实验探究“文献”的真实性,下列各步实验装置错误的是( ) 答案 C 氢气还原氯化亚铁生成铁、氯化氢,检验氯化氢是否存在可以确认氢气是否能还原氯化亚铁。A装置用于制备氢气;B装置用于还原氯化亚铁;C装置用于检验氯化氢,因为氯化氢极易溶于水,必须采用防倒吸装置;D装置用于干燥气体。 5.(2019山东泰安一模)某研究性学习小组讨论甲、乙、丙、丁四种实验装置的有关用法,其中正确的是( ) - 16 - A.甲装置:可用来除去CO气体中的CO2气体 B.乙装置:可用来验证NaHCO3和Na2CO3的热稳定性 C.丙装置:可用于实验室制备乙酸乙酯 D.丁装置:可用来比较HCl、H2CO3和H2SiO3的酸性强弱 答案 C 洗气时应长进短出,A项错误;小试管中应装NaHCO3,外面大试管装Na2CO3,NaHCO3易分解而Na2CO3不易分解,说明Na2CO3稳定性强,B项错误;可以用丙装置制备乙酸乙酯,C项正确;生成的CO2中有HCl气体,最终烧杯中生成的H2SiO3沉淀也可能是盐酸与Na2SiO3反应而得,不能比较碳酸与硅酸的酸性强弱,D项错误。 二、不定项选择题 6.用如图装置进行实验,将液体A逐滴加入固体B中,下列叙述正确的是( ) A.若A为浓盐酸,B为KMnO4晶体,C中盛有紫色石蕊溶液,则C中溶液最终呈无色 B.实验仪器D可以起到防止液体倒吸的作用 C.若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液先产生白色沉淀,然后沉淀又溶解 D.若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊 - 16 - 答案 AB 若A为浓盐酸,B为KMnO4晶体,二者反应生成氯气,把氯气通入紫色石蕊溶液中,氯气与水反应生成HCl和HClO,HCl使紫色石蕊溶液变红,HClO具有漂白性,使溶液褪色,C中溶液最终呈无色,A正确;球形干燥管D的中间部分较粗,盛放液体的量较多,倒吸的液体靠自身重力回落,因此可以防止液体倒吸,B正确;若A为浓氨水,B为生石灰,滴入后产生氨气,氨气溶于AlCl3溶液中反应生成氢氧化铝沉淀,但氢氧化铝不溶于弱碱,所以C中产生的白色沉淀不溶解,C错误;若A为浓H2SO4,B为Cu,反应需要加热才能发生,如果不加热,则没有二氧化硫气体产生,C中溶液无变化,D错误。 7.用如图装置制取并收集气体,对应的装置和试剂均正确的是( ) Ⅲ中收集的气体 Ⅰ中试剂a、b Ⅱ中试剂c Ⅳ中试剂d A SO2 稀硫酸与铜片 浓硫酸 NaOH溶液 B Cl2(忽略水蒸气) 浓盐酸与二氧化锰 饱和氯化钠溶液 NaOH溶液 C HBr 浓硫酸与溴化钠 浓硫酸 水 D CO 甲酸与浓硫酸 浓硫酸 酸性KMnO4溶液 答案 B Cu与稀硫酸不反应,不能制备二氧化硫,故A错误;在加热条件下,浓盐酸与二氧化锰反应可生成氯气,氯气的密度比空气的大,氯气能与NaOH溶液反应,图中装置可制备、收集氯气,且用饱和氯化钠溶液可除去浓盐酸挥发出的HCl,用NaOH溶液可吸收尾气,故B正确;浓硫酸与生成的HBr发生氧化还原反应生成Br2,不能制备HBr,故C错误;甲酸在浓硫酸的作用下反应生成CO、H2O,CO不能与酸性高锰酸钾溶液反应,且CO不能选用向上排空气法收集,故D错误。 8.由下列实验及现象不能推出相应结论的是( ) 选项 实验 现象 结论 A 向添有KIO3 溶液变蓝色 氧化性:IO3->I2 - 16 - 的食盐中加入淀粉溶液、稀盐酸及KI B 淀粉溶液在硫酸存在下加热一段时间后,再与新制的Cu(OH)2悬浊液混合,加热煮沸 无红色沉淀生成 淀粉没有水解 C 常温下,向等体积、等浓度的NaHCO3和CH3COONa溶液中分别滴加2滴酚酞 两份溶液均变红,NaHCO3溶液红色更深 常温下的水解平衡常数:Kh(CH3COO-)< Kh(HCO3-) D 常温时,用两支试管各取5 mL 0.1 mol/L酸性KMnO4溶液,分别加入0.1 mol/L和0.2 mol/L H2C2O4溶液各2 mL 两试管溶液均褪色,且加0.2 mol/L H2C2O4溶液的试管中褪色更快 其他条件不变,H2C2O4溶液的浓度越大,化学反应速率越大 答案 B 化学反应为IO3-+5I-+6H+ 3I2+3H2O,根据氧化剂的氧化性强于氧化产物的氧化性可知,氧化性:IO3->I2,A不符合题意;淀粉溶液在硫酸存在下加热一段时间后,应该加入碱中和过量硫酸并调pH至碱性,再与新制的Cu(OH)2悬浊液混合,加热煮沸,B符合题意;NaHCO3和CH3COONa溶液中存在HCO3-+H2O H2CO3+OH-,CH3COO-+H2O CH3COOH+OH-,分别滴加2滴酚酞,NaHCO3溶液红色更深,说明HCO3-水解能力更强,根据“越弱越水解”原理可知,常温下的水解平衡常数:Kh(CH3COO-)查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档