- 2021-04-16 发布 |
- 37.5 KB |
- 17页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习鲁科版第10章第30讲化学实验基础知识和技能学案
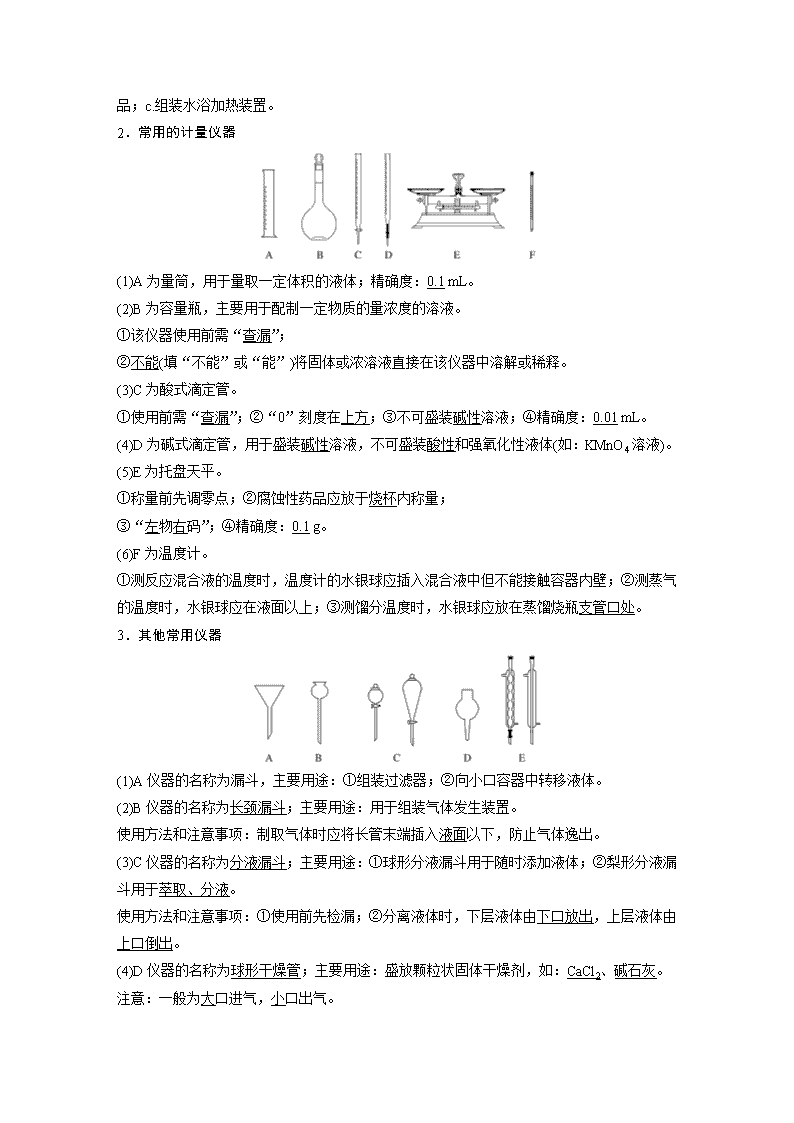
第30讲 化学实验基础知识和技能 考纲要求 1.了解化学实验是科学探究过程中的一种重要方法。2.了解化学实验常用仪器的主要用途和使用方法。3.掌握化学实验的基本操作,能识别化学品标志。了解实验室一般事故的预防和处理方法。4.掌握常见气体的实验室制法(包括所用试剂、反应原理、仪器和收集方法)。 考点一 常用化学仪器的识别与使用 1.可加热的仪器 (1)仪器②为蒸发皿。使用方法:用于蒸发或浓缩溶液,加热时液体体积不超过其容积的,蒸发浓缩时要用玻璃棒不断搅拌,有大量晶体时停止加热。 (2)仪器③为坩埚。使用方法:用于灼烧固体物质,把坩埚放在三脚架上的泥三角上加热,取放坩埚必须使用坩埚钳,加热完的坩埚应放在石棉网上冷却。 (3)仪器④中A的名称为圆底烧瓶,B的名称为蒸馏烧瓶。使用方法:a.常用于组装有液体参与反应的反应器,其中B主要用于混合液体的蒸馏和分馏;b.加热液体时,不能超过其容积的。 (4)仪器⑤为锥形瓶。使用方法:a.可用于组装气体发生器;b.用于滴定操作;c.作蒸馏装置的接收器。 (5)仪器⑥为烧杯。使用方法:a.可用于物质的溶解与稀释;b.用于称量具有腐蚀性 的固体药品;c.组装水浴加热装置。 2.常用的计量仪器 (1)A为量筒,用于量取一定体积的液体;精确度:0.1 mL。 (2)B为容量瓶,主要用于配制一定物质的量浓度的溶液。 ①该仪器使用前需“查漏”; ②不能(填“不能”或“能”)将固体或浓溶液直接在该仪器中溶解或稀释。 (3)C为酸式滴定管。 ①使用前需“查漏”;②“0”刻度在上方;③不可盛装碱性溶液;④精确度:0.01 mL。 (4)D为碱式滴定管,用于盛装碱性溶液,不可盛装酸性和强氧化性液体(如:KMnO4溶液)。 (5)E为托盘天平。 ①称量前先调零点;②腐蚀性药品应放于烧杯内称量; ③“左物右码”;④精确度:0.1 g。 (6)F为温度计。 ①测反应混合液的温度时,温度计的水银球应插入混合液中但不能接触容器内壁;②测蒸气的温度时,水银球应在液面以上;③测馏分温度时,水银球应放在蒸馏烧瓶支管口处。 3.其他常用仪器 (1)A仪器的名称为漏斗,主要用途:①组装过滤器;②向小口容器中转移液体。 (2)B仪器的名称为长颈漏斗;主要用途:用于组装气体发生装置。 使用方法和注意事项:制取气体时应将长管末端插入液面以下,防止气体逸出。 (3)C仪器的名称为分液漏斗;主要用途:①球形分液漏斗用于随时添加液体;②梨形分液漏斗用于萃取、分液。 使用方法和注意事项:①使用前先检漏;②分离液体时,下层液体由下口放出,上层液体由上口倒出。 (4)D仪器的名称为球形干燥管;主要用途:盛放颗粒状固体干燥剂,如:CaCl2、碱石灰。 注意:一般为大口进气,小口出气。 (5)E仪器的名称为冷凝管;主要用途:①用于蒸馏或分馏时冷凝易液化的气体;②用于液体回流。 使用方法和注意事项:①直形冷凝管一般用于蒸馏或分馏时冷凝;②球形冷凝管通常用于反应装置中的冷凝回流;③冷却水下口进上口出。 1.常用仪器的使用及注意事项 (1)量筒、容量瓶、锥形瓶都是不能加热的玻璃仪器( ) (2)灼烧固体时,坩埚放在铁圈或三脚架上直接加热( ) (3)在蒸馏过程中,若发现忘加沸石,应立即补加( ) (4)用托盘天平称量时,将氢氧化钠固体放在左盘的称量纸上( ) (5)滴定管的“0”刻度在上端,量筒的“0”刻度在下端( ) (6)用托盘天平称取11.7 g食盐,量取8.6 mL稀盐酸选用规格为10 mL的量筒( ) 答案 (1)× (2)× (3)× (4)× (5)× (6)√ 解析 (1)锥形瓶可以垫石棉网加热。(2)坩埚放在铁圈或三脚架上的泥三角上加热。(3)应冷却至室温后补加沸石。(4)氢氧化钠易潮解,且腐蚀纸片,应放在小烧杯中进行称量。(5)量筒没有“0”刻度。 2.玻璃棒用途 (1)过滤时,玻璃棒的作用是搅拌和引流( ) (2)溶解氢氧化钠时用玻璃棒搅拌,目的是加快溶解速度( ) (3)用浓硫酸稀释配制稀硫酸时要用玻璃棒搅拌( ) (4)配制一定物质的量浓度溶液,转移液体时要用玻璃棒引流( ) (5)用pH试纸测定溶液的pH时,用玻璃棒蘸取待测液( ) (6)粗盐提纯实验时,多次用到玻璃棒,其中蒸发结晶时要不断搅拌,以防止因受热不均匀而引起飞溅( ) 答案 (1)× (2)√ (3)√ (4)√ (5)√ (6)√ 解析 (1)过滤时不能搅拌,否则会使滤纸破裂,造成过滤操作失败。(3)浓硫酸溶于水放出大量的热,用玻璃棒搅拌的目的是及时散热并使液体混合均匀。 1.球形冷凝管不能用于组装蒸馏装置的原因是____________________________ ________________________________________________________________________。 答案 冷凝后的液体容易残留在球形区域内 2.测定已部分变质的小苏打样品中Na2CO3的质量分数方案:称取一定质量的固体样品,通过加热至恒重后冷却,称量剩余固体质量,计算。回答下列问题。 (1)下列仪器中,在灼烧固体样品时必须用到的是________________(填名称)。 (2)实验中需加热至恒重的目的是__________________________________________。 (3)实验中确定加热至恒重的方法是_______________________________________。 答案 (1)坩埚、泥三角 (2)保证NaHCO3分解完全 (3)两次称量固体的质量差不超过0.1 g时,说明已经加热至恒重 题组一 常用仪器的用途和使用 1.下列有关仪器的名称、图形、用途与使用操作的叙述均正确的是( ) 选项 A B C D 名称 250 mL容量瓶 长颈漏斗 酸式滴定管 冷凝管 图形 用途与使用操作 配制1.0 mol·L-1 NaCl溶液,定容时仰视刻度线,则配得的溶液浓度大于1.0 mol·L-1 用酒精萃取碘水中的碘,分液时,碘层需从下口放出 可用于量取10.00 mL高锰酸钾溶液 蒸馏实验中将蒸气冷凝为液体 答案 C 解析 定容时仰视刻度线,溶液体积偏大致使溶液的浓度偏低,A项错误;B项为分液漏斗且酒精不能萃取碘水中的碘,错误;高锰酸钾具有强氧化性,能腐蚀橡胶,可用酸式滴定管量取,C项正确;蒸馏实验中水从下口进上口出,D项错误。 2.(2017·全国卷Ⅰ,26改编)下图是处理铵盐产生氨气并用g吸收氨气的装置,回答下列问题: (1)b中放入少量碎瓷片的目的是__________________。f的名称是________________。 (2)玻璃管a的作用________________________________________________________, 作用原理是__________________________________________________________。 (3)e为中空双层玻璃瓶,其作用是________________________________________________。 答案 (1)防止暴沸 直形冷凝管 (2)避免b中压强过大 当b中压力过大时,a管中液面上升,使b瓶中压力稳定 (3)保温,使氨气完全蒸出 3.某学习小组按如下实验流程探究海带中碘含量的测定: 请回答仪器名称: 仪器A________,仪器B________________。 答案 坩埚 500 mL容量瓶 题组二 用途多变的广口瓶 4.回答下列问题: (1)收集气体(如图A),若用排空气法收集CO2,则应从________口进气;若瓶中装满饱和食盐水,从________口进气,收集Cl2;也可用A装置除去Cl2 中的少量HCl,则广口瓶中盛放________,应从________口进气。 答案 b a 饱和食盐水 b (2)装置E可用于贮存少量气体,若E中收集了少量H2,怎样排出H2? ________________________________________________________________________。 答案 打开止水夹,向长颈漏斗中注入适量蒸馏水 (3)图中可用于测量气体体积的是________(填装置字母,下同),用作安全瓶的是_________,接在气体连续制备的实验装置中间,用于控制气流平稳的装置是_____________________。 答案 C D B (4)用于监控气体流速(如图F),广口瓶中盛有液体,从________端通入气体,根据液体中产生气泡的速率来监控通入气体的流速。 答案 a 题组三 仪器的创新应用 5.草酸晶体(H2C2O4·2H2O)100 ℃开始失水,101.5 ℃熔化,150 ℃左右分解产生H2O、CO和CO2。用加热草酸晶体的方法获取某些气体,应该选择的气体发生装置是( ) 答案 D 解析 加热固体时,为防止水蒸气液化后倒流,试管口一般向下倾斜,但本题中考虑到草酸晶体在101.5 ℃时熔化,为了达到实验目的,需要持续加热到150 ℃左右,因此,选择装置D。 6.用如图装置(加热及夹持仪器已略去)进行的实验,下列不能达到相应实验目的的是( ) A.装置①中分液漏斗内的液体可顺利加入蒸馏烧瓶 B.装置②可实现制取CO2实验中的“即关即止,即开即用”的作用 C.利用装置③制取SO2,并验证其还原性 D.利用装置④验证KHCO3和K2CO3的热稳定性,X中应放的物质是K2CO3 答案 D 解析 ①中橡胶管能使烧瓶内与分液漏斗上部的压强相等,能使液体顺利滴下;②关闭止水夹时,产生的CO2将盐酸压入左侧,大理石与盐酸分离,反应停止,打开止水夹时,CO2 气体排出,压强减小,盐酸又流回右侧与大理石反应产生CO2;大试管中Cu与浓硫酸反应生成SO2气体,若小试管中酸性KMnO4溶液退色,则证明SO2具有还原性,C项能达到实验目的;KHCO3受热不稳定,X中应放的物质是KHCO3,D项不能达到实验目的。 题组四 干燥管的多种功能 7.(2018·福州第一中学高三月考)下列两种不同图示分别代表了干燥管的不同应用。请回答有关问题: (1)图甲所示的干燥管可作为气体干燥装置,下列组合中a和R均正确的是________(填字母)。 选项 A B C D 气体a NH3 SO2 C2H4 Cl2 固体R 碱石灰 浓硫酸 高锰酸钾 碱石灰 (2)甲装置还可以作为特殊情况下的气体发生装置。例如,在常温下可用此装置来制备空气中的某种单质气体,此时气体a为________,固体R为_______________________________。 (3)若按图乙来安装,可用NaOH浓溶液吸收Cl2,制“84”消毒液,此时干燥管的作用是________________________________________________________________________。 答案 (1)A (2)CO2 Na2O2 (3)防止倒吸 解析 (1)甲作为干燥装置,固体R必须能吸收水,且不与a发生反应。B中浓硫酸为液体干燥剂;C中的高锰酸钾不仅不易吸收水,还与乙烯反应;D中的碱石灰虽然能吸收水,但也能与Cl2反应。(2)甲作为制气装置,要求反应原理是在常温下某气体与固体反应产生气体,中学阶段熟悉的反应是二氧化碳与过氧化钠反应制取氧气。 用途广泛的干燥管 (1)位置不同,作用不同 ①在整套实验装置的中间横放——干燥、吸收及检验装置 a.干燥管内装有固体干燥剂,可用于干燥气体。 b.干燥管内盛有无水硫酸铜时,可用于水的检验。 c.可用于定量测定气体的质量。 ②在整套实验装置的最后横放——“左吸右挡” 既可以吸收多余的尾气,防止污染空气,又可以阻挡外界空气中的干扰气体(如CO2、水蒸气等)进入装置中,简记为“左吸右挡”。 (2)干燥管的创新使用 A.防倒吸装置 B.简易的过滤器,如净化天然水 C.简易的启普发生器 考点二 化学基本操作及安全 1.药品的取用 (1)根据药品的性状和用量选择取用方法 取用 药品 固体药品 液体药品 粉末 块状 一定量 少量 多量 一定量 使用 仪器 药匙(或纸槽) 镊子 用托盘天平称量 胶头 滴管 用试剂瓶倾倒 用量筒、滴定管(或移液管)量取 (2)向仪器中加入药品的操作方法 ①向容器内加固体药品 ②向容器内加液体药品 2.试纸的使用 (1)类型及作用 ——定性检验酸碱性 ——定量检测(粗测)酸碱性强弱 ——检验SO2等具有漂白性的物质 ——检验Cl2等具有氧化性的物质 (2)使用方法 ①检验溶液:取一小块试纸放在玻璃片或表面皿上,用玻璃棒蘸取液体,点在试纸中部,观察试纸的颜色变化。等pH试纸变色后,与标准比色卡对照。 ②检验气体:先用蒸馏水把试纸润湿,再用镊子夹取或粘在玻璃棒的一端,然后放在集气瓶口或导管口处,观察试纸的颜色变化。 3.物质的溶解 (1)固体物质的溶解 一般在烧杯或试管里进行,为了加速溶解,常用玻璃棒搅拌、粉碎、振荡或加热等措施,但FeCl3、AlCl3等易水解的固体溶解时不能加热。 (2)气体物质的溶解或吸收 ①溶解度不大的气体,如CO2、Cl2、H2S等,用如图a所示装置。 ②极易溶于水的气体,如NH3、HCl等,用如图b所示装置。 (3)液体物质的溶解(稀释):一般把密度较大的液体加入密度较小的液体中,如浓硫酸的稀释、浓硫酸与浓硝酸的混合。 4.化学试剂的保存方法 (1)试剂瓶及瓶塞的选择 根据药品状态 根据见光是否分解 根据酸碱性 (2)试剂的保存方法 化学试剂都应注意妥善密封保存于试剂瓶中。对于易变质、易挥发或有危险性的化学试剂,还应根据性质采取特殊的保存方法。 ①易与空气中的氧气、水蒸气、二氧化碳等起反应的药品应隔绝空气保存。如钾、钠应浸在煤油中;白磷放在水中,使之与空气隔绝。 ②易潮解、挥发、吸水的药品应密封保存。如固体NaOH、浓盐酸、浓硫酸等。 ③见光易分解的物质应放在棕色试剂瓶中,放置于阴凉处。如AgNO3、浓HNO3等。 ④液态溴有毒且易挥发,应贮存于细口瓶中,加水封,加盖玻璃塞(不能用橡胶塞),并放置于阴凉处。 ⑤易挥发、着火的药品应密封保存并放置于阴凉处,远离火源。如乙醇、乙醚、苯等。 ⑥盛放药品的器皿应不能与所盛药品反应。如盛NaOH溶液的试剂瓶不能用玻璃塞而应用橡胶塞。 5.玻璃仪器的洗涤 (1)洗净的标准:玻璃仪器内壁附着均匀的水膜,既不聚成滴,也不成股流下。 (2)常见残留物的洗涤 残留物 洗涤剂 容器里附有的油污 NaOH溶液或热的纯碱溶液 容器壁上附着的硫 CS2或热的NaOH溶液 试管壁上附着的银镜 稀HNO3 AgCl 氨水 容器内残留的MnO2 热的浓盐酸 6.常用危险化学药品的标志 7.常见实验事故的处理 意外事故 处理方法 少量浓硫酸溅到皮肤上 立即用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液 酒精等有机物在实验台上着火 用湿抹布、石棉或沙子盖灭,不能用水灭火 浓NaOH溶液溅到皮肤上 立即用大量水冲洗,再涂上5%的稀硼酸 苯酚沾到皮肤上 用酒精擦洗 误食重金属盐 服用大量牛奶或蛋清,并及时送往医院 水银洒到桌面或地面上 撒上硫粉并进行处理 1.实验室不同化学试剂的保存方法不尽相同,下表中A、B、C、D、E是一些保存药品的试剂瓶。请把下列常见试剂的序号填在各试剂瓶下面的括号内。 A B C D E ( ) ( ) ( ) ( ) ( ) ①NaOH溶液 ②浓硫酸 ③Na2CO3溶液 ④白磷 ⑤大理石 ⑥酒精 ⑦浓硝酸 ⑧锌粒 ⑨硝酸银溶液 答案 ⑤⑧ ④ ①③ ②⑥ ⑦⑨ 2.指出下列仪器使用或实验的第一步操作 (1)气体的制取与性质探究实验______________。 (2)点燃氢气或甲烷等可燃性气体________________。 (3)用淀粉碘化钾试纸检验氯气__________________。 (4)用托盘天平称量固体烧碱________________。 (5)使用时第一步操作必须检查是否漏水的常见仪器有 ________________________________________________________________________。 答案 (1)检查装置的气密性 (2)检验气体的纯度 (3)润湿 (4)调零 (5)分液漏斗、酸式滴定管、碱式滴定管、容量瓶等 3.试纸________(填“能”或“不能”)浸入溶液中;测溶液的pH时,pH试纸________(填“能”或“不能”)润湿,润湿__________(填“一定”或“不一定”)有误差。 答案 不能 不能 不一定 4.请将下列实验错误操作可能会引起的不良后果填在表格中。 实验 向试管中加锌粒 对量筒中液体读数 稀释浓H2SO4 错误操作 不良后果 答案 试管底易破裂 读数偏低 量筒内液体表面的水会飞溅或量筒会炸裂 解析 垂直放锌粒,易使试管底部破裂;仰视量筒读数,看到的刻度比实际刻度小,所以读数偏低;因为量筒的体积较小,且水的密度比浓硫酸的小,浓硫酸遇水放出大量的热,易使量筒内液体表面的水飞溅或量筒炸裂。 题组一 选择题选项判断 1.药品的存放、取用及安全 (1)氢氟酸或浓硝酸存放在带橡胶塞的棕色玻璃瓶中( ) (2)在FeCl2溶液的试剂瓶中加入少量盐酸,并加入少量铁粉( ) (3)氯水或硝酸银溶液存放在配有磨口塞的棕色玻璃瓶中( ) (4)取用放在细口瓶中的液体时,取下瓶塞倒放在桌面上,倾倒液体时,瓶上的标签对着地面( ) (5)浓硫酸溅到皮肤上时,立即用稀NaOH溶液冲洗( ) (6)酒精及其他易燃物小面积失火,应该迅速使用湿抹布扑灭;钠、钾等失火应用二氧化碳灭火器扑灭( ) 答案 (1)× (2)√ (3)√ (4)× (5)× (6)× 解析 (1)氢氟酸能腐蚀玻璃,浓硝酸腐蚀橡胶。(2)加少量盐酸抑制Fe2+水解,加少量铁粉,防止Fe2+被氧化。(6)Na、K失火时,不能用二氧化碳灭火器灭火,应用沙土盖灭。 2.化学实验基本操作中的注意事项 (1)为防止试管破裂,加热碳酸氢钠固体时,试管口应略向下倾斜( ) (2)用红色石蕊试纸检验氨气的性质时,试纸不能润湿( ) (3)长时间盛放石灰水的烧杯应先加入适量的盐酸进行洗涤( ) (4)用氢氟酸清洗做过硅酸分解实验的瓷坩埚( ) (5)蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置( ) (6)为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可( ) (7)配制500 mL 0.1 mol·L-1 NaOH溶液时,将2 g NaOH固体放入500 mL容量瓶中,加水至凹液面最低处与刻度线相切( ) 答案 (1)√ (2)× (3)√ (4)× (5)√ (6)× (7)× 解析 (3)盛放石灰水的烧杯会产生一层CaCO3,可用盐酸洗去。(7)不能在容量瓶中溶解固体且加水距刻度线1~2 cm 时,改用胶头滴管滴加水至凹液面最低处与刻度线相切。 3.实验基本操作装置图的正误判断 答案 (1)× (2)× (3)× (4)√ (5)× (6)× (7)× (8)√ 题组二 主观题中“基本操作”的规范解答训练 4.(2019·武汉调研)实验室制备无水二氯化锡的主要步骤如下: 步骤1:在圆底烧瓶中加入1.20 g碎锡箔和5 mL浓盐酸、1滴硝酸,实验装置如图所示。组装好后在95 ℃ 时回流0.5 h,待圆底烧瓶中只剩余少量锡箔为止; 步骤2:将上述反应的上清液迅速转移到仪器X中,在二氧化碳气氛保护下,蒸发浓缩,冷却结晶,过滤得到二氯化锡晶体; 步骤3:在二氯化锡晶体中加入10 mL醋酸酐,即可得无水二氯化锡,过滤; 步骤4:用少量乙醚冲洗三次,置于通风橱内,待乙醚全部挥发后得到无水二氯化锡。 回答下列问题: (1)步骤1中,圆底烧瓶中发生反应的化学方程式为 ________________________________________________________________________ ________________________________________________________________________; 冷却水从接口________(填“a”或“b”)进入。实验采取的加热方式是______________;球形冷凝管上连接装有碱石灰的干燥管的目的是 ________________________________________________________________________。 (2)步骤2中,仪器X的名称为__________;二氧化碳气氛的作用是__________________。 (3)步骤3中,醋酸酐的作用是____________________;二氯化锡晶体在进行步骤3操作前应采取的加工措施是________,该加工措施需要仪器的名称是________。 答案 (1)Sn+2HCl(浓)SnCl2+H2↑ a 95 ℃水浴加热 吸收HCl,防止HCl气体进入空气 (2)蒸发皿 防止空气中的氧气氧化Sn2+ (3)吸水 研碎 研钵 解析 (1)Sn和浓盐酸反应生成SnCl2和H2,反应的化学方程式为Sn+2HCl(浓)SnCl2+H2↑,为了充分冷却蒸气且防止温度过高的蒸气急剧冷却而炸裂冷凝管,则冷凝管中的水是逆流的,所以a是进水口、b是出水口;温度小于100 ℃时采用水浴加热的方法,所以该实验的条件是95 ℃水浴加热;浓盐酸易挥发,挥发出的HCl会污染空气,所以尾气要处理。(2)蒸发浓缩溶液的仪器是蒸发皿;Sn2+不稳定,易被空气氧化,故需要在二氧化碳气氛中进行。(3)醋酸酐能和水反应生成醋酸,则醋酸酐有吸水作用;二氯化锡的晶体表面积越大时,除去晶体中的水分越充分,所以在操作3之前必须将其研碎;研碎晶体的仪器是研钵。 5.(2018·枣庄一模)某化学兴趣小组在实验室里制备某些气体,并探究相关物质的性质,需要的仪器如下图所示,部分装置可重复选取。请回答下列问题: (1)制备并收集纯净的氨气。 ①所选装置正确的连接顺序为____________________________________ (填接口编号)。 ②简述检验氨气的操作方法__________________________________________________ ________________________________________________________________________。 (2)氯气的制备及性质实验。 ①制备装置中发生反应的离子方程式是____________________________________________ ________________________________________________________________________。 ②将纯净的氯气通入事先放入铁粉的两通硬质玻璃管中,加热制取氯化铁(极易吸水),则在玻璃管右侧需要直接连接一个________装置。若将制得的氯化铁配制成溶液,请简述操作方法________________________________________________________________________ ________________________________________________________________________。 ③可以用D装置收集并测量氯气的体积,其操作为_____________________________ ________________________________________________________________________。 答案 (1)①b(c)→i→j→k→m(→i→j)→n ②将湿润的红色石蕊试纸(或pH试纸)与气体接触,若试纸变蓝说明是氨气(其他合理答案均可) (2)①MnO2+4H++2Cl-Mn2++Cl2↑+2H2O ②干燥 将FeCl3固体溶解在少量浓盐酸中,然后加蒸馏水稀释至所需体积 ③调节两侧液面相平,读数。收集结束后,再次调节两侧液面相平并读数,两次读数差值即为所收集氯气的体积 1.(2018·海南,3)用浓硫酸配制稀硫酸时,不必要的个人安全防护用品是( ) A.实验服 B.橡胶手套 C.护目镜 D.防毒面罩 答案 D 解析 硫酸没有挥发性,稀释时不会产生有毒气体。 2.(2017·海南,5)下列危险化学品标志中表示腐蚀品的是( ) 答案 A 解析 A项图示标志是腐蚀品标志,正确;B项图示标志是指易燃固体;C项图示标志是指放射性物品;D项图示标志是指氧化剂。 3.(2018·全国卷Ⅲ,10)下列实验操作不当的是( ) A.用稀硫酸和锌粒制取H2时,加几滴CuSO4溶液以加快反应速率 B.用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择酚酞为指示剂 C.用铂丝蘸取某碱金属的盐溶液燃烧,火焰呈黄色,证明其中含有Na+ D.常压蒸馏时,加入液体的体积不超过圆底烧瓶容积的三分之二 答案 B 解析 用标准盐酸滴定NaHCO3溶液,滴定至终点时溶液呈弱酸性,应选用甲基橙作指示剂,B项错误;加几滴CuSO4溶液发生反应:Zn+Cu2+===Zn2++Cu,Zn与置换出来的Cu及稀H2SO4构成Cu—Zn原电池,加快了放出H2的速率,A项正确;黄色是钠元素的焰色,C项正确;常压蒸馏时,加入液体的体积既不能太少,也不能超过圆底烧瓶容积的三分之二,D项正确。 4.(2016·全国卷Ⅰ,10)下列实验操作能达到实验目的的是( ) A.用长颈漏斗分离出乙酸与乙醇反应的产物 B.用向上排空气法收集铜粉与稀硝酸反应产生的NO C.配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 D.将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 答案 C 解析 A项,乙酸和乙醇反应的产物为乙酸乙酯,乙酸乙酯不溶于水,分离应使用分液漏斗,错误;B项,NO能被空气中的氧气氧化,且其密度也与空气相近,故不能用向上排空气法收集NO,NO难溶于水,可用排水法收集,错误;C项,氯化铁易水解,配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释可防止其水解,正确;D项,将Cl2与HCl混合气体通过饱和食盐水可除去其中的HCl,得到的Cl2中含有水蒸气,错误。 5.(1)[2017·天津,9(1)]将称得的AgNO3配制成250 mL标准溶液,所使用的仪器除烧杯和玻璃棒外还有__________________________________________________________。 答案 250 mL(棕色)容量瓶、胶头滴管 (2)[2017·全国卷Ⅲ,26(1)]图1中仪器B的名称是_______________________________。 答案 干燥管 (3)[2014·全国卷Ⅰ,26(1)]图2中仪器B的名称是________________。 答案 (球形)冷凝管 6.[2018·全国卷Ⅰ,26(1)(2)(3)改编]醋酸亚铬[(CH3COO)2Cr·2H2O]为砖红色晶体, 难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原 为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示。回答下列问题: (1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是 ________________________________________________________________________。 仪器a的名称是________。 (2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置。打开K1、K2,关闭K3。 ①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为_____________________________ _______________________________________________。 ②同时c中有气体产生,该气体的作用是________________________________________。 (3)将三价铬还原为二价铬后,将c中溶液流入d的操作是_________________________。 答案 (1)去除水中溶解氧 分液漏斗 (2)①Zn+2Cr3+===Zn2++2Cr2+ ②排除c中空气 (3)打开K3,关闭K1和K2 解析 (1)由题给信息,(CH3COO)2Cr·2H2O在气体分析中用作O2吸收剂,说明Cr2+具有强还原性,易被O2氧化,故所用蒸馏水需经煮沸除去其中的O2,以免影响(CH3COO)2Cr·2H2O的制备。由仪器的结构特点可知,a为分液漏斗。 (2)①Zn将Cr3+还原为Cr2+,离子方程式为Zn+2Cr3+===Zn2++2Cr2+。②Zn+2H+===Zn2++H2↑,H2起到排除c中空气的作用,以防Cr2+被氧化。 (3)打开K3,关闭K1、K2,c中产生的氢气聚集在溶液上方,气体压强增大,将c中液体经长导管压入d中。查看更多