- 2021-04-16 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学第4章电化学基础第4节金属的电化学腐蚀与防护课后提能层级练新人教版选修4 2
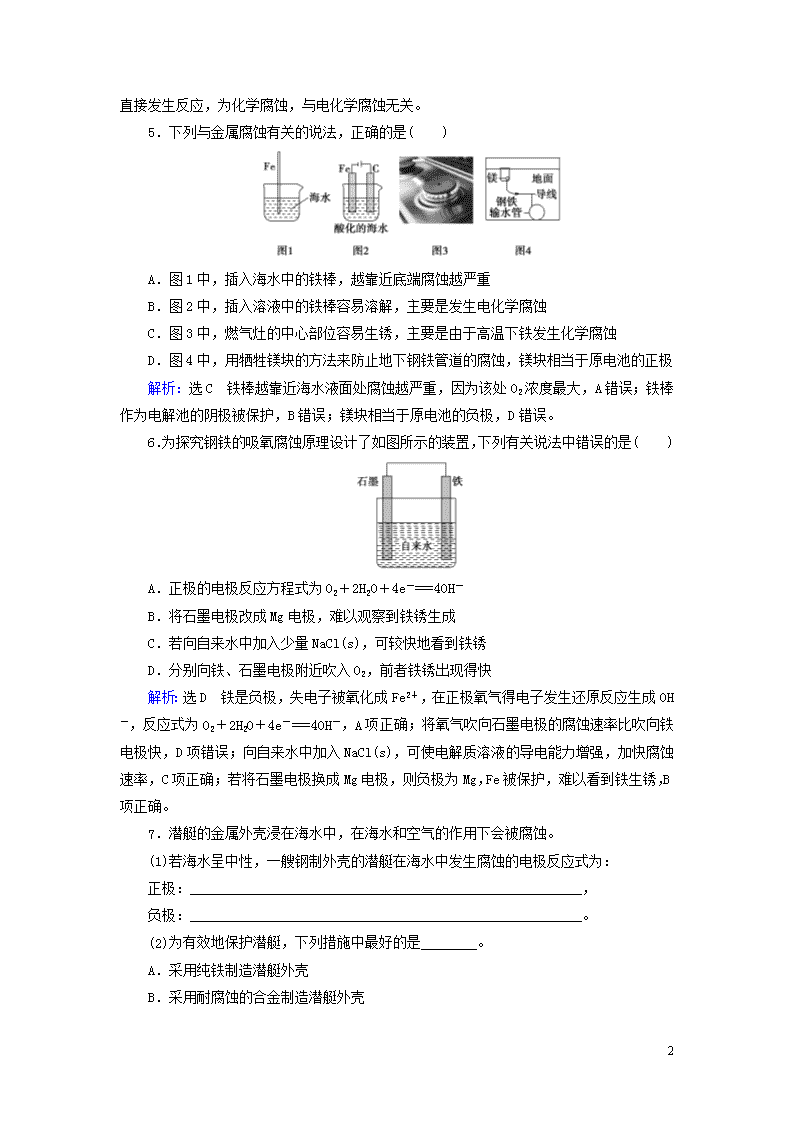
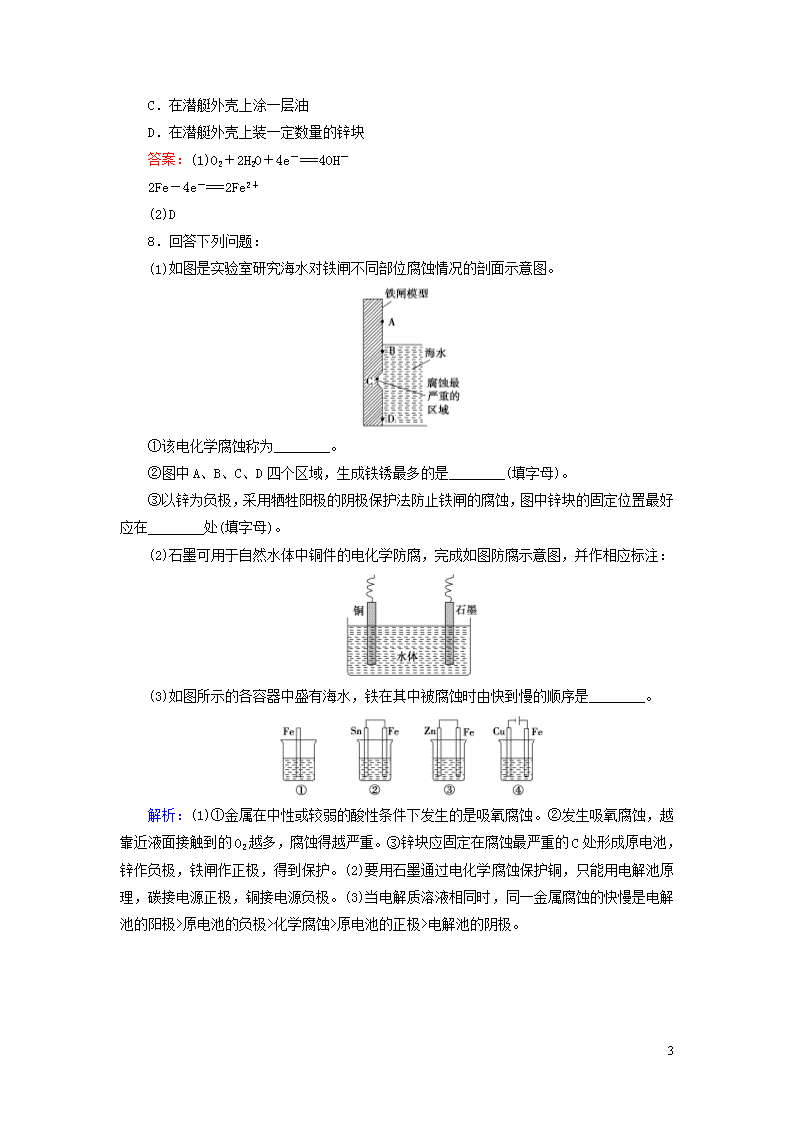
第四节 金属的电化学腐蚀与防护 课后提能 层级练 1.钢铁发生吸氧腐蚀时,正极上发生的电极反应是( ) A.2H++2e-===H2↑ B.Fe2++2e-===Fe C.2H2O+O2+4e-===4OH- D.Fe3++e-===Fe2+ 解析:选C 钢铁发生吸氧腐蚀,正极反应为2H2O+O2+4e-===4OH-。 2.下列金属防腐的措施中,使用外加电流的阴极保护法的是( ) A.水中的钢闸门连接电源的负极 B.金属护栏表面涂漆 C.汽车底盘喷涂高分子膜 D.地下钢管连接镁块 解析:选A 水中的钢闸门连接电源的负极,即使用了外加电流,A正确;金属护栏表面涂漆,是一种使用外加涂层而使金属隔绝空气和水分的保护方法,B错误;汽车底盘喷涂高分子膜,也是一种使用外加涂层而使金属隔绝空气和水分的保护方法,C错误;地下钢管连接镁块,是牺牲阳极的阴极保护法,D错误。 3.下列有关金属的保护方法的说法中正确的是( ) A.常使用的快餐杯表面有一层搪瓷,若搪瓷层破损后仍能起到防止铁生锈的作用 B.白铁(镀锌铁)镀层破损后,铁皮的腐蚀速率很慢 C.轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阴极的阳极保护法 D.钢铁制造的暖气管道外常涂有一层沥青,这是钢铁的电化学保护法 解析:选B 涂层破损后,铁直接暴露在空气中,因而搪瓷层不能对破损部分进行保护,A错误;镀层破损后由于锌的金属性比铁强,和铁构成原电池,锌作负极,保护铁不被腐蚀,B正确;应是牺牲阳极的阴极保护法,C错误;应是用沥青作涂层的涂层保护法,D错误。 4.以下现象与电化学腐蚀无关的是( ) A.镀锡铁器比镀锌铁器表面破损时更易被腐蚀 B.纯铁不容易生锈 C.镶有相邻的银牙和金牙容易引起头痛 D.输送氯气的钢管易被氯气腐蚀 解析:选D A项中镀锡铁器表面破损时形成原电池,Fe作负极,易被腐蚀,而镀锌铁器表面破损时形成原电池,Fe作正极,被保护;B项中纯铁不能形成原电池,所以不容易被腐蚀;C项中相邻的银牙和金牙容易形成原电池产生电流,使人头痛恶心;D项中铁和Cl2 9 直接发生反应,为化学腐蚀,与电化学腐蚀无关。 5.下列与金属腐蚀有关的说法,正确的是( ) A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重 B.图2中,插入溶液中的铁棒容易溶解,主要是发生电化学腐蚀 C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 解析:选C 铁棒越靠近海水液面处腐蚀越严重,因为该处O2浓度最大,A错误;铁棒作为电解池的阴极被保护,B错误;镁块相当于原电池的负极,D错误。 6.为探究钢铁的吸氧腐蚀原理设计了如图所示的装置,下列有关说法中错误的是( ) A.正极的电极反应方程式为O2+2H2O+4e-===4OH- B.将石墨电极改成Mg电极,难以观察到铁锈生成 C.若向自来水中加入少量NaCl(s),可较快地看到铁锈 D.分别向铁、石墨电极附近吹入O2,前者铁锈出现得快 解析:选D 铁是负极,失电子被氧化成Fe2+,在正极氧气得电子发生还原反应生成OH-,反应式为O2+2H2O+4e-===4OH-,A项正确;将氧气吹向石墨电极的腐蚀速率比吹向铁电极快,D项错误;向自来水中加入NaCl(s),可使电解质溶液的导电能力增强,加快腐蚀速率,C项正确;若将石墨电极换成Mg电极,则负极为Mg,Fe被保护,难以看到铁生锈,B项正确。 7.潜艇的金属外壳浸在海水中,在海水和空气的作用下会被腐蚀。 (1)若海水呈中性,一艘钢制外壳的潜艇在海水中发生腐蚀的电极反应式为: 正极:________________________________________________________, 负极:________________________________________________________。 (2)为有效地保护潜艇,下列措施中最好的是________。 A.采用纯铁制造潜艇外壳 B.采用耐腐蚀的合金制造潜艇外壳 9 C.在潜艇外壳上涂一层油 D.在潜艇外壳上装一定数量的锌块 答案:(1)O2+2H2O+4e-===4OH- 2Fe-4e-===2Fe2+ (2)D 8.回答下列问题: (1)如图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。 ①该电化学腐蚀称为________。 ②图中A、B、C、D四个区域,生成铁锈最多的是________(填字母)。 ③以锌为负极,采用牺牲阳极的阴极保护法防止铁闸的腐蚀,图中锌块的固定位置最好应在________处(填字母)。 (2)石墨可用于自然水体中铜件的电化学防腐,完成如图防腐示意图,并作相应标注: (3)如图所示的各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是________。 解析:(1)①金属在中性或较弱的酸性条件下发生的是吸氧腐蚀。②发生吸氧腐蚀,越靠近液面接触到的O2越多,腐蚀得越严重。③锌块应固定在腐蚀最严重的C处形成原电池,锌作负极,铁闸作正极,得到保护。(2)要用石墨通过电化学腐蚀保护铜,只能用电解池原理,碳接电源正极,铜接电源负极。(3)当电解质溶液相同时,同一金属腐蚀的快慢是电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极。 9 答案:(1)①吸氧腐蚀 ②B ③C(2)(3)④>②>①>③ 1.下列说法中正确的是( ) ①镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀 ②钢铁表面常易锈蚀生成Fe2O3·xH2O ③锌和铁构成原电池时,铁作负极 ④铅蓄电池中铅作负极,PbO2作正极,两极浸到稀H2SO4中 A.只有②④ B.只有①③ C.①②③ D.①②③④ 解析:选A 镀层破损后,白铁形成原电池时,因为锌比铁活泼,易失电子,从而保护了铁,而马口铁破损后,因为形成原电池时,铁比锡活泼,铁被腐蚀,所以在镀层破损后,马口铁比白铁更易被腐蚀,①说法错误;钢铁无论发生析氢腐蚀或吸氧腐蚀,铁都是失电子变成Fe2+,吸氧腐蚀更普遍,O2得电子变成OH-,与Fe2+结合生成Fe(OH)2,Fe(OH)2在空气中很易被氧化成Fe(OH)3,因此铁锈的成分常用Fe2O3·xH2O表示,②说法正确;锌和铁构成原电池时,锌比铁活泼,应该是锌作负极,③说法不正确;④说法正确,故A正确。 2.铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法不正确的是( ) A.正极的电极反应式为2H++2e-===H2↑ B.此过程中还涉及反应:4Fe(OH)2+2H2O+O2===4Fe(OH)3 C.此过程中铜并不被腐蚀 D.此过程中电子从Fe移向Cu 解析:选A 该图表示为吸氧腐蚀,其中铁铆钉为负极,电极反应式为Fe-2e-===Fe2+,铜板为正极,电极反应式为O2+4e-+2H2O===4OH-,当形成Fe(OH)2后,还有4Fe(OH)2+O2+2H2O===4Fe(OH)3这个反应,故A项错误,B、C、D项正确。 3.如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动)。下列叙述正确的是( ) 9 A.a中铁钉附近呈现红色 B.b中铁钉上发生还原反应 C.a中铜丝上发生氧化反应 D.b中铝条附近有气泡产生 解析:选B a中铁比铜活泼,铁作负极,发生氧化反应,铜作正极,发生还原反应,电极反应式分别为负极:2Fe-4e-===2Fe2+,正极:O2+2H2O+4e-===4OH-,因此A、C不正确;b中铝比铁活泼,铝作负极,发生氧化反应,铁作正极,发生还原反应,电极反应式分别为负极:4Al-12e-===4Al3+,正极:3O2+6H2O+12e-===12OH-,因此B正确,D不正确。 4.根据图示判断,下列说法正确的是( ) A.装置Ⅰ和装置Ⅱ中负极反应均是Fe-2e-===Fe2+ B.装置Ⅰ和装置Ⅱ中正极反应均是O2+2H2O+4e-===4OH- C.装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动 D.放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH均增大 解析:选D 装置Ⅰ中,由于Zn比Fe活泼,所以Zn作原电池的负极,电极反应式为Zn-2e-===Zn2+;Fe作正极,电极反应式为O2+2H2O+4e-===4OH-;由于正极有OH-生成,因此溶液的pH增大。装置Ⅱ中,Fe作负极,电极反应式为Fe-2e-===Fe2+;Cu作正极,电极反应式为2H++2e-===H2↑;由于正极不断消耗H+,所以溶液的pH逐渐增大,A、B项错误,D项正确;盐桥中的阳离子移向原电池的正极,C项错误。 5.下列与金属腐蚀有关的说法正确的是( ) 9 A.图a中,铁钉易被腐蚀 B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 解析:选B 图a中铁钉与溶液不接触,不能形成原电池,因此不易被腐蚀,A错误;图b中开关置于M时,Cu-Zn合金作负极,由M改置于N时,Cu-Zn合金作正极,腐蚀速率减小,B正确;图c中接通开关时Zn作负极,腐蚀速率增大,但氢气在Pt极上放出,C错误;NH水解使溶液显酸性,Zn在酸性条件下被腐蚀,主要由Zn的还原作用引起,而不是MnO2的氧化作用引起的,D错误。 6.将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘处少。下列说法正确的是( ) A.液滴中的Cl-由a区向b区迁移 B.液滴边缘是正极区,发生的电极反应式为O2+2H2O+4e-===4OH- C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应式为Cu-2e-===Cu2+ 解析:选B 液滴边缘O2多,在碳粒上发生正极反应:O2+2H2O+4e-===4OH-。液滴下的Fe发生负极反应:Fe-2e-===Fe2+,为腐蚀区(a),B选项正确;阴离子应移向负极,即Cl-由b区向a区迁移,A选项错误;液滴下的Fe因发生氧化反应而被腐蚀,C选项错误;铜螺丝钉在铁板上,Cu不如铁活泼,作正极,负极反应为Fe-2e-===Fe2+,D选项错误。 7.钢铁工业是国家工业的基础。请回答钢铁腐蚀、防护过程中的有关问题。 9 (1)生产中可用盐酸来除铁锈,现将一生锈的铁片放入盐酸中,当铁锈被除尽后,发生的化合反应的化学方程式为________________________。 (2)下列哪个装置可防止铁棒被腐蚀________。 (3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置如图所示: 请回答: ①A电极对应的金属是________(写元素符号),B电极的电极反应是______________________。 ②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为________ mol。 ③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因__________________________________________________。 解析:(1)铁锈的主要成分是Fe2O3,Fe2O3和盐酸反应生成Fe3+,2FeCl3+Fe===3FeCl2。 (2)B项是牺牲阳极(Zn)的阴极(Fe)保护法,D是外加电流的阴极(Fe)保护法。 (3)①电镀的特点是:待镀金属作阴极,镀层金属作阳极,则A为阳极应是铜,B为阴极,电极反应为Cu2++2e-===Cu。 ②两极质量差为5.12 g,则每极变化质量为=2.56 g,转移电子的物质的量为×2=0.08 mol。 ③镀层破损后易形成原电池,铁比铜活泼,铁作负极更易被腐蚀。 答案:(1)2FeCl3+Fe===3FeCl2 (2)BD (3)①Cu Cu2++2e-===Cu ②0.08 9 ③铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀(其他合理答案也可) 8.如图所示是某研究性学习小组探究金属腐蚀条件的实验装置图,试分析实验并回答下列问题: (1)若起始时甲、乙、丙三套装置的导管中液面高度相同,过一段时间后液面最高的是________。铁粉腐蚀的速率由大到小的排列顺序为(用甲、乙、丙填写)________。 (2)通过甲、乙装置的对比说明钢铁中碳的含量越________(填“高”或“低”)越易腐蚀。 (3)乙装置中发生电化学腐蚀时正极的电极反应式为_________________。 (4)针对乙、丙装置研究的结果分析,可采用何种防护措施来减缓金属的腐蚀:____________________________(写出一点即可)。 解析:铁粉、炭粉—食盐水构成原电池,发生吸氧腐蚀,故乙中液面最高;甲中铁粉中的少量碳也能发生吸氧腐蚀,但由于C的含量少,故不如乙中Fe腐蚀得快,丙中乙醇为非电解质,铁粉、炭粉形不成原电池,Fe受到保护,故可把钢铁放在油脂或有机溶剂中进行防护。 答案:(1)乙 乙>甲>丙(2)高(3)2H2O+O2+4e-===4OH-(4)将金属放在油脂或有机溶剂中 9.某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。 (1)请完成以下实验设计表(表中不要留空格): 编号 实验目的 炭粉/g 铁粉/g 醋酸/% ① 为以下实验作参照 0.5 2.0 90.0 ② 醋酸浓度的影响 0.5 36.0 ③ 0.2 2.0 90.0 (2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了________腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,炭粉表面发生了________(填“氧化”或“还原”)反应,其电极反应式是____________________。 9 (3)该小组对图2中0~t1时压强变大的原因提出了如下假设,请你完成假设二: 假设一:发生析氢腐蚀产生了气体; 假设二:__________________________。 解析:(1)探究醋酸浓度对电化学腐蚀的影响时,应保证炭粉和铁粉的质量与参照实验相同,因此实验②中铁粉为2.0 g;对比实验①和③可知,铁粉的质量及醋酸的浓度相同,而炭粉的质量不同,显然探究的是炭粉的含量对铁的电化学腐蚀的影响。 (2)当铁发生析氢腐蚀时,由于生成H2,容器的压强不断增大,而发生吸氧腐蚀时,由于消耗O2,容器的压强不断减小,t2时容器的压强明显小于起始压强,说明铁发生了吸氧腐蚀,此时Fe作负极,失去电子发生氧化反应;炭粉作正极,O2在其表面得到电子发生还原反应,电极反应式为O2+2H2O+4e-===4OH-。 (3)Fe发生电化学腐蚀时,放出热量,使体系的温度升高。 答案:(1)②2.0 ③炭粉含量的影响 (2)吸氧 还原 2H2O+O2+4e-===4OH- (3)反应放热,温度升高 9查看更多