- 2021-04-16 发布 |
- 37.5 KB |
- 42页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
广西专用2020版高考化学二轮复习专题1第6讲电化学基础课件
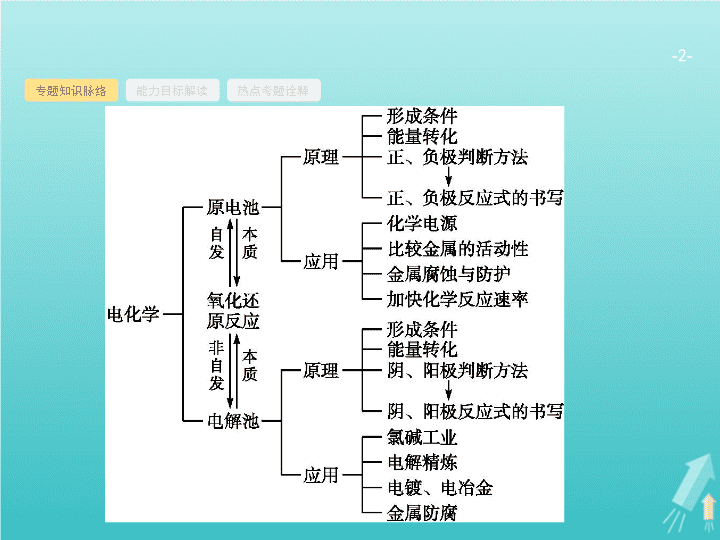
第 6 讲 电化学基础 - 2 - 专题知识脉络 能力目标解读 热点考题诠释 - 3 - 专题知识脉络 能力目标解读 热点考题诠释 - 4 - 专题知识脉络 能力目标解读 热点考题诠释 1 .(2019 全国 Ⅰ ) 利用生物燃料电池原理研究室温下氨的合成 , 电池工作时 MV 2+ /MV + 在电极与酶之间传递电子 , 示意图如下所示。下列说法错误的是 ( ) A. 相比现有工业合成氨 , 该方法条件温和 , 同时还可提供电能 B. 阴极区 , 在氢化酶作用下发生反应 H 2 +2MV 2+ 2H + +2MV + C. 正极区 , 固氮酶为催化剂 ,N 2 发生还原反应生成 NH 3 D. 电池工作时质子通过交换膜由负极区向正极区移动 B - 5 - 专题知识脉络 能力目标解读 热点考题诠释 解题要领 该过程是在室温条件下进行的 , 因此比现有工业合成氨的条件温和 , 同时还能提供电能 ,A 项正确 ; 阴极区发生的是得电子的反应 , 而左池中发生的是失电子的反应 ,B 项错误 ; 右池为正极区 , 氮气发生还原反应生成氨气 ,C 项正确 ; 左池中产生的氢离子通过交换膜向右池移动 , 即由负极区移向正极区 ,D 项正确。 - 6 - 专题知识脉络 能力目标解读 热点考题诠释 2 .(2018 全国 Ⅰ ) 最近我国科学家设计了一种 CO 2 +H 2 S 协同转化装置 , 实现对天然气中 CO 2 和 H 2 S 的高效去除。示意图如下所示 , 其中电极分别为 ZnO@ 石墨烯 ( 石墨烯包裹的 ZnO) 和石墨烯 , 石墨烯电极区发生反应为 : - 7 - 专题知识脉络 能力目标解读 热点考题诠释 该装置工作时 , 下列叙述错误的是 ( ) A. 阴极的电极反应 :CO 2 +2H + +2e - CO+H 2 O B. 协同转化总反应 :CO 2 +H 2 S CO+H 2 O+S C. 石墨烯上的电势比 ZnO@ 石墨烯上的低 D. 若采用 Fe 3+ /Fe 2+ 取代 EDTA-Fe 3+ /EDTA-Fe 2+ , 溶液需为酸性 C - 8 - 专题知识脉络 能力目标解读 热点考题诠释 3 .(2017 全国 Ⅰ ) 支撑海港码头基础的钢管桩 , 常用外加电流的阴极保护法进行防腐 , 工作原理如图所示 , 其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是 ( ) A. 通入保护电流使钢管桩表面腐蚀电流接近于零 B. 通电后外电路电子被强制从高硅铸铁流向钢管桩 C. 高硅铸铁的作用是作为损耗阳极材料和传递电流 D. 通入的保护电流应该根据环境条件变化进行调整 C 解题要领 外加电流的阴极保护法 , 使被保护的钢管桩上无腐蚀电流 ,A 项正确 ; 通电后 , 高硅铸铁为惰性阳极 , 钢管桩为阴极 , 外电路电子从阳极流向阴极 ,B 项正确 ; 由于高硅铸铁为惰性阳极 , 因此应是海水中的 OH - 失电子 ,2H 2 O-4e - O 2 ↑+4H + , 因此阳极材料不被损耗 ,C 项错误 ; 在外加电流的阴极保护法中 , 应依据环境条件变化调整电流大小。 - 9 - 专题知识脉络 能力目标解读 热点考题诠释 4 .(2017 全国 Ⅱ ) 用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜 , 电解质溶液一般为 H 2 SO 4 -H 2 C 2 O 4 混合溶液。下列叙述错误的是 ( ) A. 待加工铝质工件为阳极 B. 可选用不锈钢网作为阴极 C. 阴极的电极反应式为 :Al 3+ +3e - Al D. 硫酸根离子在电解过程中向阳极移动 C - 10 - 专题知识脉络 能力目标解读 热点考题诠释 5 .(2017 全国 Ⅲ ) 全固态锂硫电池能量密度高、成本低 , 其工作原理如图所示 , 其中电极 a 常用掺有石墨烯的 S 8 材料 , 电池反应为 : 16Li+ x S 8 8Li 2 S x (2 ≤ x ≤ 8) 。下列说法错误的是 ( ) A. 电池工作时 , 正极可发生反应 :2Li 2 S 6 +2Li + +2e - 3Li 2 S 4 B. 电池工作时 , 外电路中流过 0.02 mol 电子 , 负极材料减重 0.14 g C. 石墨烯的作用主要是提高电极 a 的导电性 D. 电池充电时间越长 , 电池中 Li 2 S 2 的量越多 D - 11 - 专题知识脉络 能力目标解读 热点考题诠释 - 12 - 命题热点一 命题热点二 命题热点三 原电池原理及电极反应式的书写 有关原电池解题的思维路径 - 13 - 命题热点一 命题热点二 命题热点三 问题探究 1 . 如何确定正负极 ? (1) 根据电极材料判断 : 活泼金属作负极、不活泼金属 ( 或能导电的非金属 ) 作正极。燃料电池 : 燃料在负极 , 氧气在正极。 (2) 由反应类型判断 : 失电子发生氧化反应的是负极 ; 得电子发生还原反应的是正极。 (3) 依据电子流向、阴阳离子流向、电流流向判断 : 电子流出、电流流入、阴离子流向的电极为负极 ; 电子流入、电流流出、阳离子流向的电极为正极。 - 14 - 命题热点一 命题热点二 命题热点三 2 . 怎样正确书写电极反应 ? (1) 电极反应的书写是关键。常见的步骤及方法 : - 15 - 命题热点一 命题热点二 命题热点三 (2) 书写电极反应式应充分注意介质影响。 ① 中性溶液反应物中若是 H + 得电子或 OH - 失电子 ,H + 和 OH - 均来自水的电离 ; ② 酸性溶液反应物、生成物中均不出现 OH - ; ③ 碱性溶液反应物、生成物中均不出现 H + ; ④ 水溶液中不能出现 O 2- 。 - 16 - 命题热点一 命题热点二 命题热点三 例 1 (1) 二甲醚直接燃料电池具有启动快、效率高等优点 , 其能量密度高于甲醇直接燃料电池 (5.93 kW·h·kg -1 ) 。若电解质为酸性 , 二甲醚直接燃料电池的负极反应为 , 一个二甲醚分子经过电化学氧化 , 可以产生 个电子的电量。 (2) 与 MnO 2 -Zn 电池类似 ,K 2 FeO 4 -Zn 也可以组成碱性电池 ,K 2 FeO 4 在电池中作为正极材料 , 其电极反应式为 , 该电池总反应的离子方程式为 。 - 17 - 命题热点一 命题热点二 命题热点三 分析推理 (1) 对于燃料电池负极反应的书写 , 需要以下几个思维步骤 : 第一步先写反应物、生成物 , 注意溶液的环境 : 酸性 电解质中 CH 3 OCH 3 ——2CO 2 ; 第二步写明转移电子数 , 根据碳元素的化合价变化 : CH 3 OCH 3 -12e - ——2CO 2 ; 第三步配平 , 根据电荷守恒和原子守恒 : 3H 2 O+CH 3 OCH 3 -12e - 2CO 2 +12H + 。 1 mol 二甲醚被氧化生成 2 mol CO 2 , 失去 12 N A 个电子 , 故 1 个二甲醚分子转移 12 个电子。 - 18 - 命题热点一 命题热点二 命题热点三 - 19 - 命题热点一 命题热点二 命题热点三 题后反思 (1) 在书写负极反应时 , 因为不遵循守恒规律 , 导致书写错误 , 若忽略溶液的酸碱性 , 写出了碱性环境下的反应 , 没有分清正负极 , 写出了正极的电极反应。 (2) 在书写正极反应时 , 写成 , 没有考虑溶液为碱性环境而不得分 , 未配平不得分。 (3) 总方程式书写常见的两个问题 : 第一是写成化学方程式 , 题干要求写离子方程式 ; 第二是没有配平或不该拆开的物质拆开了。 - 20 - 命题热点一 命题热点二 命题热点三 对点训练 1 (2018 天津理综 , 节选 )O 2 辅助的 Al-CO 2 电池工作原理如图所示。该电池电容量大 , 能有效利用 CO 2 , 电池反应产物 Al 2 (C 2 O 4 ) 3 是重要的化工原料。 - 21 - 命题热点一 命题热点二 命题热点三 - 22 - 命题热点一 命题热点二 命题热点三 电解原理及电极反应式的书写 有关电解池解题的思维路径 - 23 - 命题热点一 命题热点二 命题热点三 问题探究 1 . 如何判断阴阳极 ? 判断原电池和电解池的电极是解题的关键 , 为了方便记忆 , 我们可采取口诀或谐音的方法记忆。 原电池 , 正负极 ; 电解池 , 阴阳极 ; 失去电子负 ( 原电池 ) 阳 ( 电解池 ) 极 ; 发生氧化定无疑。 - 24 - 命题热点一 命题热点二 命题热点三 2 . 怎样判断电解产物 ? (1) 阳极产物的判断。 首先看电极 , 如果是活性电极 ( 金属活动性顺序中 Ag 以前的金属 , 包括 Ag) 作阳极 , 则电极材料本身失电子 , 电极溶解。如果是惰性电极 , 则看溶液中阴离子的失电子能力 , 阴离子的放电顺序为 S 2- >I - >Br - >Cl - >OH - , 其氧化产物依次对应为单质 S 、 I 2 、 Br 2 、 Cl 2 和 O 2 。 (2) 阴极产物的判断。 直接根据阳离子放电顺序 ( 如下 ) 进行判断 :Ag + >Fe 3+ >Cu 2+ >H + > Pb 2 + >Sn 2+ >Fe 2+ >Zn 2+ , 其还原产物依次对应为金属单质或低价态阳离子 :Ag 、 Fe 2+ 、 Cu 、 H 2 、 Pb 、 Sn 、 Fe 、 Zn 。 3 . 如何正确书写电极反应式 ? 根据溶液环境 , 结合电解产物的判断 , 书写出阴阳极的电极反应方程式。 - 25 - 命题热点一 命题热点二 命题热点三 例 2 (1)H 3 PO 2 也可用电渗析法制备 ,“ 四室电渗析法 ” 工作原理如图所示 ( 阳膜和阴膜分别只允许阳离子、阴离子通过 ): - 26 - 命题热点一 命题热点二 命题热点三 ① 写出阳极的电极反应式 。 ② 分析产品室可得到 H 3 PO 2 的原因 。 ③ 早期采用 “ 三室电渗析法 ” 制备 H 3 PO 2 , 将 “ 四室电渗析法 ” 中阳极室的稀硫酸用 H 3 PO 2 稀溶液代替。并撤去阳极室与产品室之间的阳膜 , 从而合并了阳极室与产品室。其缺点是产品中混有 杂质 , 该杂质产生的原因是 。 (2)PbO 2 也可以通过石墨为电极 ,Pb(NO 3 ) 2 和 Cu(NO 3 ) 2 的混合溶液为电解液电解制取。阳极发生的电极反应式为 , 阴极上观察到的现象是 ; 若电解液中不加入 Cu(NO 3 ) 2 , 阴极发生的电极反应式为 , 这样做的主要缺点是 。 - 27 - 命题热点一 命题热点二 命题热点三 分析推理 (1) 如何判断阴阳极电解产物 ? 根据电子的流动方向及溶液中离子的放电顺序 , 可知阳极只能是氢氧根离子失电子 , 转化为 O 2 , 阴极为氢离子得电子转化为 H 2 。 (2) 如何判断溶液中离子的移动方向 ? 根据离子交换膜的性质与溶液中离子的移动要形成闭合回路这一特点 , 阳极室中的氢离子移向产品室 , 因为产品室与原料室之间有阴膜 , 阻止了阳离子向阴极室移动 , 为了形成闭合回路 , 只能是原料室 中 移 向产品室 , 同时钠离子移向阴极室。 (3) 若采用 “ 三室电渗析法 ”, 则杂质是如何产生的 ? 此时可以根据放电顺序及所给物质性质判断 , 因为 H 3 PO 2 中 P 为 +1 价 , 具有较强的还原性 , 会被阳极产生的氧气氧化为 。 - 28 - 命题热点一 命题热点二 命题热点三 (4) 对于 Pb(NO 3 ) 2 和 Cu(NO 3 ) 2 混合溶液 , 阳极产物是 O 2 吗 ? 阴阳极产物如何判断 ? 一般要依据离子在溶液中的放电顺序 , 活性电极作阳极要先放电溶解 , 结合题给信息 , 知道 PbO 2 可以由电解得到 , 则 Pb 2+ 的化合价升高 , 失电子 , 只能在阳极产生 , 所以阳极产生的是 PbO 2 而非 O 2 。根据放电顺序 , 阴极产生的是铜单质。 - 29 - 命题热点一 命题热点二 命题热点三 题后反思 (1) 写电极反应时电子的得失易写反 , 如写成 2H 2 O+4e - O 2 ↑ + 4H + 而丢分。 (2) 得到 H 3 PO 2 的原因 , 杂质产生的原因 , 学生给出的答案千奇百怪 , 说明对原理不清楚。即使清楚原理 , 很多学生语言叙述存在很大问题 , 没有说出关键点而丢分。由此提醒我们在今后的学习中多在课堂中练习表述 , 学会表述。 (3) 对于 Pb(NO 3 ) 2 和 Cu(NO 3 ) 2 混合溶液中阳极反应很多学生没有审清题 , 写成 4OH - -4e - 2H 2 O+O 2 ↑ 而丢分。同样 “ 阴极上观察的现象 ”, 而许多学生写成溶液中的现象而丢分。审清题意成为此题得分的关键点。 - 30 - 命题热点一 命题热点二 命题热点三 对点训练 2 (2018 全国 Ⅰ , 节选 ) 制备 Na 2 S 2 O 5 也可采用三室膜电解技术 , 装置如图所示 , 其中 SO 2 碱吸收液中含有 NaHSO 3 和 Na 2 SO 3 。阳极的电极反应式为 。电解后 , 室的 NaHSO 3 浓度增加。将该室溶液进行结晶脱水 , 可得到 Na 2 S 2 O 5 。 - 31 - 命题热点一 命题热点二 命题热点三 解析 根据电解目的 —— 得到更多的 NaHSO 3 , 因此阳极是水电离出的 OH - 放电 , 留下的氢离子通过阳离子交换膜进入 a 室 , 使 a 室中的 NaHSO 3 浓度增大。 - 32 - 命题热点一 命题热点二 命题热点三 金属的腐蚀与防护 电化学定量计算 金属的腐蚀与防护的解题思维路径 - 33 - 命题热点一 命题热点二 命题热点三 问题探究 1 . 金属防腐的电化学方法有哪些 ? (1) 牺牲阳极的阴极保护法 —— 原电池原理 : 在被保护的钢铁设备上装若干较活泼金属如锌块 , 让被保护的金属作原电池的正极 , 简称 “ 牺阳保阴 ” 。 (2) 外加电流的阴极保护法 —— 电解池原理 : 让被保护的钢铁设备作阴极 , 惰性电极作阳极 , 外接直流电源 , 简称 “ 外流保阴 ” 。 (3) 其他方法 : 改变金属内部结构 , 如制成不锈钢 ; 加涂防护层如喷油漆、涂油脂、喷镀等方法。 - 34 - 命题热点一 命题热点二 命题热点三 2 . 有关电化学定量计算的方法有哪些 ? (1) 根据总反应式计算。先写出电极反应 , 再写出总反应式 , 然后根据总反应式列比例式计算。 (2) 守恒法计算。用于串联电路中电极反应物、产物及电子转移的有关计算 , 其依据是电路中转移的电子数守恒。 - 35 - 命题热点一 命题热点二 命题热点三 例 3 如下图所示 , 将铁棒和石墨棒插入盛有饱和 NaCl 溶液的 U 形管中。下列分析正确的是 ( ) A.K 1 闭合 , 铁棒上发生的反应为 2H + +2e - H 2 ↑ B.K 1 闭合 , 石墨棒周围溶液 pH 逐渐升高 C.K 2 闭合 , 铁棒不会被腐蚀 , 属于牺牲阳极的阴极保护法 D.K 2 闭合 , 电路中通过 0.002 N A 个电子时 , 两极共产生 0.001 mol 气体 - 36 - 命题热点一 命题热点二 命题热点三 答案 B - 37 - 命题热点一 命题热点二 命题热点三 对点训练 3 (2018 北京理综 ) 验证牺牲阳极的阴极保护法 , 实验如下 ( 烧杯内均为经过酸化的 3% NaCl 溶液 ) 。 - 38 - 命题热点一 命题热点二 命题热点三 下列说法不正确的是 ( ) A. 对比 ②③ , 可以判定 Zn 保护了 Fe B. 对比 ①② ,K 3 [Fe(CN) 6 ] 可能将 Fe 氧化 C. 验证 Zn 保护 Fe 时不能用 ① 的方法 D. 将 Zn 换成 Cu, 用 ① 的方法可判断 Fe 比 Cu 活泼 答案 解析 解析 关闭 A 项 , 由②与③的现象不同 , 可以说明 Zn 保护了 Fe, 正确 ;B 项 , 对比①②可知 , 铁氰化钾可能把 Fe 氧化为 Fe 2+ , 并进一步与 Fe 2+ 反应生成蓝色沉淀 , 正确 ;C 项 , ①生成蓝色沉淀 , 说明有 Fe 2+ 生成 , 因而不能用于验证 Zn 保护 Fe, 正确 ;D 项 , 实验①中无论 Fe 作正极还是负极 ,Fe 附近均产生蓝色沉淀 , 故将 Zn 换成 Cu, 无法证明 Fe 比 Cu 活泼 , 错误。 答案 解析 关闭 D - 39 - 1 . 微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示 , 下列说法正确的是 ( ) B. 电子从电极 b 流出 , 经外电路流向电极 a C. 如果将反应物直接燃烧 , 能量的利用率不会变化 D. 若该电池电路中有 0.4 mol 电子发生转移 , 则有 0.5 mol H + 通过质子交换膜 A 答案 解析 解析 关闭 答案 解析 关闭 - 40 - 2 .(1) 工业上使用如图装置 , 采用石墨作电极电解 Na 2 CrO 4 溶液 , 使 Na 2 CrO 4 转化为 Na 2 Cr 2 O 7 , 其转化原理为 。 - 41 - - 42 -查看更多