- 2021-04-16 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习人教版物质的分类与转化 物质的分散系教案
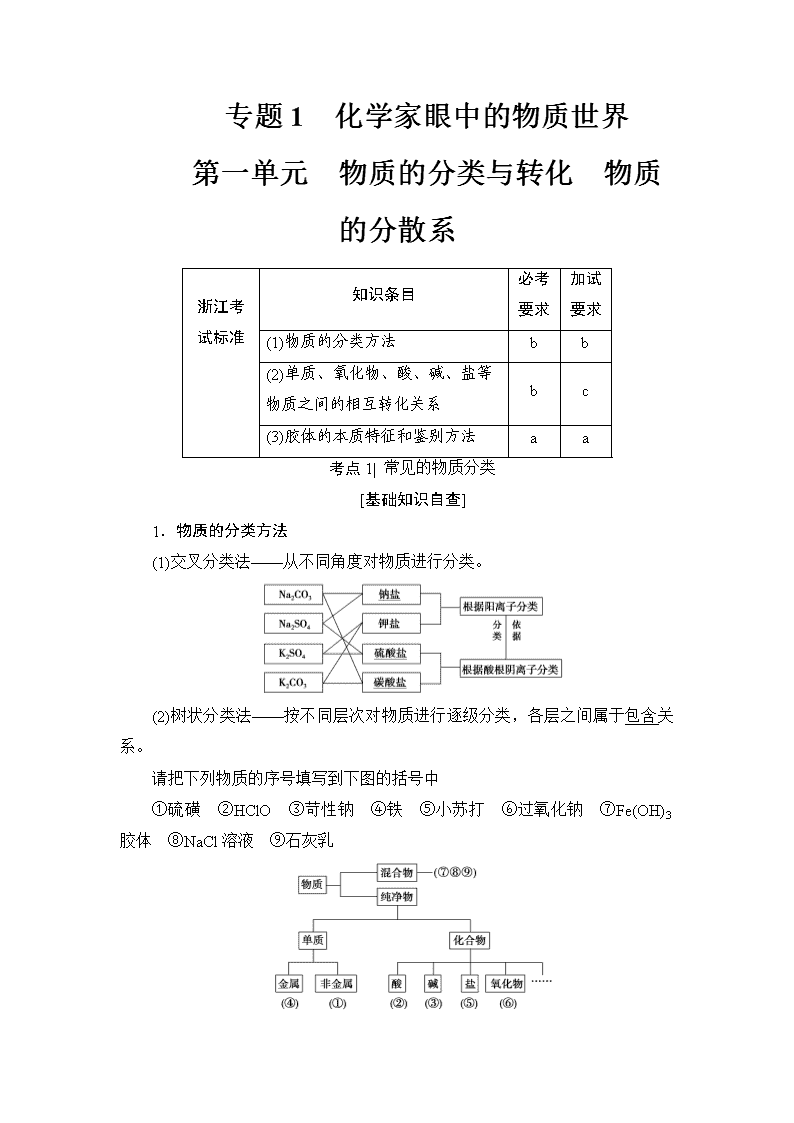
专题1 化学家眼中的物质世界 第一单元 物质的分类与转化 物质的分散系 浙江考试标准 知识条目 必考要求 加试要求 (1)物质的分类方法 b b (2)单质、氧化物、酸、碱、盐等物质之间的相互转化关系 b c (3)胶体的本质特征和鉴别方法 a a 考点1| 常见的物质分类 [基础知识自查] 1.物质的分类方法 (1)交叉分类法——从不同角度对物质进行分类。 (2)树状分类法——按不同层次对物质进行逐级分类,各层之间属于包含关系。 请把下列物质的序号填写到下图的括号中 ①硫磺 ②HClO ③苛性钠 ④铁 ⑤小苏打 ⑥过氧化钠 ⑦Fe(OH)3胶体 ⑧NaCl溶液 ⑨石灰乳 2.化合物的分类 3.氧化物的简单分类 (1)碱性氧化物 ①概念:能与酸反应生成盐和水的氧化物。 ②反应实例:CuO+H2SO4===CuSO4+H2O。 ③举例:CaO、Na2O、CuO、Fe2O3等。 (2)酸性氧化物 ①概念:能与碱反应生成盐和水的氧化物。 ②反应实例:CO2+2NaOH===Na2CO3+H2O。 ③举例:CO2、SO2、SO3等。 4.化学反应的分类 虽然物质间转化时所发生的反应千变万化,但绝大多数无机物之间所发生的化学反应,基本上属于以下几种类型。 (1)四种基本化学反应类型 根据参加反应的物质种类不同,可以将化学反应分为化合反应、分解反应、置换反应和复分解反应四种基本类型。 (2)氧化还原反应 根据化学反应过程中元素的化合价是否发生变化,可以将化学反应分为氧化还原反应和非氧化还原反应。 氧化还原反应:元素化合价发生变化的反应。氧化还原反应的本质是反应过程中发生了电子转移(电子得失或电子偏移)。 (3)四种反应类型与氧化还原反应的关系 在四种基本反应类型中,置换反应一定属于氧化还原反应,复分解反应一定不属于氧化还原反应。 [核心要点提升] 1.明晰分类标准是对物质正确分类的关键 2.物质分类的常见误区归类 (1)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物(如Mn2O7为酸性氧化物、Al2O3为两性氧化物、Na2O2为过氧化物)。 (2)酸性氧化物不一定是非金属氧化物(如Mn2O7);非金属氧化物也不一定是酸性氧化物(如CO、NO)。 (3)酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱(如SiO2、Fe2O3)。 (4)高分子化合物属于混合物。 (5)酸(或碱)的水溶液一定呈酸(或碱)性,但呈酸(或碱)性的溶液不一定是酸(或碱)溶液。 (6)一个一元强酸分子一定能电离出一个H+,电离出一个H+的不一定是一元酸(如NaHSO4)。 (7)盐中的阳离子不一定是金属阳离子,也可能是NH。 [典型例题讲解] (2016·浙江10月选考)下列属于酸的是( ) A.H2SO4 B.CO2 C.NaCl D.NaOH 【解析】 H2SO4属于酸;CO2是酸性氧化物;NaCl属于盐;NaOH属于强碱。 【答案】 A (2015·浙江10月选考)下列属于酸性氧化物的是( ) A.CO2 B.CaO C.K2SO4 D.NaOH 【解析】 B项为碱性氧化物,C、D两项不属于氧化物。 【答案】 A (1)正确分类的前提是明确分类标准。 (2)正确理解重要概念的内涵和外延是正确分类的基础。 (3)同一种物质按不同的角度进行分类,可以得到不同的分类结果。 [题组对点训练] 1.(2016·浙江4月学考)下列属于氧化物的是( ) A.NaCl B.MgO C.H2SO4 D.NaOH B [氧化物由两种元素组成且其中一种是氧元素,NaCl属于盐,MgO是氧化物,H2SO4属于酸,NaOH属于碱。] 2.(2015·浙江1月学考)下列物质中,属于碱性氧化物的是( ) A.SO2 B.CO C.MgO D.Cu(OH)2 C [能与酸反应生成盐和水的氧化物是碱性氧化物。SO2是酸性氧化物,MgO是碱性氧化物,Cu(OH)2是碱。] 3.(2015·浙江10月学考)HCl+NaOH===NaCl+H2O的反应类型是( ) A.化合反应 B.置换反应 C.分解反应 D.复分解反应 D [酸和碱反应生成盐和水的反应是中和反应,中和反应是化合物相互交换成分的复分解反应。] 4.(加试题)(2017·杭州模拟)下列说法正确的是( ) ①经分析某物质只含有一种元素,则该物质一定是单质 ②胆矾、冰水混合物、四氧化三铁都不是混合物 ③碱性氧化物一定是金属氧化物 ④NO2不是酸性氧化物,Na2O2不属于碱性氧化物 ⑤非金属氧化物一定属于酸性氧化物 A.①③④ B.②③④ C.②③⑤ D.①③⑤ B [含一种元素可能是同素异形体形成的混合物,①错;胆矾、冰水混合物、四氧化三铁都是纯净物,②正确;碱性氧化物一定是金属氧化物,③正确;NO2与H2O反应不只是生成酸,Na2O2与H2O反应不只是生成碱,④正确;有些非金属氧化物不属于酸性氧化物,如CO,⑤错。] 5.(2017·衢州模拟)下列10种物质:①水 ②空气 ③铁 ④二氧化碳 ⑤硫酸 ⑥熟石灰[Ca(OH)2] ⑦胆矾(CuSO4·5H2O) ⑧NaOH溶液 ⑨碱式碳酸铜[Cu2(OH)2CO3] ⑩硫酸氢钠(NaHSO4) (1)属于混合物的是________________________________________________。 (2)属于氧化物的是________________________________________________。 (3)属于碱的是________________________________________________。 (4)属于酸的是________________________________________________。 (5)属于盐的是________________________________________________。(以上空格填物质的序号) 【解析】 结晶水合物如胆矾(CuSO4·5H2O),碱式盐如Cu2(OH)2CO3,酸式盐如NaHSO4都有固定的组成,均为纯净物。而NaOH溶液是由溶质和溶剂组成的,属于混合物。 【答案】 (1)②⑧ (2)①④ (3)⑥ (4)⑤ (5)⑦⑨⑩ 考点2| 物质的性质与变化 [基础知识自查] 1.物质的性质和变化 (1)物质的性质 ①物理性质主要表现在颜色、熔沸点、硬度、状态、气味、溶解性、导电性、导热性、密度、光泽和延展性等方面。 ②化学性质主要表现在金属性、非金属性、可燃性、还原性、氧化性、酸碱性、稳定性等方面。 (2)物质的变化 ①物理变化是指没有新物质生成,即没有化学键断裂和形成的变化。 ②化学变化是指有新物质生成,即有化学键的断裂和形成,也就是结构发生变化,分子中原子重新组合的变化。 2.单质、氧化物、酸、碱、盐之间的相互转化关系 (1)复分解反应发生的条件:有沉淀、气体或弱电解质生成。 (2)金属与盐发生置换反应的条件是较活泼金属单质与较不活泼金属的盐溶液反应。 [核心要点提升] 1.常见的物理变化和化学变化 物理变化 化学变化 三馏 蒸馏、分馏 干馏 四色 焰色反应 显色反应、颜色反应、指示剂变色反应 五解 潮解 分解、裂解、水解、电解 十八化 熔化、汽化、液化、酸化 氧化、氢化、水化、风化、钝化、皂化、炭化、催化、硫化、酯化、硝化、裂化、卤化、油脂硬化 2.常见物质转化 (1)常见物质转化关系 ①连续氧化转化:ABC,若A为无机物单质,则其可能为C、S、N2、Na等;若A为常见有机物,则其可能为CH3CH2OH;若A为常见氢化物,则可能为CH4、H2S、NH3等。 ②三角转化 ③交叉转化 (2)常见物质间转化的几个误区 ①S燃烧不能直接生成SO3而是生成SO2。 ②Al2O3、SiO2、Fe2O3与H2O不反应,不能直接转化为Al(OH)3、H2SiO3、Fe(OH)3。 ③NH3催化氧化不能直接生成NO2。 ④Fe与Cl2反应不能生成FeCl2。 ⑤Fe与H+、Cu2+、S、I2反应不能生成Fe3+。 [典型例题讲解] (2015·浙江7月学考)下列属于物理变化的是( ) A.石油裂解 B.煤的干馏 C.食物腐败 D.空气液化 【解析】 石油裂解有新物质生成,是化学变化;煤的干馏是煤隔绝空气受热分解的过程,是化学变化;食物腐败发生氧化反应;空气液化只是物质状态发生变化,没有新物质生成。 【答案】 D 在给定条件下,下列选项中所示的物质间转化均能一步实现的是( ) A.粗硅SiCl4Si B.Mg(OH)2MgCl2(aq)Mg C.Fe2O3FeCl3(aq)无水FeCl3 D.FeFe2(SO4)3(aq)Fe(OH)3 【解析】 B项,MgCl2(aq)电解时不能生成Mg;C项,蒸发FeCl3溶液不能得到无水FeCl3,而是生成水解产物Fe(OH)3;D项,Fe与稀H2SO4反应生成FeSO4。 【答案】 A 判断一个变化过程是物理变化还是化学变化的唯一标准是看有无新物质生成,表现为生成新物质、新分子或旧键断裂同时有新键形成;物理变化过程不一定有化学变化,但化学变化一定包含物理变化。 [题组对点训练] 1.(2015·浙江1月学考)下列过程中,属于化学变化的是( ) A.用加热法分离泥沙中的碘单质 B.用蒸馏法制取蒸馏水 C.干冰升华 D.铁锅生锈 D [铁锅生锈由铁(Fe)最终转化为Fe2O3,生成了新物质。] 2.(2017·浙江温州十校联合体期中)下列变化一定属于化学变化的是( ) ①风化 ②变色 ③燃烧 ④爆炸 ⑤石墨变成金刚石 ⑥工业制氧气 ⑦氯水久置变成无色 A.①②③④ B.③④⑤⑦ C.①③⑤⑦ D.①③④⑦ C [①风化一定是化学变化,如Na2CO3·10H2O===Na2CO3+10H2O。②看具体情况而定,如FeCl3溶液遇KSCN变红,为化学变化;向溴水中加苯,振荡后有机层显橙红色,为物理变化。③燃烧是化学反应。④爆炸也可能是气体温度升高、压强增大所致,这时为物理变化。⑤同素异形体间的转化一定是化学变化。⑥工业制氧气常采用分离液态空气法,是利用N2、O2的沸点不同而把N2与O2 分离开。⑦反应的化学方程式为Cl2+H2OHCl+HClO,2HClO2HCl+O2↑。] 3.(2017·浙江宁波镇海中学学考模拟)晚会上,某位学生在表演“空瓶生烟”魔术节目时,将两个“空”集气瓶口对口靠在一起,一会儿,瓶内白烟滚滚。魔术并不是无中生有,而是有一定的科学根据的。原来表演者事先在两个集气瓶中分别滴加了2滴浓盐酸和浓氨水,充分振荡后使HCl气体和NH3气体分别充满两个集气瓶,发生化学反应生成了固体小颗粒NH4Cl(白烟)。该反应的化学方程式为HCl+NH3===NH4Cl。请回答以下问题: (1)此魔术中体现了浓盐酸和浓氨水均极易________。 (2)从物质分类角度看,NH4Cl属于________。 (3)从化学反应类型分析,此反应属于________反应。 【解析】 浓盐酸和浓氨水均易挥发,分别产生HCl气体和氨气,二者相遇发生反应NH3+HCl===NH4Cl,NH4Cl由NH和Cl-构成,属于盐类。 【答案】 (1)挥发 (2)盐或正盐、铵盐、盐酸盐等 (3)化合 考点3| 分散系 胶体 [基础知识自查] 1.分散系 (1)组成 (2)分类 ①把分散系分为溶液、胶体和浊液的本质标准是:分散质粒子直径大小。可用如下方式直观地表示: ②若按分散质或分散剂的状态分类,可分为9种分散系,如图: 如烟属于固气分散系;雾属于液气分散系; 悬浊液属于固液分散系;合金属于固固分散系。 2.胶体 (1)本质特征:分散质粒子的直径为10-9~10-7_m。 (2)胶体的性质 ①丁达尔效应 当光束通过胶体时,在垂直于光线的方向可以看到一条光亮的通路的现象。可用于鉴别胶体和溶液。 ②胶体的吸附性 利用胶体所具有的极强的吸附性,Al(OH)3胶体和Fe(OH)3胶体可用于净水。 (3)胶体的主要应用 ①作净水剂。 ②可以改进材料的机械性能和光学性质。 ③医学上利用高度分散的胶体来检验或治疗疾病。 ④国防工业中有些火药、炸药须制成胶体。 (4)Fe(OH)3胶体的实验室制备 ①方法:将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至液体呈红褐色,即制得Fe(OH)3胶体。 ②化学方程式为FeCl3+3H2OFe(OH)3(胶体)+3HCl。 (4)几种常见胶体 ①烟或雾 ②鸡蛋白的溶液 ③血液 ④淀粉溶液 ⑤豆浆 ⑥牛奶 ⑦墨水 ⑧Fe(OH)3胶体 ⑨硅酸胶体 [核心要点提升] 三种分散系的比较 分散系 溶液 胶体 浊液 分散质粒子 单个小分子或离子 高分子或多分子集合体 巨大数目的分子集合体 性质 外观 均一、透明 均一 不均一、不透明 稳定性 稳定 较稳定 不稳定 能否透 过滤纸 能 能 不能 能否透过 半透膜 能 不能 不能 【易错警示】 (1)胶体区别于其他分散系的本质特征是胶体粒子直径在1~100 nm之间。 (2)丁达尔效应是区别胶体和溶液的最简便的方法。 [典型例题讲解] (2015·浙江7月学考)下列分散系能产生丁达尔效应的是( ) A.Fe(OH)3胶体 B.CuSO4溶液 C.溴水 D.KCl溶液 【解析】 丁达尔效应是胶体特有的性质,也是区别胶体和溶液的最简便的方法。 【答案】 A (2015·浙江9月学考测试)下列关于Fe(OH)3胶体的说法中,不正确的是( ) A.分散质粒子直径在10-9~10-7 m之间 B.是一种纯净物 C.具有丁达尔效应 D.具有净水作用 【解析】 胶体区别于其他分散系的本质是其分散质粒子直径在10-9~10-7 m之间;特征是能产生丁达尔效应;胶体有强吸附性,有净水作用;胶体是混合物。 【答案】 B 有关胶体的理解 (1)胶体微粒一般是离子、分子或难溶物的聚集体,但有些高分子化合物,如淀粉、蛋白质,因其分子非常大,其相对分子质量通常为几万、几十万甚至上百万、千万,因此一个分子就是一个胶体微粒,它们的溶液是胶体。 (2)胶体粒子的直径一般在1~100 nm之间,它决定了胶体粒子具有较大的表面积,吸附力很强,能在水中吸附悬浮固体形成沉淀,从而达到净化水的目的,这就是胶体净水的原理,胶体一般没有杀菌的作用。 [题组对点训练] 1.(2015·浙江1月学考)用聚光手电筒照射下列分散系,能观察到丁达尔效应的是( ) A.溶液 B.胶体 C.乳浊液 D.悬浊液 B [只有胶体才能产生丁达尔效应。] 2.(2017·浙江嘉兴测试)澳大利亚科学家发现了纯碳新材料“碳纳米泡沫”,每个泡沫含有约4 000个碳原子,直径约6到9 nm,在低于-183 ℃时,泡沫具有永久磁性。下列叙述正确的是( ) A.“碳纳米泡沫”与石墨互为同位素 B.把“碳纳米泡沫”分散到适当的溶剂中,能产生丁达尔现象 C.“碳纳米泡沫”是一种新型的含碳化合物 D.“碳纳米泡沫”和金刚石的性质相同 B [A项,“碳纳米泡沫”与石墨均是由碳元素组成的不同单质,互为同素异形体,故A错误;B项,根据每个泡沫含有约4 000个碳原子,直径约6到9 nm,可知将“碳纳米泡沫”分散到适当的溶剂中可形成胶体,能产生丁达尔现象,故B正确;C项,“碳纳米泡沫”只含碳元素,是一种单质,故C错误;D项,“碳纳米泡沫”和金刚石的结构不同,物理性质不同,故D错误。] 3.(2017·舟山模拟)磁流体是电子材料的新秀,它既有固体的磁性,又有液体的流动性,制备时将含等物质的量的FeSO4和Fe2(SO4)3 的溶液混合,再滴入稍过量的NaOH溶液,随后加入硫酸钠,即可产生黑色的、分散质粒子的直径为36~55 nm的磁流体,下列说法中正确的是( ) A.所得到的分散系为浊液 B.该分散系的分散质为Fe(OH)3 C.用一束光照射该分散系,可以看到一条光亮的“通路” D.该分散系极不稳定 C [根据题意磁流体分散系的分散质粒子直径为36~55 nm,属于胶体的范畴,所以应具备胶体的性质;所得分散系为胶体,故A错误;分散质应是黑色的,而Fe(OH)3是红褐色的,故不是Fe(OH)3,故B错误;胶体具有丁达尔效应,故C正确;所得分散系为胶体,较稳定,属于介稳体系,故D错误。]查看更多