- 2021-04-16 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习无机化工流程学案
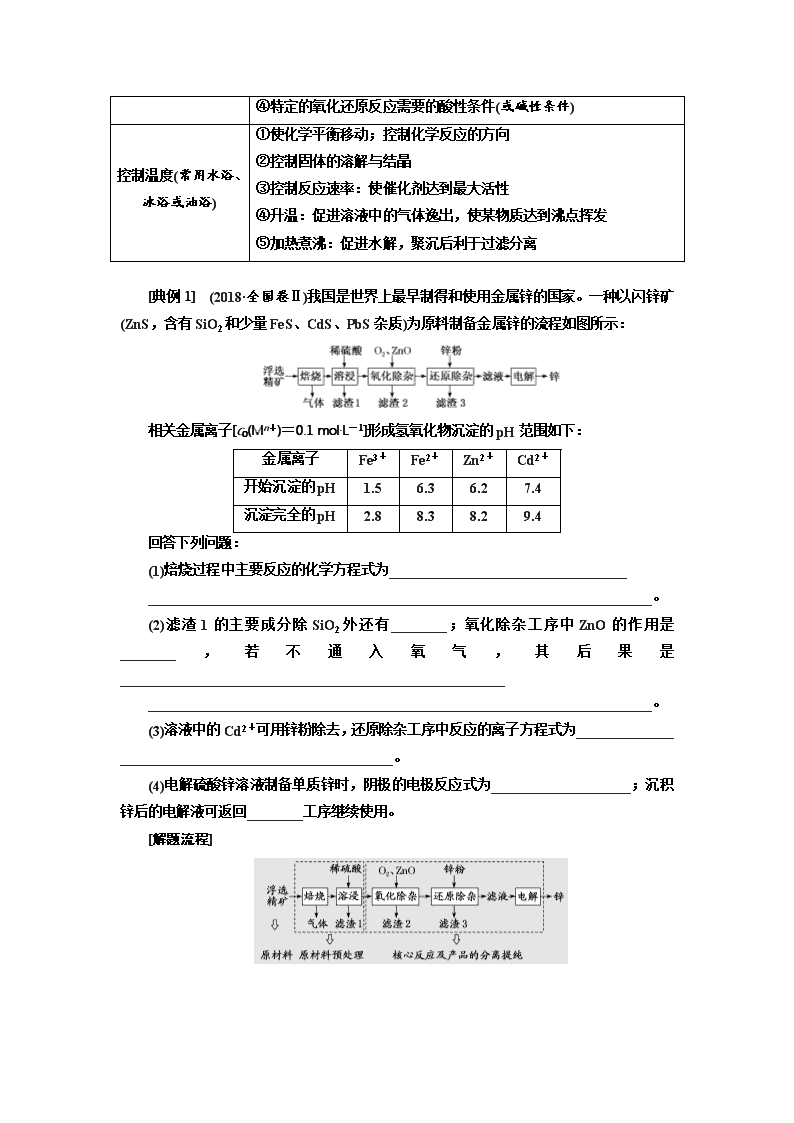
第12课时 题型研究——“无机化工流程题”解题指导 无机化工流程题是以实际的工业生产过程为背景,以解决化学实际问题为思路设置问题,通常以流程图的形式呈现生产过程,有时还结合表格和图像提供多种信息。试题的结构通常分为题头、流程和设问三部分。题头一般是简单介绍该工艺生产的原材料和工艺生产的目的(包括副产品);流程部分主要用框图形式将原料到产品的主要生产工艺流程表示出来;设问主要是根据生产过程中涉及的化学知识来设置,从而组成一道完整的化学试题。从要解决的问题看,这类试题通常有两个目的:一是从混合物中分离、提纯某种物质;二是利用某些物质制备另一物质。 1.化工生产的一般流程 2.试题的设问角度 化工流程题的考点主要从以下6点设置: (1)基本操作 除杂、分离、检验、洗涤、干燥等实验操作的步骤描述;加入某些试剂或某个操作步骤的目的描述。 (2)物质的分离与提纯 通过调节pH使溶液中的金属离子沉淀达到分离除杂的目的,据此选择需要加入的化学试剂;加入某种物质使难溶物转化为更难溶的物质后,通过过滤除去等。 (3)化学反应速率与化学平衡理论的运用 例如,研磨使反应物颗粒变小,增大反应物间的接触面积,从而增大反应速率,提高原料利用率;升高温度能增大反应速率,使吸热反应平衡正向移动等。 (4)化学方程式或离子方程式的书写 根据流程图及设问中的信息找出反应物和生成物,书写指定的化学方程式或离子方程式。 (5)环境与绿色化学思想 流程中物质的转化和循环、资源的回收和利用、“三废”的来源、对环境的影响及处理措施等。 (6)化学计算 联系原料纯度、转化率、损失率、产物产率等计算产品质量;联系溶液配制、滴定操作测定样品中某元素含量或产品纯度;联系溶度积常数,计算溶液中某离子浓度或完全沉淀时的pH等。 题型一 以物质制备为目的工艺流程 1.工艺流程中的常见专业术语 释义 研磨、雾化 将块状或颗粒状的物质磨成粉末或将液体分散成微小液滴,增大反应物接触面积,以加快反应速率或使反应更充分 灼烧(煅烧) 使固体在高温下分解或改变结构、使杂质高温氧化、分解等。如煅烧石灰石、高岭土、硫铁矿 浸取 向固体中加入适当溶剂或溶液,使其中可溶性的物质溶解,包括水浸取、酸溶、碱溶、醇溶等 酸浸 在酸性溶液中使可溶性金属离子进入溶液,不溶物通过过滤除去的过程 浸出率 固体溶解后,离子在溶液中的含量的多少 滴定 定量测定,可用于某种未知浓度物质的物质的量浓度的测定 酸作用 溶解、去氧化物(膜)、抑制某些金属离子的水解、除去杂质离子等 碱作用 去油污、去铝片氧化膜,溶解铝、二氧化硅、调节pH、促进水解(沉淀) 2.工艺流程题中常见问题的答题方向 常见问题 答题要考虑的角度 分离、提纯 过滤、蒸发、萃取、分液、蒸馏等常规操作,如从溶液中得到晶体的方法:蒸发浓缩—冷却结晶—过滤—(洗涤、干燥) 提高原子利用率 绿色化学(物质的循环利用、废物处理、原子利用率、能量的充分利用) 在空气中或特定气体中进行的反应或操作 要考虑O2、H2O、CO2或特定气体是否参与反应或能否达到隔绝空气,防氧化、水解、潮解等目的 洗涤沉淀 方法:往漏斗中加入蒸馏水至浸没沉淀,待水自然流下后,重复以上操作2~3次 判断沉淀是否洗涤干净 取最后洗涤液少量,检验其中是否还有某种离子存在等 控制溶液的pH ①调节溶液的酸碱性,抑制水解(或使其中某些金属离子形成氢氧化物沉淀) ②“酸作用”还可除去氧化物(膜) ③“碱作用”还可除去油污,除去铝片氧化膜,溶解铝、二氧化硅等 ④特定的氧化还原反应需要的酸性条件(或碱性条件) 控制温度(常用水浴、冰浴或油浴) ①使化学平衡移动;控制化学反应的方向 ②控制固体的溶解与结晶 ③控制反应速率:使催化剂达到最大活性 ④升温:促进溶液中的气体逸出,使某物质达到沸点挥发 ⑤加热煮沸:促进水解,聚沉后利于过滤分离 [典例1] (2018·全国卷Ⅱ)我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示: 相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下: 金属离子 Fe3+ Fe2+ Zn2+ Cd2+ 开始沉淀的pH 1.5 6.3 6.2 7.4 沉淀完全的pH 2.8 8.3 8.2 9.4 回答下列问题: (1)焙烧过程中主要反应的化学方程式为__________________________________ ________________________________________________________________________。 (2)滤渣1的主要成分除SiO2外还有________;氧化除杂工序中ZnO的作用是________,若不通入氧气,其后果是_______________________________________________________ ________________________________________________________________________。 (3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为______________ _______________________________________。 (4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为____________________;沉积锌后的电解液可返回________工序继续使用。 [解题流程] [答案] (1)ZnS+O2ZnO+SO2(或2ZnS+3O22ZnO+2SO2) (2)PbSO4 调节溶液的pH 无法除去杂质Fe2+ (3)Cd2++Zn===Cd+Zn2+ (4)Zn2++2e-===Zn 溶浸 [备考方略] 解答化工流程题的基本步骤 (1)从题干中获取有用信息,阅读题干时要随手画出目的及相关信息,了解反应物是什么,产品是什么,主要分析出产品中各个元素的来源,即分析“元素流向”。 (2)了解流程中一些实验操作的目的,通常都是为了净化原料或者提纯产品。 (3)对反应条件的分析可从以下几个方面着手: ①对反应速率有何影响; ②对平衡转化率有何影响; ③对综合生产效益有何影响(从原料来源、能源成本、环境保护、循环利用方面考虑)。 [对点练1] 3PbO·PbSO4·H2O化学名:三盐基硫酸铅,简称三盐,M=990 g·mol-1。不溶于水,微黄色粉末,可用作聚氯乙烯稳定剂。以铅泥(含PbO、Pb及PbSO4等)为原料制备三盐基硫酸铅的工艺流程如图所示。 已知:PbSO4的Ksp=1.82×10-8,PbCO3的Ksp=1.462×10-13。 请回答下列问题: (1)铅蓄电池其工作原理是Pb+PbO2+2H2SO42PbSO4+2H2O。充电时,阳极的电极反应式为____________________________。 (2)步骤①转化的目的是______________,将滤液1、滤液3合并,经蒸发浓缩、降温结晶、过滤等操作,可得到一种结晶水合物(M=322 g·mol-1),其化学式为________;滤液2中可循环利用的溶质为________(填化学式)。 (3)沉铅的滤液中c(Pb2+)=9.10×10-5 mol·L-1,则此时c(SO)=________mol·L-1。 (4)步骤⑥合成三盐的化学方程式为_____________________________________________ ________________________________________________________________________; 步骤⑦洗涤沉淀时的操作是______________________________________________; 若以100.0 t铅泥为原料制得纯净干燥的三盐49.5 t,假设铅泥中的铅元素有90%转化为三盐,则铅泥中铅元素的质量分数为________。 解析:(1)铅蓄电池充电时,阳极发生氧化反应,其电极反应式为PbSO4+2H2O-2e-===PbO2+SO+4H+。(2)步骤①加入Na2CO3溶液能将PbSO4转化为PbCO3,可以提高铅元素的利用率。结合上述分析可知滤液1、滤液3中均含有Na2SO4,再结合所得晶体的摩尔质量可知析出的晶体为Na2SO4·10H2O。滤液2中的HNO3可循环使用。(3)沉铅后滤液中c(Pb2+)=9.10×10-5 mol·L-1,则滤液中c(SO)== mol·L-1=2.0×10-4 mol·L-1。(4)步骤⑥中加入NaOH溶液,使PbSO4转化成三盐,化学方程式为4PbSO4+6NaOH3PbO·PbSO4·H2O+3Na2SO4+2H2O。沉淀表面有Na2SO4等杂质,洗涤沉淀时,向漏斗中加蒸馏水至浸没沉淀,让蒸馏水自然流下,并重复上述操作2~3次即可。设铅泥中铅元素的质量分数为x,根据关系式: 4Pb ~ 3PbO·PbSO4·H2O 4 mol×207 g·mol-1 990 g 100.0 t×x×90% 49.5 t 则=,解得x=46.0%。 答案:(1)PbSO4+2H2O-2e-===PbO2+SO+4H+ (2)将PbSO4转化为PbCO3,提高铅元素的利用率 Na2SO4·10H2O HNO3 (3)2.0×10-4 (4)4PbSO4+6NaOH3PbO·PbSO4·H2O+3Na2SO4+2H2O 向漏斗中加蒸馏水至浸没沉淀,让蒸馏水自然流下,并重复上述操作2~3次 46.0% 题型二 以分离提纯为目的工艺流程 1.物质转化过程中分离提纯阶段的主要操作 除杂 加入沉淀剂或控制溶液的酸碱性使形成氢氧化物沉淀。如:除去含Cu2+溶液中混有的Fe3+,可加入CuO、Cu(OH)2、Cu2(OH)2CO3等来调节溶液的pH 加热 加快反应速率或使平衡向某个方向移动。如果在制备过程中出现一些受热易分解的物质或产物,则要注意对温度的控制。如:侯氏制碱中的NaHCO3;还有如H2O2、Ca(HCO3)2、KMnO4、AgNO3、HNO3(浓)等物质 降温 防止某物质在高温时会分解或使平衡向着题目要求的方向移动 分离 固液分离——过滤 液液分离: a.有溶解度差异——结晶或重结晶(蒸发浓缩、冷却结晶、过滤、洗涤、烘干;蒸发结晶、趁热过滤) b.有溶解性差异——(萃取)分液 c.有沸点差异——蒸馏 2.获得产品阶段的主要操作 洗涤(冰水、热水、有机溶剂) 水洗:洗去晶体表面的杂质离子(适用于溶解度小的物质) 冰水洗涤:洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗(适用于高温溶解度大、低温溶解度小的物质) 醇洗(常用于溶解度较大的物质):洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗(若对溶解度小的物质进行醇洗,则是为了洗去杂质离子,并使其尽快干燥) 蒸发时的气体氛围抑制水解 如从溶液中析出FeCl3、AlCl3、MgCl2等溶质时,应在HCl的气流中加热,以防其水解 蒸发浓缩、冷却结晶 如K2Cr2O7和少量NaCl的混合溶液,若将混合溶液加热蒸发后再降温,则析出的固体主要是K2Cr2O7,母液中是NaCl和少量K2Cr2O7,这样就可分离出大部分K2Cr2O7;同样原理可除去KNO3中的少量NaCl 蒸发结晶、趁热过滤 如NaCl和少量K2Cr2O7的混合溶液,若将混合溶液蒸发一段时间,析出的固体主要是NaCl,母液中是K2Cr2O7和少量NaCl;同样原理可除去NaCl中的少量KNO3 [典例2] (2016·全国卷Ⅲ)以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为: 物质 V2O5 V2O4 K2SO4 SiO2 Fe2O3 Al2O3 质量分数/% 2.2~2.9 2.8~3.1 22~28 60~65 1~2 <1 以下是一种废钒催化剂回收工艺路线: 回答下列问题: (1)“酸浸”时V2O5转化为VO,反应的离子方程式为_____________________, 同时V2O4转化成VO2+。“废渣1”的主要成分是________。 (2)“氧化”中欲使3 mol的VO2+变为VO,则需要氧化剂KClO3至少为________ mol。 (3)“中和”作用之一是使钒以V4O形式存在于溶液中。“废渣2”中含有________。 (4)“离子交换”和“洗脱”可简单表示为:4ROH+V4OR4V4O12+4OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈________性(填“酸”“碱”或“中”)。 (5)“流出液”中阳离子最多的是________。 (6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式:________________________________________________________________________。 [解题流程] [答案] (1)V2O5+2H+===2VO+H2O SiO2 (2)0.5 (3)Fe(OH)3和Al(OH)3 (4)碱 (5)K+ (6)2NH4VO3V2O5+H2O+2NH3↑ [对点练2] 湿法炼锌产生的铜镉渣主要含锌、镉(Cd)、铜、铁、钴(Co)等金属单质。利用铜镉渣可生产Cu、Cd及ZnSO4·7H2O 等,其生产流程如图: 如表是部分金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1 mol·L-1计算): 氢氧化物 Fe(OH)3 Fe(OH)2 Cd(OH)2 Zn(OH)2 开始沉淀的pH 1.9 7.0 7.2 5.4 沉淀完全的pH 3.2 9.0 9.5 8.2 请回答下列问题: (1)提高铜镉渣的“浸出”速率的措施有________________________________(写出1条即可)。 (2)Fe的金属性比Co强,该流程中“除钴”________(填“能”或“不能”)用Zn代替Fe,“除钴”中Fe发生反应的离子方程式是__________________________________。 (3)“除铁”操作中加入H2O2的目的是______________________________,加入ZnO的目的是调节溶液pH,以除去溶液中的铁元素,调节溶液pH的范围为_________,“除铁”操作中的沉淀成分是__________(写化学式)。 (4)“电解”操作中,Cd2+在________极放电得到金属Cd,电极反应式是________________________________________________________________________。 (5)“电解”后的电解废液是ZnSO4溶液,用该电解废液制备ZnSO4·7H2O的方法是________________________________________________________________________。 (6)“除钴”后的含钴废渣在空气中煅烧,煅烧后的成分测定如表: 元素 Co Zn Cu Fe 含量/% 59.00 0.52 0.20 13.16 则煅烧后所得固体混合物中,钴氧化物的化学式是________。 解析:(1)升高温度、增大反应物表面积等均可提高反应速率。(2)因Zn的金属性比Fe强,故可用Zn代替铁除钴。除钴中Fe与Co2+发生置换反应生成Fe2+和Co。(3)H2O2可氧化Fe2+,使之转化为Fe3+。根据表格中的数据,可知欲除去溶液中的铁元素,需加入ZnO调节溶液pH的范围为3.2~5.4,此时Fe3+完全转化成Fe(OH)3 沉淀。(4)电解操作中Cd2+在阴极得电子生成单质Cd。(5)从ZnSO4溶液中制备ZnSO4·7H2O的方法是蒸发浓缩、冷却结晶、过滤。(6)由题意知,煅烧后所得固体为钴氧化物、ZnO、CuO、Fe2O3的混合物,设煅烧后所得固体质量为100 g,结合题表中的数据可知,钴氧化物中m(O)=100 g-59.00 g-81 g·mol-1×-80 g·mol-1×-160 g·mol-1×=21.302 g,则钴氧化物中n(O)=≈1.33 mol,n(Co)==1.00 mol,故钴氧化物的化学式为Co3O4。 答案:(1)适当升高浸取液温度(或将铜镉渣磨制成粉末等) (2)能 Fe+Co2+===Fe2++Co (3)将Fe2+氧化成Fe3+ 3.2~5.4 Fe(OH)3 (4)阴 Cd2++2e-===Cd (5)蒸发浓缩、冷却结晶、过滤 (6)Co3O4查看更多