- 2021-04-16 发布 |
- 37.5 KB |
- 27页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
备战2021 高考化学 考点56 综合实验题(原卷版)
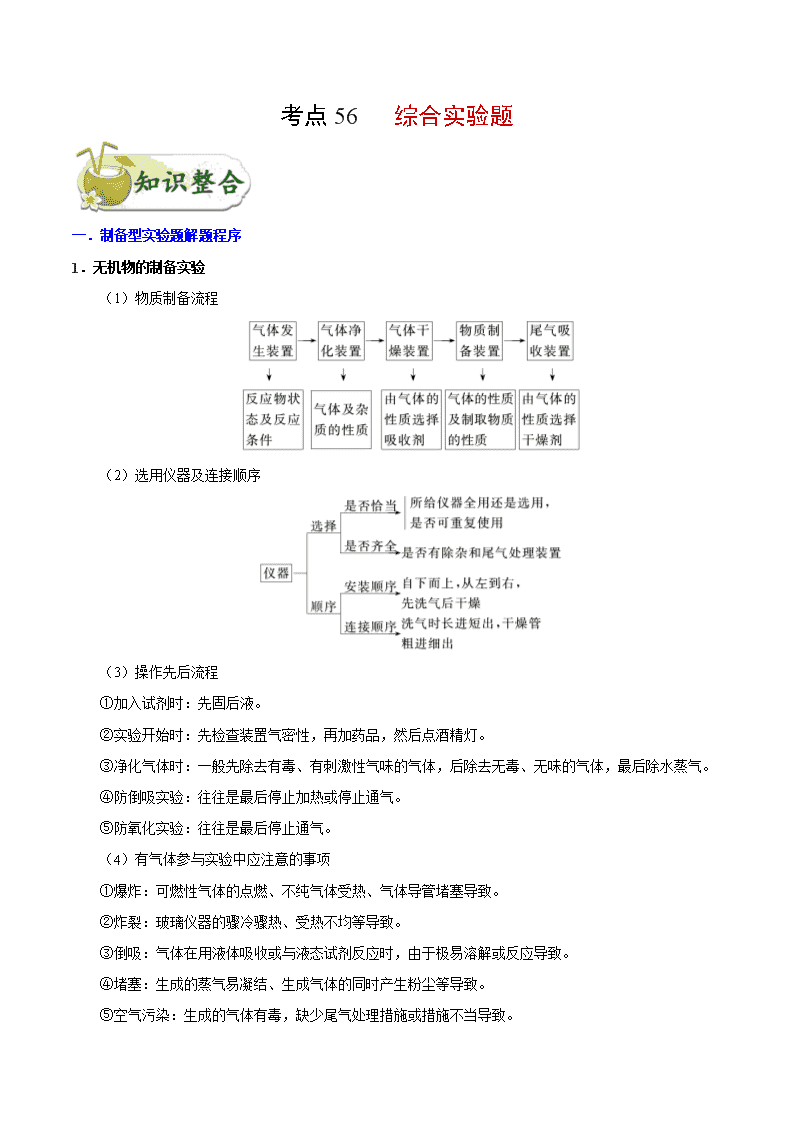
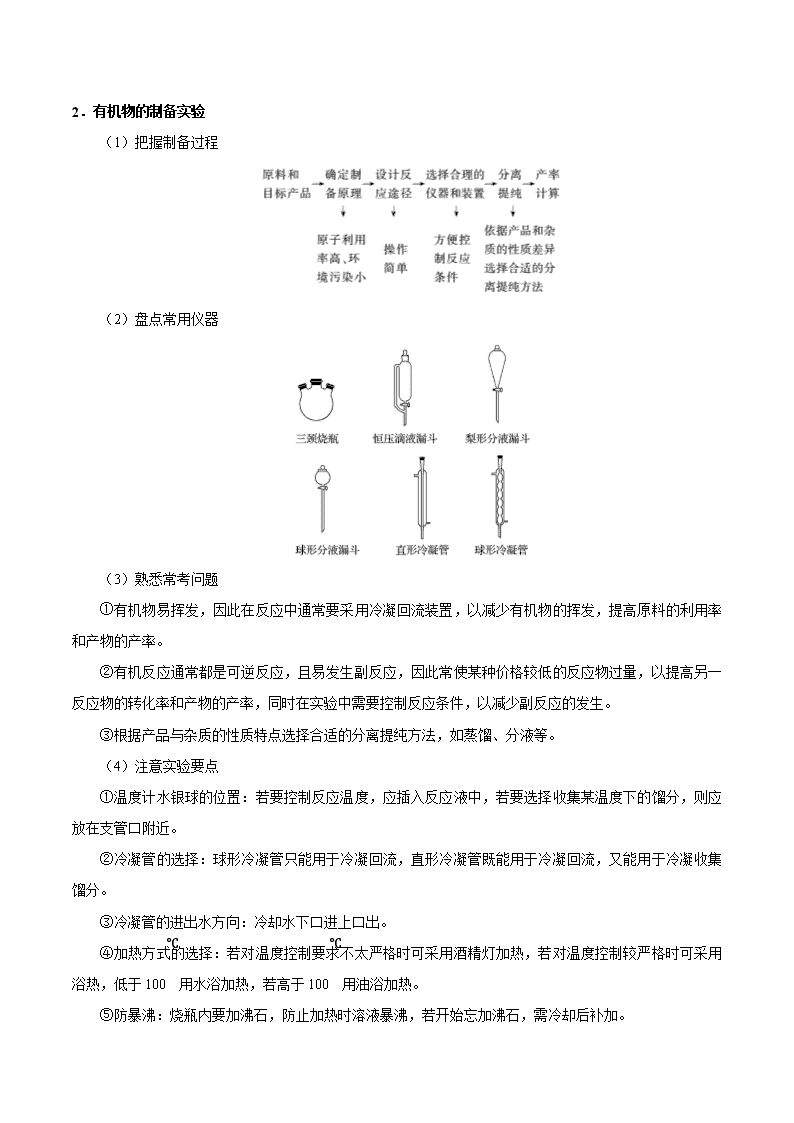
考点 56 综合实验题 一.制备型实验题解题程序 1.无机物的制备实验 (1)物质制备流程 (2)选用仪器及连接顺序 (3)操作先后流程 ①加入试剂时:先固后液。 ②实验开始时:先检查装置气密性,再加药品,然后点酒精灯。 ③净化气体时:一般先除去有毒、有刺激性气味的气体,后除去无毒、无味的气体,最后除水蒸气。 ④防倒吸实验:往往是最后停止加热或停止通气。 ⑤防氧化实验:往往是最后停止通气。 (4)有气体参与实验中应注意的事项 ①爆炸:可燃性气体的点燃、不纯气体受热、气体导管堵塞导致。 ②炸裂:玻璃仪器的骤冷骤热、受热不均等导致。 ③倒吸:气体在用液体吸收或与液态试剂反应时,由于极易溶解或反应导致。 ④堵塞:生成的蒸气易凝结、生成气体的同时产生粉尘等导致。 ⑤空气污染:生成的气体有毒,缺少尾气处理措施或措施不当导致。 2.有机物的制备实验 (1)把握制备过程 (2)盘点常用仪器 (3)熟悉常考问题 ①有机物易挥发,因此在反应中通常要采用冷凝回流装置,以减少有机物的挥发,提高原料的利用率 和产物的产率。 ②有机反应通常都是可逆反应,且易发生副反应,因此常使某种价格较低的反应物过量,以提高另一 反应物的转化率和产物的产率,同时在实验中需要控制反应条件,以减少副反应的发生。 ③根据产品与杂质的性质特点选择合适的分离提纯方法,如蒸馏、分液等。 (4)注意实验要点 ①温度计水银球的位置:若要控制反应温度,应插入反应液中,若要选择收集某温度下的馏分,则应 放在支管口附近。 ②冷凝管的选择:球形冷凝管只能用于冷凝回流,直形冷凝管既能用于冷凝回流,又能用于冷凝收集 馏分。 ③冷凝管的进出水方向:冷却水下口进上口出。 ④加热方式的选择:若对温度控制要求不太严格时可采用酒精灯加热,若对温度控制较严格时可采用 浴热,低于 100℃用水浴加热,若高于 100℃用油浴加热。 ⑤防暴沸:烧瓶内要加沸石,防止加热时溶液暴沸,若开始忘加沸石,需冷却后补加。 二.探究型实验的基本程序 (1)解答探究型实验题的基本程序可用以下流程图表示: ①提出问题 要提出问题,首先得发现问题,对题给信息进行对比、质疑,通过思考提出值得探究的问题。此外, 实验中出现的特殊现象也是发现问题、提出问题的重要契机。 ②提出猜想 所谓猜想就是根据已有知识对问题的解决提出的几种可能的情况。有一些问题,结论有多种可能(这就 是猜想),只能通过实验进行验证。 ③设计验证方案 提出猜想后,就要结合题给条件,设计出科合理、安全的实验方案,对可能的情况进行探究。实验设 计中,关键点是对试剂的选择和实验条件的调控。 ④观察实验现象,得出结论 根据设计的实验方案,根据实验现象进行推理分析或计算分析得出结论。 (2)整体思路 ①明确目标,根据题目要求,找出该题需要解决的最终目标。 ②分析问题,根据上述目标,结合题目所给信息,分析解决该问题可能涉及的所学知识,即利用所学 知识,分析解决该问题。 ③注意细节,在解决该类问题时,注意分析实验原理是否正确可行,实验操作是否安全合理,实验步 骤是否简单方便,实验现象是否突出明显。 三.定量测定数据的方法和过程分析 1.掌握五种数据的测定方法 (1)测沉淀质量法 先将某种成分转化为沉淀,然后称量纯净、干燥的沉淀的质量,再进行相关计算。 (2)测气体体积法 对于产生气体的反应,可以通过测定气体体积的方法测定样品纯度。 常见的量气装置:A 是常规的量气装置,B、C、D 是改进后的量气装置。 (3)测气体质量法 将生成的气体通入足量的吸收剂中,通过称量实验前后吸收剂的质量,求得所吸收气体的质量,然后 进行相关计算。 (4)滴定法 即利用滴定操作原理,通过酸碱中和滴定、沉淀滴定和氧化还原反应滴定等获得相应数据后再进行相 关计算。 (5)热重法 只要物质受热时发生质量变化,都可以用热重法来研究物质的组成。热重法是在控制温度的条件下, 测量物质的质量与温度关系的方法。通过分析热重曲线,我们可以知道样品及其可能产生的中间产物的组 成、热稳定性、热分解情况及生成产物等与质量相联系的信息。 2.明确常考的定量实验 (1)一定物质的量浓度溶液的配制与溶液稀释的操作方法和简单计算; (2)酸碱中和滴定的操作方法与滴定曲线的绘制; (3)中和热的测定原理、方法; (4)硫酸铜晶体中结晶水含量的测定; (5)物质的质量、液体或气体体积、溶液 pH 的测定方法,其他定量实验的数据处理等。 3.掌握常见考查方法 从高考命题来看,定量实验主要包含两种类型:一是含量测定,二是物质组成测定。这些测定都是以 上五大定量实验知识的迁移和应用,主要包含定量实验原理、数据处理、误差分析等。实验设计中的误差 分析,可从两方面来考虑,一是外界环境(H2O、CO2、O2 等)对该实验的影响而产生误差;二是实验操作中, 由于操作不当引起的误差。如果是分析最终结果的误差,应通过最后得出的表达式来观察哪些物理量发生 了变化,从而得出实际误差情况。 考向一 制备型实验题 典例 1 氯化亚砜(SOCl2)常用于医药、农药、染料工业,也可在有机合成工业中作氯化剂。已知:SOCl2 的相关性质如下表所示: 颜色、状态 熔点 沸点 腐蚀性 水解 无色或微黄液体 -105℃ 78℃ 强 极易水解 现利用如图装置制备 SOCl2。 请回答下列问题: Ⅰ.制备 SO2 和 Cl2。 (1)本实验选用装置甲制备 SO2 和 Cl2,装置甲中仪器 x 的名称为_________;若以 KMnO4 和浓盐酸 反应制备 Cl2,反应的离子方程式为_______________。 Ⅱ.制备 SOCl2。 以活性炭作为催化剂,SO2 和 C12 可以和 S 粉在 180~200℃时反应合成 SOCl2,选用装置 A、B、C、D 进行制备(夹持、加热装置略去)。 (2)按气流从左到右的方向,装置 A、B、C、D 的连接顺序为_________(填仪器接口的字母编号)。 (3)试剂 y 为_________(填选项字母,下同);试剂 z 为____________。 A.热水 B.乙醇 C.石蜡油 D.冰水 (4)装置 A 中 U 形管内发生反应的化学方程式为__________________。 (5)装置 C 的作用为____________;若装置 A 处通入的 SO2 和 Cl2 的物质的量之比为 1:3,则装置 C 中生成的盐为______(填化学式);请设计实验验证装置 C 中生成的盐中含有 SO42-:_____________。 考向二 探究型实验 典例 2 1.某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到 Fe3+,发现和探究过程如下。 向硝酸酸化的 0.05 mol·L-1 硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体, 溶液呈黄色。 (1)检验产物 ①取少量黑色固体,洗涤后,_______(填操作和现象),证明黑色固体中含有 Ag。 ②取上层清液,滴加 K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有_______________。 (2)针对“溶液呈黄色”,甲认为溶液中有 Fe3+,乙认为铁粉过量时不可能有 Fe3+,乙依据的原理是 ___________________(用离子方程式表示)。针对两种观点继续实验: ①取上层清液,滴加 KSCN 溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜 色变浅、沉淀量多少与取样时间有关,对比实验记录如下: 序号 取样时间/min 现象 ⅰ 3 产生大量白色沉淀;溶液呈红色 ⅱ 30 产生白色沉淀;较 3 min 时量少;溶液红色较 3 min 时 加深 ⅲ 120 产生白色沉淀;较 30 min 时量少;溶液红色较 30 min 时变浅 (资料:Ag+与 SCN-生成白色沉淀 AgSCN) ② 对 Fe3+产生的原因作出如下假设: 假设 a:可能是铁粉表面有氧化层,能产生 Fe3+; 假设 b:空气中存在 O2,由于________(用离子方程式表示),可产生 Fe3+; 假设 c:酸性溶液中 NO3-具有氧化性,可产生 Fe3+; 假设 d:根据_______现象,判断溶液中存在 Ag+,可产生 Fe3+。 ③ 下列实验Ⅰ可证实假设 a、b、c 不是产生 Fe3+的主要原因。实验Ⅱ可证实假设 d 成立。 实验Ⅰ:向硝酸酸化的________溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴 加 KSCN 溶液,3 min 时溶液呈浅红色,30 min 后溶液几乎无色。 实验Ⅱ:装置如图。其中甲溶液是________,操作及现象是________________。 (3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中 Fe3+浓度变化的原因:______。 考向三 定量分析究实验题 典例 3 为测定某氟化稀土样品中氟元素的质量分数进行如下实验。利用高氯酸(高沸点酸)将样品中的氟元 素转化为氟化氢(低沸点酸)蒸出,再通过滴定测量。实验装置如图所示。 (1)a 的作用是________,d 的名称是__________。 (2)检查装置气密性:________________________________________________(填操作),关闭 k,微 热 c,导管 e 末端有气泡冒出;停止加热,导管 e 内有一段稳定的水柱,说明装置气密性良好。 (3)c 中加入一定体积高氯酸和 m g 氟化稀土样品,f 中盛有滴加酚酞的 NaOH 溶液。加热 b、c,使 b 中产生的水蒸气进入 c。 ①下列物质可代替高氯酸的是________(填序号)。 A.硝酸 B.盐酸 C.硫酸 D.磷酸 ②实验中除有 HF 气体外,可能还有少量 SiF4(易水解)气体生成。若有 SiF4 生成,实验结果将________ (填“偏高”“偏低”或“不受影响”)。 ③若观察到 f 中溶液红色褪去,需要向 f 中及时补加 NaOH 溶液,否则会使实验结果偏低,原因是 ____________________________________________。 (4)向馏出液中加入 V1mL c1mol·L-1La(NO3)溶液,得到 LaF3 沉淀,再用 c2mol·L-1EDTA 标准溶液滴 定剩余 La3+(La3+与 EDTA 按 1∶1 络合),消耗 EDTA 标准溶液 V2mL,则氟化稀土样品中氟的质量分 数为________。 (5)用样品进行实验前,需要用 0.084 g 氟化钠代替样品进行实验,改变条件(高氯酸用量、反应温度、 蒸馏时间),测量并计算出氟元素质量,重复多次。该操作的目的是________________。 1.为测定某铁碳合金中铁的质量分数,并探究铁与浓硫酸的反应设计了图示实验装置。 (1)在装药品开始实验前要进行的操作是_____ (2)a 克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A 无明显现象,其原因是常温下①_____;② _____。 (3)写出加热时 A 中碳与浓硫酸发生反应的化学方程式_____。 (4)B 中的现象是:_____;C 的作用是:_____。 (5)待 A 中不再逸出气体时,停止加热,拆下 E 并称重,E 增重 bg。则铁碳合金中铁的质量分数为 _____(写含 a、b 的表达式)。 (6)经测定,(5)中测得结果偏小,原因可能是_____。 2.无水 MgBr2 可用作催化剂,实验室采用镁屑与液溴为原料制备无水 MgBr2,装置如图 1,主要步骤 如下: 步骤 1 三颈瓶中装入 10 g 镁屑和 150 mL 无水乙醚;装置 B 中加入 15 mL 液溴。 步骤 2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。 步骤 3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至 0 ℃,析出晶体,再过 滤得三乙醚合溴化镁粗品。 步骤 4 室温下用苯溶解粗品,冷却至 0 ℃,析出晶体,过滤、洗涤得三乙醚合溴化镁,加热至 160 ℃ 分解得无水 MgBr2 产品。 已知:①Mg 与 Br2 反应剧烈放热;MgBr2 具有强吸水性。 ②MgBr2+3C2H5OC2H5 MgBr2·3C2H5OC2H5 请回答: (1)仪器 A 的名称是________。实验中不能用干燥空气代替干燥 N2,原因是 _____________________________________________________________________。 (2)如将装置 B 改为装置 C(图 2),可能会导致的后果是_______________________。 (3)步骤 3 中,第一次过滤除去的物质是________。 (4)有关步骤 4 的说法,正确的是________。 A.可用 95%的乙醇代替苯溶解粗品 B.洗涤晶体可选用 0 ℃的苯 C.加热至 160 ℃的主要目的是除去苯 D.该步骤的目的是除去乙醚和可能残留的溴 (5)为测定产品的纯度,可用 EDTA(简写为 Y4-)标准溶液滴定,反应的离子方程式:Mg2++Y4-===MgY2 -。 ①滴定前润洗滴定管的操作方法是____________________________________。 ②测定时,先称取 0.250 0 g 无水 MgBr2 产品,溶解后,用 0.050 0 mol·L-1 的 EDTA 标准溶液滴定至终 点,消耗 EDTA 标准溶液 26.50 mL,则测得无水 MgBr2 产品的纯度是________(以质量分数表示)。 3.在梨、香蕉等水果中存在着乙酸正丁酯。实验室制备乙酸正丁酯的反应、装置示意图和有关数据如下: 水中溶解性 密度(g·cm-3) 沸点 相对分子质量 乙酸 溶于水 1.049 2 118 60 正丁醇 微溶于水 0.809 8 117.7 74 乙酸正丁酯 微溶于水 0.882 4 126.5 116 实验步骤: Ⅰ.乙酸正丁酯的制备 在 A 中加入 7.4 g 正丁醇、6.0 g 乙酸,再加入数滴浓硫酸,摇匀,放入 1~2 颗沸 石。按图安装带分水器的回流反应装置,并在分水器中预先加入水,使水面略低于分水器的支管口,通入 冷凝水,缓慢加热 A。在反应过程中,通过分水器下部的旋塞分出生成的水,保持分水器中水层液面的高 度不变,使油层尽量回到圆底烧瓶中。反应达到终点后,停止加热,记录分出水的体积。 Ⅱ.产品的精制 把分水器中的酯层和 A 中反应液倒入分液漏斗中,分别用少量水、饱和碳酸钠溶液和水洗涤,分出的 产物加入少量无水硫酸镁固体,静置后过滤,将产物常压蒸馏,收集 124-126 ℃的馏分,得到 5.8 g 产品。 请回答下列问题: (1)冷水应从冷凝管的________(填“a”或“b”)口通入。 (2)产品的精制过程中,第一次水洗的目的是________________,第二次水洗的目的是 ________________,洗涤完成后将有机层从分液漏斗的________(填“上口”或“下口”)转移到锥形瓶中。 (3)本实验提高产品产率的方法是_________________________________________。 (4)判断反应终点的依据是_______________________________________________。 (5)该实验过程中,生成乙酸正丁酯的产率是_______________________________。 4.化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究: 查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。 I、摩擦剂中氢氧化铝的定性检验 取适量牙膏样品,加水搅拌、过滤。并进行如下实验 (1)请完成表格中的填空: 实验步骤 实现现象 反应的离子方程式 往滤渣中加入过量 NaOH 溶液。 ①______________ 过滤,往所得滤液中 通入过量二氧化碳, ②_________ ③______________ 继续加入过量稀盐酸 ④_________ II、牙膏样品中碳酸钙的定量测定 利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定 C 中生成的 BaCO3 沉淀质量,以确 定碳酸钙的质量分数。 依据实验过程回答下列问题: (2)实验过程中先后两次鼓入空气,第二次鼓入空气的目的是:______。 (3)C 中反应生成 BaCO3 的化学方程式是_________________。 (4)下列各项措施中,不能提高测定准确度的是________(填标号)。 A.在加入盐酸之前,应排净装置内的 CO2 气体 B.滴加盐酸不宜过快 C.在 A—B 之间增添盛有浓硫酸的洗气装置 D.在 B—C 之间增添盛有饱和碳酸氢钠溶液的洗气装置 (5)、实验中准确称取 8.00g 样品三份,进行三次测定,测得 BaCO3 平均质量为 3.94g。则样品中碳酸钙的 质量分数为_______。 (6)某同学提出将 C 中的 Ba(OH)2 换成浓 H2SO4,通过测定 D 装置反应前后的质量差也可以测定 CaCO3 的含量,假设反应前 D 装置的质量为 m1,实验结束后 D 装置的质量为 m2,则样品中 CaCO3 的质量为_______。 实验证明按此测定的结果偏高,原因是______。 5.二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。 查阅资料可知 S2Cl2 具有下列性质: 物理性质 毒性 色态 挥发性 熔点 沸点 剧毒 金黄色液体 易挥发 -76℃ 138℃ 化学性质 ①300℃以上完全分解; ②S2Cl2+Cl2 2SCl2; ③遇高热或与明火接触,有引起燃烧的危险; ④受热或遇水分解放热,放出腐蚀性烟气; Ⅰ.制取少量 S2Cl2 实验室可利用硫与少量氯气在 110~140℃反应制得 S2Cl2 粗品。 (1)仪器 m 的名称为___,装置 A 中发生反应的离子方程式为 ______________。 (2)装置连接顺序:A→___→___→___→E→D。______________ (3)为了提高 S2Cl2 的纯度,实验的关键是控制好温度和__________________。 (4)若 D 中所装试剂为碱石灰,则该装置的作用为______________。 II.测定产品中 SO2Cl2 的含量,实验步骤如下: ①取 1.8g 产品加入足量 Ba(OH)2 溶液,充分振荡、过滤、洗涤,将所得溶液均放入锥形瓶中; ②向锥形瓶中加入硝酸酸化,再加入 0.2000mol·L-1 的 AgNO3 溶液 l00.00mL; ③向其中加入 2mL 硝基苯,用力摇动,使沉淀表面被有机物覆盖; ④加入 NH4Fe(SO4)2 指示剂,用 0.1000mol·L-1NH4SCN 溶液滴定过量 Ag+,终点所用体积为 10.00mL。 已知:Ksp(AgCl)=3.2×10-10 ;Ksp(AgSCN)=2×10-12 (5)滴定终点的现象为_____________________________。 (6)产品中 SO2Cl2 的质量分数为__________,若步骤③不加入硝基苯则所测 SO2Cl2 含量将________(填“偏 高”、“偏低”或“无影响”)。 1.[2020 新课标 I 卷]为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。 回答下列问题: (1)由 FeSO4·7H2O 固体配制 0.10 mol·L−1 FeSO4 溶液,需要的仪器有药匙、玻璃棒、_________(从下列图中 选择,写出名称)。 (2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电 迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择____________作为电解质。 阳离子 u∞×108/(m2·s−1·V−1) 阴离子 u∞×108/(m2·s−1·V−1) Li+ 4.07 3HCO 4.61 Na+ 5.19 3NO 7.40 Ca2+ 6.59 Cl− 7.91 K+ 7.62 2 4SO 8.27 (3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入________电极溶液中。 (4)电池反应一段时间后,测得铁电极溶液中 c(Fe2+)增加了 0.02 mol·L−1。石墨电极上未见 Fe 析出。可知, 石墨电极溶液中 c(Fe2+)=________。 (5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为_______,铁电极的电极反应式为_______。因此, 验证了 Fe2+氧化性小于________,还原性小于________。 (6)实验前需要对铁电极表面活化。在 FeSO4 溶液中加入几滴 Fe2(SO4)3 溶液,将铁电极浸泡一段时间,铁电 极表面被刻蚀活化。检验活化反应完成的方法是_______。 2.[2020 新课标 II 卷]苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下: +KMnO4→ + MnO2 +HCl→ +KCl 名称 相对分 子质量 熔点/℃ 沸点/℃ 密度 /(g·mL−1) 溶解性 甲苯 92 −95 110.6 0.867 不溶于水,易溶于 乙醇 苯甲 酸 122 122.4(100℃左右 开始升华) 248 —— 微溶于冷水,易溶 于乙醇、热水 实验步骤: (1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入 1.5 mL 甲苯、100 mL 水和 4.8 g(约 0.03 mol)高锰酸钾, 慢慢开启搅拌器,并加热回流至回流液不再出现油珠。 (2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物 趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出 完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为 1.0 g。 (3)纯度测定:称取 0. 122 g 粗产品,配成乙醇溶液,于 100 mL 容量瓶中定容。每次移取 25. 00 mL 溶液, 用 0.01000 mol·L−1 的 KOH 标准溶液滴定,三次滴定平均消耗 21. 50 mL 的 KOH 标准溶液。 回答下列问题: (1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为______(填标号)。 A.100 mL B.250 mL C.500 mL D.1000 mL (2)在反应装置中应选用______冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其 判断理由是______。 (3)加入适量饱和亚硫酸氢钠溶液的目的是___________;该步骤亦可用草酸在酸性条件下处理,请用反应的 离子方程式表达其原理__________。 (4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是_______。 (5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是_______。 (6)本实验制备的苯甲酸的纯度为_______;据此估算本实验中苯甲酸的产率最接近于_______(填标号)。 A.70% B.60% C.50% D.40% (7)若要得到纯度更高的苯甲酸,可通过在水中__________的方法提纯。 3.[2020 新课标Ⅲ]氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部 分装置省略)制备 KClO3 和 NaClO,探究其氧化还原性质。 回答下列问题: (1)盛放 MnO2 粉末的仪器名称是________,a 中的试剂为________。 (2)b 中采用的加热方式是_________,c 中化学反应的离子方程式是________________,采用冰水浴冷却的 目的是____________。 (3)d 的作用是________,可选用试剂________(填标号)。 A.Na2S B.NaCl C.Ca(OH)2 D.H2SO4 (4)反应结束后,取出 b 中试管,经冷却结晶,________,__________,干燥,得到 KClO3 晶体。 (5)取少量 KClO3 和 NaClO 溶液分别置于 1 号和 2 号试管中,滴加中性 KI 溶液。1 号试管溶液颜色不变。2 号试管溶液变为棕色,加入 CCl4 振荡,静置后 CCl4 层显____色。可知该条件下 KClO3 的氧化能力 ____NaClO(填“大于”或“小于”)。 4.[2019 新课标Ⅱ] 咖啡因是一种生物碱(易溶于水及乙醇,熔点 234.5℃,100℃以上开始升华),有兴奋 大脑神经和利尿等作用。茶叶中含咖啡因约 1%~5%、单宁酸(Ka 约为 10−6,易溶于水及乙醇)约 3%~10%, 还含有色素、纤维素等。实验室从茶叶中提取咖啡因的流程如下图所示。 索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管 2 上升至球形冷凝管,冷凝后滴 入滤纸套筒 1 中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管 3 顶端时,经虹吸管 3 返回烧瓶, 从而实现对茶叶末的连续萃取。回答下列问题: (1)实验时需将茶叶研细,放入滤纸套筒 1 中,研细的目的是______________,圆底烧瓶中加入 95% 乙醇为溶剂,加热前还要加几粒______________。 (2)提取过程不可选用明火直接加热,原因是______________,与常规的萃取相比,采用索氏提取器的 优点是______________。 (3)提取液需经“蒸馏浓缩”除去大部分溶剂。与水相比,乙醇作为萃取剂的优点是______________。“蒸 馏浓缩”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管之外,还有______________(填标号)。 A.直形冷凝管 B.球形冷凝管 C.接收瓶 D.烧杯 (4)浓缩液加生石灰的作用是中和_______和吸收_______。 (5)可采用如图所示的简易装置分离提纯咖啡因。将粉状物放入蒸发皿中并小火加热,咖啡因在扎有小 孔的滤纸上凝结,该分离提纯方法的名称是______________。 5.[2019新课标Ⅲ]乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司 匹林的一种方法如下: 水杨酸 醋酸酐 乙酰水杨酸 熔点/℃ 157~159 -72~-74 135~138 相对密度/(g·cm﹣3) 1.44 1.10 1.35 相对分子质量 138 102 180 实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70 ℃左右,充分反应。稍冷后进行如下操作。 ①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。 ②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。 ③滤液用浓盐酸酸化后冷却、过滤得固体。 ④固体经纯化得白色的乙酰水杨酸晶体5.4 g。 回答下列问题: (1)该合成反应中应采用__________加热。(填标号) A.热水浴 B.酒精灯 C.煤气灯 D.电炉 (2)下列玻璃仪器中,①中需使用的有________(填标号),不需使用的_______________________(填 名称)。 (3)①中需使用冷水,目的是______________________________________。 (4)②中饱和碳酸氢钠的作用是_________________________________,以便过滤除去难溶杂质。 (5)④采用的纯化方法为____________。 (6)本实验的产率是_________%。 6.[2019 天津] 环己烯是重要的化工原料。其实验室制备流程如下: 回答下列问题: Ⅰ.环己烯的制备与提纯 (1)原料环己醇中若含苯酚杂质,检验试剂为____________,现象为__________________。 (2)操作 1 的装置如图所示(加热和夹持装置已略去)。 ①烧瓶 A 中进行的可逆反应化学方程式为________________________,浓硫酸也可作该反应的催化剂, 选择 3 2FeCl 6H O 而不用浓硫酸的原因为________________________(填序号)。 a.浓硫酸易使原料炭化并产生 2SO b. 3 2FeCl 6H O 污染小、可循环使用,符合绿色化学理念 c.同等条件下,用 3 2FeCl 6H O 比浓硫酸的平衡转化率高 ②仪器 B 的作用为____________。 (3)操作 2 用到的玻璃仪器是____________。 (4)将操作 3(蒸馏)的步骤补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,____________,弃去前 馏分,收集 83℃的馏分。 Ⅱ.环己烯含量的测定 在一定条件下,向 ga 环己烯样品中加入定量制得的 2mol Brb ,与环己烯充分反应后,剩余的 2Br 与足 量 KI 作用生成 2I ,用 1mol Lc 的 2 2 3Na S O 标准溶液滴定,终点时消耗 2 2 3Na S O 标准溶液 mLv (以上 数据均已扣除干扰因素)。 测定过程中,发生的反应如下: ① ② 2 2Br 2KI I 2KBr ③ 2 2 2 3 2 4 6I 2Na S O 2NaI Na S O (5)滴定所用指示剂为____________。样品中环己烯的质量分数为____________(用字母表示)。 (6)下列情况会导致测定结果偏低的是____________(填序号)。 a.样品中含有苯酚杂质 b.在测定过程中部分环己烯挥发 c. 2 2 3Na S O 标准溶液部分被氧化 7.[2019 北京] 化学小组实验探究 SO2 与 AgNO3 溶液的反应。 (1)实验一:用如下装置(夹持、加热仪器略)制备 SO2,将足量 SO2 通入 AgNO3 溶液中,迅速反应, 得到无色溶液 A 和白色沉淀 B。 ①浓 H2SO4 与 Cu 反应的化学方程式是____________________________________。 ②试剂 a 是____________。 (2)对体系中有关物质性质分析得出:沉淀 B 可能为 Ag2SO3、Ag2SO4 或二者混合物。(资料:Ag2SO4 微溶于水;Ag2SO3 难溶于水) 实验二:验证 B 的成分 ①写出Ag2SO3溶于氨水的离子方程式:__________。 ②加入盐酸后沉淀 D 大部分溶解,剩余少量沉淀 F。推断 D 中主要是 BaSO3,进而推断 B 中含有 Ag2SO3。 向滤液 E 中加入一种试剂,可进一步证实 B 中含有 Ag2SO3。所用试剂及现象是__________。 (3)根据沉淀 F 的存在,推测 2- 4SO 的产生有两个途径: 途径 1:实验一中,SO2 在 AgNO3 溶液中被氧化生成 Ag2SO4,随沉淀 B 进入 D。 途径 2:实验二中, 2- 3SO 被氧化为 2- 4SO 进入 D。 实验三:探究 2- 4SO 的产生途径 ①向溶液 A 中滴入过量盐酸,产生白色沉淀,证明溶液中含有________:取上层清液继续滴加 BaCl2 溶 液,未出现白色沉淀,可判断 B 中不含 Ag2SO4。做出判断的理由:_______。 ②实验三的结论:__________。 (4)实验一中 SO2 与 AgNO3 溶液反应的离子方程式是_________________。 (5)根据物质性质分析,SO2 与 AgNO3 溶液应该可以发生氧化还原反应。将实验一所得混合物放置一 段时间,有 Ag 和 2- 4SO 生成。 (6)根据上述实验所得结论:__________________。 8.[2018 新课标Ⅰ] 醋酸亚铬[(CH3COO)2Cr·2H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分 析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬; 二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示。回答下列问题: (1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是_________。仪器 a 的名称是_______。 (2)将过量锌粒和氯化铬固体置于 c 中,加入少量蒸馏水,按图连接好装置,打开 K1、K2,关闭 K3。 ①c 中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为_________。 ②同时 c 中有气体产生,该气体的作用是_____________。 (3)打开 K3,关闭 K1 和 K2。c 中亮蓝色溶液流入 d,其原因是________ ;d 中析出砖红色沉淀。为 使沉淀充分析出并分离,需采用的操作是___________、_________、洗涤、干燥。 (4)指出装置 d 可能存在的缺点______________。 9.[2018 新课标Ⅱ]K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题: (1)晒制蓝图时,用 K3[Fe(C2O4)3]·3H2O 作感光剂,以 K3[Fe(CN)6]溶液为显色剂。其光解反应的化学 方 程 式 为 : 2K3[Fe(C2O4)3] 2FeC2O4 +3K2C2O4 +2CO2↑ ; 显 色 反 应 的 化 学 方 程 式 为 ______________。 (2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。 ①通入氮气的目的是________________________________________。 ②实验中观察到装置 B、F 中澄清石灰水均变浑浊,装置 E 中固体变为红色,由此判断热分解产 物中一定含有___________、___________。 ③为防止倒吸,停止实验时应进行的操作是_________________________________________。 ④样品完全分解后,装置 A 中的残留物含有 FeO 和 Fe2O3 ,检验 Fe2O3 存在的方法是: _____________________________________。 (3)测定三草酸合铁酸钾中铁的含量。 ①称量 m g 样品于锥形瓶中,溶解后加稀 H2SO4 酸化,用 c mol·L-1 KMnO4 溶液滴定至终点。滴 定终点的现象是___________________________。 ②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。 加稀 H2SO4 酸化,用 c mol·L-1 KMnO4 溶液滴定至终点,消耗 KMnO4 溶液 V ml。该晶体中铁的质 量分数的表达式为________________________________。 10.[2018 新课标Ⅲ] 硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol−1)可用作定影剂、还原剂。回答下列 问题: (1)已知:Ksp(BaSO4)=1.1×10−10,Ksp(BaS2O3)=4.1×10−5。市售硫代硫酸钠中常含有硫酸根杂质,选用 下列试剂设计实验方案进行检验: 试剂:稀盐酸、稀 H2SO4、BaCl2 溶液、Na2CO3 溶液、H2O2 溶液 实验步骤 现象 ①取少量样品,加入除氧蒸馏水 ②固体完全溶解得无色澄清溶液 ③___________ ④___________,有刺激性气体产生 ⑤静置,___________ ⑥___________ (2)利用 K2Cr2O7 标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下: ①溶液配制:称取 1.2000 g 某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________中溶 解,完全溶解后,全部转移至 100 mL 的_________中,加蒸馏水至____________。 ②滴定:取 0.00950 mol·L−1 的 K2Cr2O7 标准溶液 20.00 mL,硫酸酸化后加入过量 KI,发生反应: Cr2O72−+6I−+14H+ 3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应: I2+2S2O32− S4O62−+2I−。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。 平行滴定 3 次,样品溶液的平均用量为 24.80 mL,则样品纯度为_________%(保留 1 位小数)。 11.[2018 北京] 实验小组制备高铁酸钾(K2FeO4)并探究其性质。 资料:K2FeO4 为紫色固体,微溶于 KOH 溶液;具有强氧化性,在酸性或中性溶液中快速产生 O2,在 碱性溶液中较稳定。 (1)制备 K2FeO4(夹持装置略) ①A 为氯气发生装置。A 中反应方程式是________________(锰被还原为 Mn2+)。 ②将除杂装置 B 补充完整并标明所用试剂。 ③C 中得到紫色固体和溶液。C 中 Cl2 发生的反应有 3Cl2+2Fe(OH)3+10KOH 2K2FeO4+6KCl+8H2O,另外还有________________。 (2)探究 K2FeO4 的性质 ①取 C 中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液 a,经检验气体中含有 Cl2。为证明是 否 K2FeO4 氧化了 Cl-而产生 Cl2,设计以下方案: 方案Ⅰ 取少量 a,滴加 KSCN 溶液至过量,溶液呈红色。 方案Ⅱ 用 KOH 溶液充分洗涤 C 中所得固体,再用 KOH 溶液将 K2FeO4 溶出,得 到紫色溶液 b。取少量 b,滴加盐酸,有 Cl2 产生。 i.由方案Ⅰ中溶液变红可知 a 中含有______离子,但该离子的产生不能判断一定是 K2FeO4 将 Cl -氧化,还可能由________________产生(用方程式表示)。 ii.方案Ⅱ可证明 K2FeO4 氧化了 Cl-。用 KOH 溶液洗涤的目的是________________。 ②根据 K2FeO4 的制备实验得出:氧化性 Cl2________ 2 4FeO (填“>”或“<”),而方案Ⅱ实验表明, Cl2 和 2 4FeO 的氧化性强弱关系相反,原因是________________。 ③资料表明,酸性溶液中的氧化性 2 4FeO > 4MnO ,验证实验如下:将溶液 b 滴入 MnSO4 和足量 H2SO4 的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性 2 4FeO > 4MnO 。若能,请说 明理由;若不能,进一步设计实验方案。 理由或方案:________________。 12.[2018 天津] 烟道气中的 NOx 是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。 回答下列问题: Ⅰ.采样 采样步骤: ①检验系统气密性;②加热器将烟道气加热至 140℃;③打开抽气泵置换系统内空气;④采集无尘、干 燥的气样;⑤关闭系统,停止采样。 (1)A 中装有无碱玻璃棉,其作用是___________。 (2)C 中填充的干燥剂是(填序号)___________。 a.碱石灰 b.无水 CuSO4 c.P2O5 (3)用实验室常用仪器组装一套装置,其作用是与 D(装有碱液)相同,在虚线框中画出该装置的示 意图,标明气体的流向及试剂。 (4)采样步骤②加热烟道气的目的是___________。 Ⅱ.NOx 含量的测定 将 v L 气样通入适量酸化的 H2O2 溶液中,使 NOx 完全被氧化为 NO3−,加水稀释至 100.00 mL。量取 20.00 mL 该溶液,加入 v1 mL c1 mol·L−1 FeSO4 标准溶液(过量),充分反应后,用 c2 mol·L−1 K2Cr2O7 标准溶 液滴定剩余的 Fe2+,终点时消耗 v2 mL。 (5)NO 被 H2O2 氧化为 NO3−的离子方程式是___________。 (6)滴定操作使用的玻璃仪器主要有___________。 (7)滴定过程中发生下列反应: 3Fe2++NO3−+4H+ NO↑+3Fe3++2H2O Cr2O72− + 6Fe2+ +14H+ 2Cr3+ +6Fe3++7H2O 则气样中 NOx 折合成 NO2 的含量为_________mg·m−3。 (8)判断下列情况对 NOx 含量测定结果的影响(填“偏高” 、“偏低”或“无影响 ”) 若缺少采样步骤③,会使测试结果___________。 若 FeSO4 标准溶液部分变质,会使测定结果___________。 13.[2018 江苏] 3,4−亚甲二氧基苯甲酸是一种用途广泛的有机合成中间体,微溶于水,实验室可用 KMnO4 氧化 3,4−亚甲二氧基苯甲醛制备,其反应方程式为 实验步骤如下: 步骤 1:向反应瓶中加入 3,4−亚甲二氧基苯甲醛和水,快速搅拌,于 70~80 ℃滴加 KMnO4 溶液。反 应结束后,加入 KOH 溶液至碱性。 步骤 2:趁热过滤,洗涤滤饼,合并滤液和洗涤液。 步骤 3:对合并后的溶液进行处理。 步骤 4:抽滤,洗涤,干燥,得 3,4−亚甲二氧基苯甲酸固体。 (1)步骤 1 中,反应结束后,若观察到反应液呈紫红色,需向溶液中滴加 NaHSO3 溶液, 3HSO 转化 为_____________(填化学式);加入 KOH 溶液至碱性的目的是____________________________。 (2)步骤 2 中,趁热过滤除去的物质是__________________(填化学式)。 (3)步骤 3 中,处理合并后溶液的实验操作为__________________。 (4)步骤 4 中,抽滤所用的装置包括_______________、吸滤瓶、安全瓶和抽气泵。 14.[2017 新课标Ⅰ]凯氏定氮法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样 品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。已知:NH3+H3BO3=NH3·H3BO3; NH3·H3BO3+HCl= NH4Cl+ H3BO3。 回答下列问题: (1)a 的作用是_______________。 (2)b 中放入少量碎瓷片的目的是____________。f 的名称是__________________。 (3)清洗仪器:g 中加蒸馏水;打开 k1,关闭 k2、k3,加热 b,蒸气充满管路;停止加热,关闭 k1,g 中蒸馏水倒吸进入 c,原因是____________;打开 k2 放掉水,重复操作 2~3 次。 (4)仪器清洗后,g 中加入硼酸(H3BO3)和指示剂。铵盐试样由 d 注入 e,随后注入氢氧化钠溶液, 用蒸馏水冲洗 d,关闭 k3,d 中保留少量水。打开 k1,加热 b,使水蒸气进入 e。 ①d 中保留少量水的目的是___________________。 ②e 中主要反应的离子方程式为________________,e 采用中空双层玻璃瓶的作用是________。 (5)取某甘氨酸(C2H5NO2)样品 m 克进行测定,滴定 g 中吸收液时消耗浓度为 c mol·L–1 的盐酸 V mL, 则样品中氮的质量分数为_________%,样品的纯度≤_______%。 15.[2017 新课标Ⅱ]水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河 水中的溶解氧。实验步骤及测定原理如下: Ⅰ.取样、氧的固定 用溶解氧瓶采集水样。记录大气压及水体温度。将水样与 Mn(OH)2 碱性悬浊液(含有 KI)混合,反应生 成 MnO(OH)2,实现氧的固定。 Ⅱ.酸化、滴定 将固氧后的水样酸化,MnO(OH)2 被 I−还原为 Mn2+,在暗处静置 5 min,然后用标准 Na2S2O3 溶液滴定生 成的 I2(2 2 2 3S O +I2=2I−+ 2 4 6S O )。 回答下列问题: (1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是_____________。 (2)“氧的固定”中发生反应的化学方程式为_______________。 (3)Na2S2O3 溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和 ____________;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除____及二氧化碳。 (4)取 100.00 mL 水样经固氧、酸化后,用 a mol·L−1Na2S2O3 溶液滴定,以淀粉溶液作指示剂,终点现 象 为 ____________ ; 若 消 耗 Na2S2O3 溶 液 的 体 积 为 b mL , 则 水 样 中 溶 解 氧 的 含 量 为 _________mg·L−1。 (5)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测量结果偏___________。(填“高”或“低”) 16.[2017 新课标Ⅲ]绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小 组对绿矾的一些性质进行探究。回答下列问题: (1)在试管中加入少量绿矾样品,加水溶解,滴加 KSCN 溶液,溶液颜色无明显变化。再向试管中通 入空气,溶液逐渐变红。由此可知:______________、_______________。 (2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关 K1 和 K2)(设为装置 A)称重,记为 m1 g。 将样品装入石英玻璃管中,再次将装置 A 称重,记为 m2 g。按下图连接好装置进行实验。 ①仪器 B 的名称是____________________。 ②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至 A 恒 重,记为 m3 g。 a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭 K1 和 K2 d.打开 K1 和 K2,缓缓通入 N2 e.称量 A f.冷却到室温 ③根据实验记录,计算绿矾化学式中结晶水数目 x=________________(列式表示)。若实验时按 a、d 次序操作,则使 x__________(填“偏大”“偏小”或“无影响”)。 (3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置 A 接入下图所示的装置中,打开 K1 和 K2, 缓缓通入 N2,加热。实验后反应管中残留固体为红色粉末。 ①C、D 中的溶液依次为_________(填标号)。C、D 中有气泡冒出,并可观察到的现象分别为 _______________。 a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓 H2SO4 ②写出硫酸亚铁高温分解反应的化学方程式_____________________。查看更多