- 2021-04-16 发布 |
- 37.5 KB |
- 4页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习物质结构综合题作业
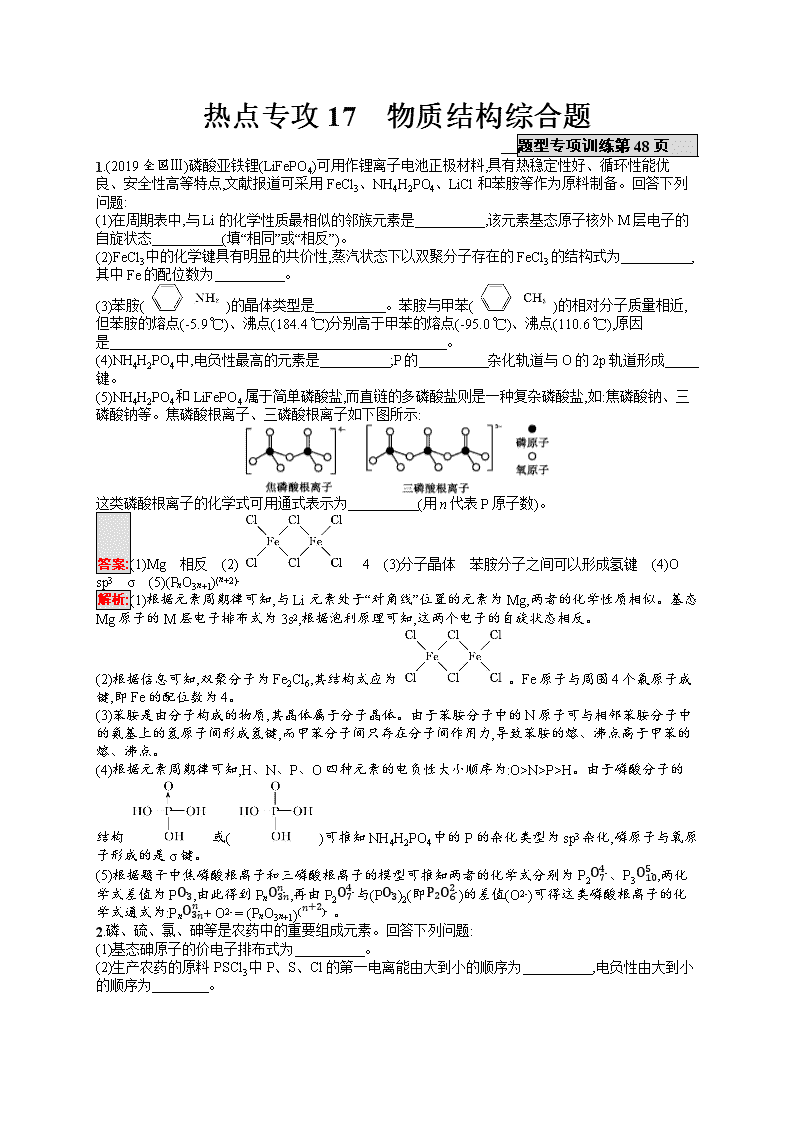
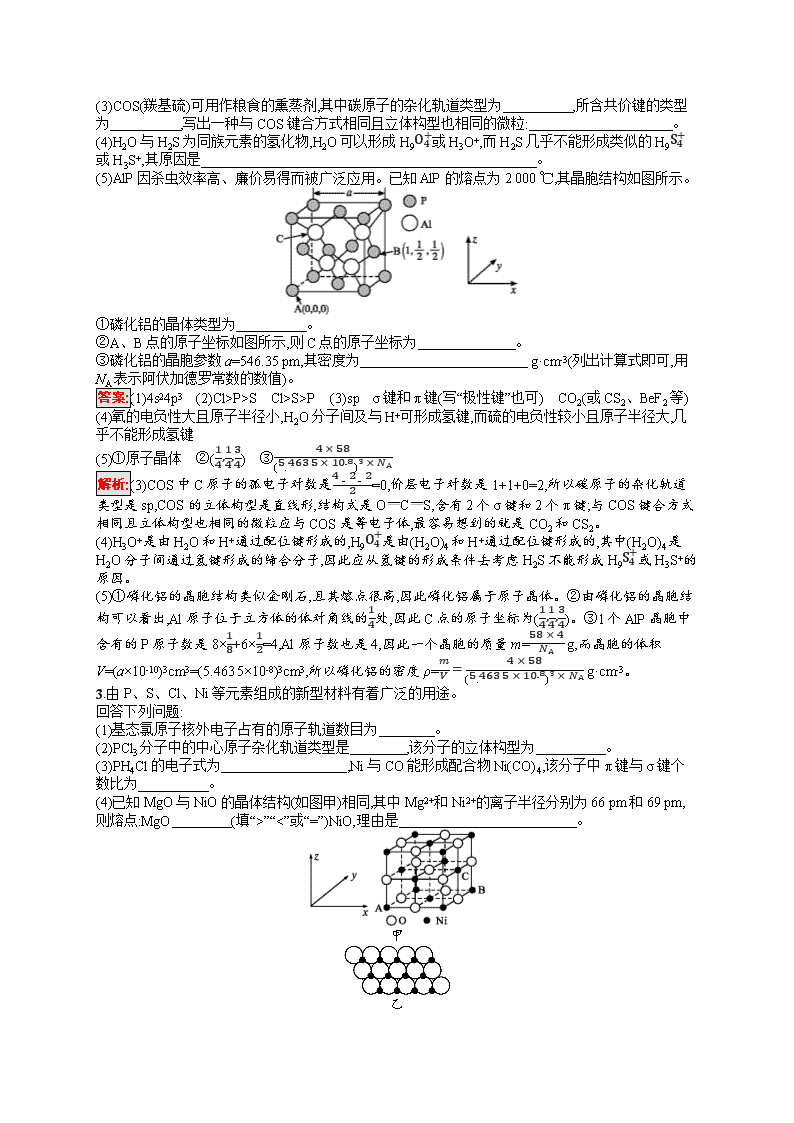
热点专攻17 物质结构综合题 题型专项训练第48页 1.(2019全国Ⅲ)磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。回答下列问题: (1)在周期表中,与Li的化学性质最相似的邻族元素是 ,该元素基态原子核外M层电子的自旋状态 (填“相同”或“相反”)。 (2)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为 ,其中Fe的配位数为 。 (3)苯胺()的晶体类型是 。苯胺与甲苯()的相对分子质量相近,但苯胺的熔点(-5.9 ℃)、沸点(184.4 ℃)分别高于甲苯的熔点(-95.0 ℃)、沸点(110.6 ℃),原因是 。 (4)NH4H2PO4中,电负性最高的元素是 ;P的 杂化轨道与O的2p轨道形成 键。 (5)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示: 这类磷酸根离子的化学式可用通式表示为 (用n代表P原子数)。 答案:(1)Mg 相反 (2) 4 (3)分子晶体 苯胺分子之间可以形成氢键 (4)O sp3 σ (5)(PnO3n+1)(n+2)- 解析:(1)根据元素周期律可知,与Li元素处于“对角线”位置的元素为Mg,两者的化学性质相似。基态Mg原子的M层电子排布式为3s2,根据泡利原理可知,这两个电子的自旋状态相反。 (2)根据信息可知,双聚分子为Fe2Cl6,其结构式应为。Fe原子与周围4个氯原子成键,即Fe的配位数为4。 (3)苯胺是由分子构成的物质,其晶体属于分子晶体。由于苯胺分子中的N原子可与相邻苯胺分子中的氨基上的氢原子间形成氢键,而甲苯分子间只存在分子间作用力,导致苯胺的熔、沸点高于甲苯的熔、沸点。 (4)根据元素周期律可知,H、N、P、O四种元素的电负性大小顺序为:O>N>P>H。由于磷酸分子的结构或()可推知NH4H2PO4中的P的杂化类型为sp3杂化,磷原子与氧原子形成的是σ键。 (5)根据题干中焦磷酸根离子和三磷酸根离子的模型可推知两者的化学式分别为P2O74-、P3O105-,两化学式差值为PO3-,由此得到PnO3nn-,再由P2O74-与(PO3-)2(即P2O62-)的差值(O2-)可得这类磷酸根离子的化学式通式为:PnO3nn-+ O2- = (PnO3n+1)(n+2)- 。 2.磷、硫、氯、砷等是农药中的重要组成元素。回答下列问题: (1)基态砷原子的价电子排布式为 。 (2)生产农药的原料 PSCl3中P、S、Cl的第一电离能由大到小的顺序为 ,电负性由大到小的顺序为 。 (3)COS(羰基硫)可用作粮食的熏蒸剂,其中碳原子的杂化轨道类型为 ,所含共价键的类型为 ,写出一种与COS键合方式相同且立体构型也相同的微粒: 。 (4)H2O与H2S为同族元素的氢化物,H2O可以形成H9O4+或H3O+,而H2S几乎不能形成类似的H9S4+或H3S+,其原因是 。 (5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2 000 ℃,其晶胞结构如图所示。 ①磷化铝的晶体类型为 。 ②A、B点的原子坐标如图所示,则C点的原子坐标为 。 ③磷化铝的晶胞参数a=546.35 pm,其密度为 g·cm-3(列出计算式即可,用NA表示阿伏加德罗常数的数值)。 答案:(1)4s24p3 (2)Cl>P>S Cl>S>P (3)sp σ键和π键(写“极性键”也可) CO2(或CS2、BeF2等) (4)氧的电负性大且原子半径小,H2O分子间及与H+可形成氢键,而硫的电负性较小且原子半径大,几乎不能形成氢键 (5)①原子晶体 ②(14,14,34) ③4×58(5.463 5×10-8)3×NA 解析:(3)COS中C原子的孤电子对数是4-2-22=0,价层电子对数是1+1+0=2,所以碳原子的杂化轨道类型是sp,COS的立体构型是直线形,结构式是OCS,含有2个σ键和2个π键;与COS键合方式相同且立体构型也相同的微粒应与COS是等电子体,最容易想到的就是CO2和CS2。 (4)H3O+是由H2O和H+通过配位键形成的,H9O4+是由(H2O)4和H+通过配位键形成的,其中(H2O)4是H2O分子间通过氢键形成的缔合分子,因此应从氢键的形成条件去考虑H2S不能形成H9S4+或H3S+的原因。 (5)①磷化铝的晶胞结构类似金刚石,且其熔点很高,因此磷化铝属于原子晶体。②由磷化铝的晶胞结构可以看出,Al原子位于立方体的体对角线的14处,因此C点的原子坐标为(14,14,34)。③1个AlP晶胞中含有的P原子数是8×18+6×12=4,Al原子数也是4,因此一个晶胞的质量m=58×4NA g,而晶胞的体积V=(a×10-10)3cm3=(5.463 5×10-8)3cm3,所以磷化铝的密度ρ=mV=4×58(5.463 5×10-8)3×NA g·cm-3。 3.由P、S、Cl、Ni等元素组成的新型材料有着广泛的用途。 回答下列问题: (1)基态氯原子核外电子占有的原子轨道数目为 。 (2)PCl3分子中的中心原子杂化轨道类型是 ,该分子的立体构型为 。 (3)PH4Cl的电子式为 ,Ni与CO能形成配合物Ni(CO)4,该分子中π键与σ键个数比为 。 (4)已知MgO与NiO的晶体结构(如图甲)相同,其中Mg2+和Ni2+的离子半径分别为66 pm和69 pm,则熔点:MgO (填“>”“<”或“=”)NiO,理由是 。 甲 乙 (5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C的坐标参数为 。 (6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-做密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为a m,每平方米面积上分散的该晶体的质量为 g(用a、NA表示,用NA表示阿伏加德罗常数的值)。 答案:(1)9 (2)sp3 三角锥形 (3)[H··H]+[··Cl······]- 1∶1 (4)> Mg2+半径比Ni2+小,MgO的晶格能比NiO大 (5)(1,12,12) (6)2532a2NA或7523a2NA 解析:(1)基态氯原子的核外电子排布式为1s22s22p63s23p5,其核外电子占有的原子轨道数为9。 (2)PCl3中P原子杂化轨道数为12×(5+3)=4,采取sp3杂化方式,有1对孤电子对,所以该分子立体构型为三角锥形。 (3)PH4Cl的电子式为[H··H]+[··Cl······]-;Ni与CO能形成配合物Ni(CO)4,该分子中Ni与C形成配位键(即σ键),CO中含有1个σ键和2个π键,则σ键个数为1×4+4=8,π键个数为2×4=8,所以个数之比为1∶1。 (4)Mg2+的半径比Ni2+小,所带电荷数相同,所以氧化镁的晶格能大于氧化镍,则熔点:MgO>NiO。 (5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),因C的x轴坐标与B的x轴坐标相同,y、z轴坐标都在棱的中点上,所以C的坐标参数为(1,12,12)。 (6)根据题图可知,每个氧化镍“分子”所占的面积为(2×a m)×(2×a m×sin 60°)=23a2 m2,则每平方米面积上含有的氧化镍“分子”个数为123a2,每个氧化镍“分子”的质量为75NA g,所以每平方米面积上含有的氧化镍的质量为75NA g×123a2=2532a2NA g。 4.氮元素是重要的非金属元素,可形成卤化物、氮化物、叠氮化物及配合物等多种化合物。 (1)NF3、NCl3、NBr3沸点由高到低的顺序是 ,这三种化合物中N原子的杂化类型是 ,分子的立体构型是 。 (2)Mg3N2遇水发生剧烈反应,生成一种有刺激性气味的气体,该反应的化学方程式为 。 (3)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-,请写出两种与N3-互为等电子体的分子: 。 (4)Fe2+、Cu2+、Co3+等过渡金属离子都能与叠氮化物、氰化物形成配合物。Fe2+的核外电子排布式为 ;配合物[Co(N3)(NH3)5]SO4中Co的配位数为 ,Co3+与NH3之间的作用是 。 (5)NaN3与KN3相比,NaN3的晶格能 (填“>”“=”或“<”)KN3的晶格能。 (6)某元素X与N形成的氮化物中,X+中K、L、M三个电子层均充满了电子,它与N3-形成晶体的结构如图所示。X+的符号是 ;晶体中与N3-距离最近的X+有 个。 答案:(1)NBr3>NCl3>NF3 sp3杂化 三角锥形 (2)Mg3N2+6H2O3Mg(OH)2+2NH3↑ (3)N2O、CO2、CS2或BeCl2(任写两种) (4)1s22s22p63s23p63d6或[Ar]3d6 6 配位键 (5)> (6)Cu+ 6 解析:(1)NF3、NCl3、NBr3均形成分子晶体,分子晶体的相对分子质量越大,分子间作用力越大,其沸点越高,则沸点:NBr3>NCl3>NF3。三种化合物中N原子均形成3个σ键,且有一对孤电子对,故N原子都采取sp3杂化,三种分子都为三角锥形结构。 (3)根据等电子体原理可知,与N3-互为等电子体的分子有N2O、CO2、CS2、BeCl2等。 (5)NaN3与KN3都为离子晶体,NaN3与KN3相比,离子半径:r(K+)>r(Na+),则NaN3的晶格能大于KN3的晶格能。 (6)X+中K、L、M三个电子层均充满了电子,X+的电子排布式为1s22s22p63s23p63d10,为Cu+。由晶胞结构可知,该晶体的配位数为6,与N3-距离最近的X+有6个。查看更多