- 2021-04-15 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018高考化学实验题瓶颈突破
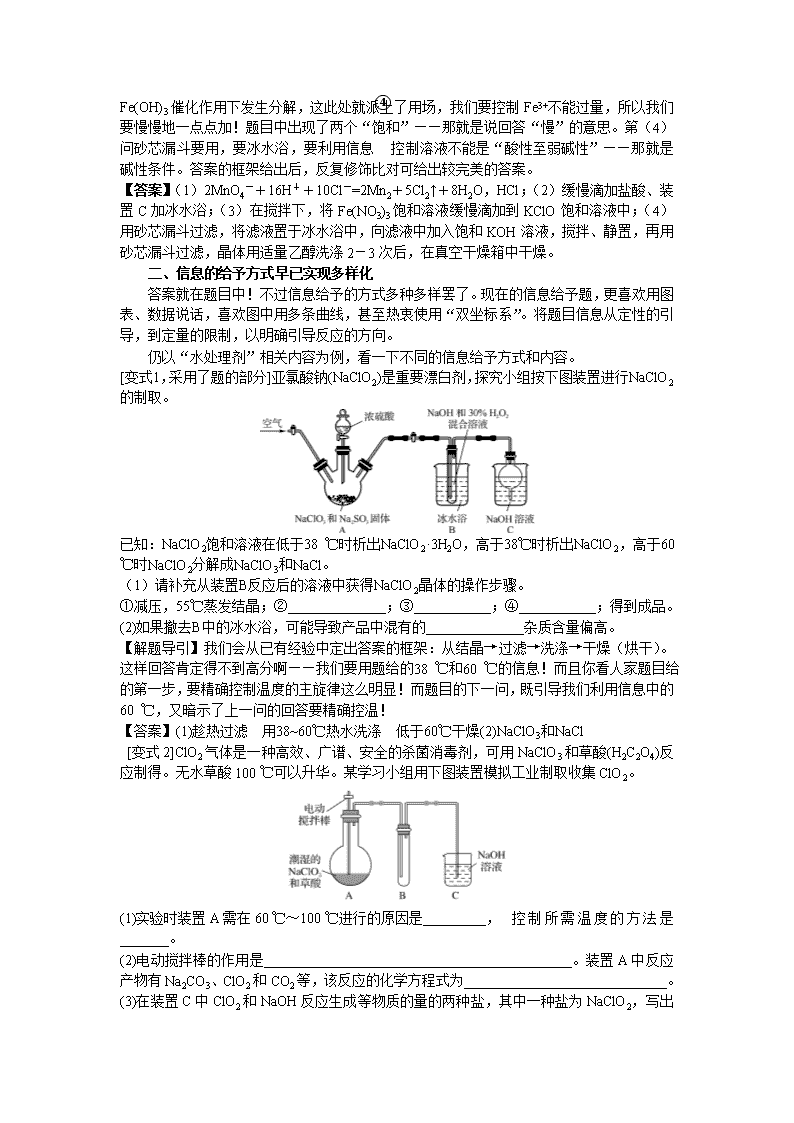
学会实验题中信息与答案的“一对一” 江苏 卢新发 目前,高考化学中“纯实验”题型,是许多学生感到头疼的题型,我们往往会做,但往往答不到点子上去。如何提高实验题的得分率,成为化学考试中能否获得高分的关键。撇开那些高深的理论不谈,我只想从做题的实战技术层面谈谈我的经验,供大家参考。大多数实验题都属于新情境给予,大量陌生的信息,有限的时间,相当于增加了试题的难度。其实,越是这样的信息类题目越好做,我们只要将题给反应新信息、性质新信息读懂理解,通过题给的限制条件的引导,“现学现卖”,一一对应地呈现在答案中即可。这时,我们需要的是只是细致、全面、严谨罢了。在整体做完实验题后,别忘了一定重新细细读题,将信息和答案一一对照核对检查,确保新信自全部用到,以使答案全面、细致、规范。 一、新信息包括新反应、新性质、限制条件 现在的化学试题,早已没有了“冗余”信息,所有的给予信息都是有用的,必须用的,都要出现在答案中。给了题目里用不到的信息,在命题时是要坚决摒弃的。这种命题上的规范和严谨,实际上给我们答案的表述指了一条明确的道路。物质陌生了,性质就陌生了,怎么办?给!所以我们就知道了该物质的氧化性、还原性,知道了该物质在酸、碱性介质中的稳定情况或性质展示,知道了该物质在不同温度下的稳定性等。而这些正是考点的落实,答案也就“水落石出”。下面以净水剂相关几道题为例,让我们一起感悟。 例1.实验室用下图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4。已知K2FeO4具有下列性质①可溶于水、微溶于浓KOH溶液,②在0℃-5℃、强碱性溶液中比较稳定,③在Fe3+和Fe(OH)3催化作用下发生分解,④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。 (1)装置A中KMnO4与盐酸反应生成MnCl2和Cl2,其离子方程式为_____________。将制备的Cl2通过装置B可除去______________(填化学式)。 (2)Cl2和KOH在较高温度下反应生成KClO3。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是_________。 (3)制备K2FeO4时,KClO饱和溶液与Fe(NO3)3饱和溶液的混合方式为_______。 (4)提纯K2FeO4粗产品[含有Fe(OH)3、KCl等杂质]的实验方案为:将一定量的K2FeO4粗产品溶于冷的3mol·L-1KOH溶液中,_____(实验中须使用的试剂有:饱和KOH溶液,乙醇;除常用仪器外须使用的仪器有:砂芯漏斗,真空干燥箱)。 【解题导引】这是2015年江苏高考题。该题第(1)问,给出了明确的反应和生成物及介质条件,先配平得失电子数,后考虑酸性介质,用H+和H2O来调配电荷守恒,最后原子守恒配平即可。除去Cl2中的HCl会考虑用饱和食盐水。此反应式学生大多见过,但以信息方式给出,彰显命题的策略。第(2)问已提醒在较高温度下会发生副反应——那就是提醒要温度不能高;不能改变KOH浓度和体积——那浓度和体积方面可改的只能是HCl了; 提示反应在控制在0℃~5℃——其实是提示使用冰水浴。限制条件使答案昭然若揭啊。第(3)问,两种溶液还有混合方式?那就是要谈“谁加入谁”的意思啊——题给信息③在Fe3+ 和Fe(OH)3催化作用下发生分解,这此处就派上了用场,我们要控制Fe3+不能过量,所以我们要慢慢地一点点加!题目中出现了两个“饱和”——那就是说回答“慢”的意思。第(4)问砂芯漏斗要用,要冰水浴,要利用信息④控制溶液不能是“酸性至弱碱性”——那就是碱性条件。答案的框架给出后,反复修饰比对可给出较完美的答案。 【答案】(1)2MnO4-+16H++10Cl-=2Mn2+5Cl2↑+8H2O,HCl;(2)缓慢滴加盐酸、装置C加冰水浴;(3)在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中;(4)用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置,再用砂芯漏斗过滤,晶体用适量乙醇洗涤2-3次后,在真空干燥箱中干燥。 二、信息的给予方式早已实现多样化 答案就在题目中!不过信息给予的方式多种多样罢了。现在的信息给予题,更喜欢用图表、数据说话,喜欢图中用多条曲线,甚至热衷使用“双坐标系”。将题目信息从定性的引导,到定量的限制,以明确引导反应的方向。 仍以“水处理剂”相关内容为例,看一下不同的信息给予方式和内容。 [变式1,采用了题的部分]亚氯酸钠(NaClO2)是重要漂白剂,探究小组按下图装置进行NaClO2的制取。 已知:NaClO2饱和溶液在低于38 ℃时析出NaClO2·3H2O,高于38℃时析出NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。 (1)请补充从装置B反应后的溶液中获得NaClO2晶体的操作步骤。 ①减压,55℃蒸发结晶;②______________;③___________;④___________;得到成品。 (2)如果撤去B中的冰水浴,可能导致产品中混有的______________杂质含量偏高。 【解题导引】我们会从已有经验中定出答案的框架:从结晶→过滤→洗涤→干燥(烘干)。这样回答肯定得不到高分啊——我们要用题给的38 ℃和60 ℃的信息!而且你看人家题目给的第一步,要精确控制温度的主旋律这么明显!而题目的下一问,既引导我们利用信息中的60 ℃,又暗示了上一问的回答要精确控温! 【答案】(1)趁热过滤 用38~60℃热水洗涤 低于60℃干燥(2)NaClO3和NaCl [变式2]ClO2气体是一种高效、广谱、安全的杀菌消毒剂,可用NaClO3和草酸(H2C2O4)反应制得。无水草酸100 ℃可以升华。某学习小组用下图装置模拟工业制取收集ClO2。 (1)实验时装置A需在60 ℃~100 ℃进行的原因是_________, 控制所需温度的方法是_______。 (2)电动搅拌棒的作用是____________________________________________。装置A中反应产物有Na2CO3、ClO2和CO2等,该反应的化学方程式为_____________________________。 (3)在装置C中ClO2和NaOH反应生成等物质的量的两种盐,其中一种盐为NaClO2 ,写出反应的离子方程式_______________________。 (4)用ClO2处理过的饮用水(pH为5.5~6.5)往往残留少量ClO2和一定量对人体不利的亚氯酸根离子(ClO)。 ①ClO2被I-还原为ClO、Cl-的转化率与溶液pH的关系如图所示 ②当pH≤2.0时,ClO也能被I-还原成Cl- ③2Na2S2O3+I2===Na2S4O6+2NaI 根据上述信息,请补充完整测定饮用水中ClO含量的实验方案: 取一定体积的饮用水,加入NaOH溶液调节pH为7.0~8.0;_________________________; 再重复上述操作1~2次,计算得出结果。 (实验中需使用的试剂:淀粉溶液、标准Na2S2O3溶液、KI溶液、稀硫酸) 【解题导引】(1)100 ℃是个明显的提示信息,别忘了叙述60 ℃以下时(低温时)的速率影响。第(2)搅拌的作用都是使混合均匀,使物质充分接触,充分快速反应等。“电动”一词提示我们要回答“充分”,题给中“潮湿”提示我们是固体,更需要充分搅拌。(3)给出了“等物质的量”,就是限制确定了氧化产物为ClO3-;(4)题目的虚实两条线,明确了此反应分两个阶段;文字信息①②③进一步明确的分段进行的思想。而且,题目给了实验开始步骤,那个pH范围是很有提示意味的。 【答案】(1)温度过低,化学反应速率较慢,温度过高草酸升华或分解 水浴加热(2)将反应物充分混合(或充分反应、或使反应物受热均匀)2NaClO3+H2C2O4Na2CO3+CO2↑+2ClO2↑+H2O (3)2ClO2+2OH-===ClO+ClO+H2O(4)加入足量KI溶液,加2滴淀粉溶液;用标准Na2S2O3溶液滴定至终点(或蓝色褪去),记录消耗标准Na2S2O3溶液的体积;加入稀硫酸调节溶液的pH≤2.0;继续用标准Na2S2O3溶液滴定至终点,记录消耗标准Na2S2O3溶液的体积 二、从定量的图表数据中找到定性的结论,明确答案的清晰走向 结合所给物质已知相关反应知识,从题目的各种限制条件、实验步骤、条件控制中,推演出新反应,从而使命题者的思路凸显,解题快捷准确。 【例3】焦亚硫酸钠(Na2S2O5)是一种食品添加剂。实验室用图1所示装置制备Na2S2O5,实验步骤如下: Ⅰ. 在Na2CO3溶液中通入SO2至pH为4.1,生成NaHSO3溶液;Ⅱ. 加碳酸钠粉末调至pH为7~8;Ⅲ. 再通SO2至pH为4.1; Ⅳ. 从过饱和溶液中析出Na2S2O5晶体。 图1 (1)制备焦亚硫酸钠总反应的化学方程式为 。 (2)Na2S2O5溶于水且与水能反应,所得溶液显酸性,其原因是 。步骤Ⅲ中测定溶液的pH的方法是 ;pH>4.1时,则产品中会有副产物,其化学式是 。 (3)利用碘量法可测定Na2S2O5产品中+4价硫的含量,实验方案:将一定量的Na2S2O5产品放入碘量瓶(带磨口塞的锥形瓶)中, ,重复如上步骤2次,记录数据。 (实验中必须使用的试剂:c1 mol·L-1标准碘溶液、c2mol·L-1标准Na2S2O3溶液、冰醋酸、淀粉溶液、蒸馏水。已知:2Na2S2O3+I2=Na2S4O6+2NaI。) (4)含铬废水中常含有六价铬[Cr(Ⅵ)]。利用Na2S2O5和FeSO4·7H2O先后分两个阶段处理含Cr2O72-的废水,实验结果见图。 实验过程中溶液的pH不断升高的原因是 。 【解题导引】实验步骤I涉及的反应为SO2+Na2CO3=Na2SO3+CO2,Na2SO3+SO2+H2O=NaHSO3,NaHSO3溶液呈酸性(pH=4.1),说明它的电离大于它的水解。实验步骤II实际是消耗NaHSO3中的H+;实验步骤Ⅲ再次生成了NaHSO3,与实验步骤I相比,大大提高了NaHSO3的量,使其达到过饱和;实验步骤Ⅳ,从过饱和NaHSO3溶液中析出r的却是Na2S2O5晶体,说明发生了反应:2NaHSO3=Na2S2O5+H2O(从化学式中原子个数易看出翻倍,从第2问的与水反应,且呈酸性,说明该反应可逆)(1)NaHSO3只是一个中间产物,总反应式从投料出发,产物为最终产物。(2)从上述反应转化中看出生成了NaHSO3,其溶液显酸性(题给的4.1可参考),pH>4.1,其实就是多方明确提示有Na2SO3。(3)“必须使用”一词实际是对方案的重要提示。(4)pH的变化总是考虑跟c(H+)或c(OH-)变化挂钩。 【答案】(1)Na2CO3+2SO2=Na2S2O5+CO2(2)Na2S2O5与水反应生成NaHSO3,NaHSO3在水中的电离程度大于水解程度,使溶液显酸性 用pH计测定 Na2SO3(3)加入一定体积的过量的c1 mol·L-1标准碘溶液,再加入适量的冰醋酸和蒸馏水,充分反应一段时间;加入淀粉溶液,用c2 mol·L-1标准Na2S2O3溶液滴定至溶液由蓝色恰好变为无色,且半分钟内不变色,读数(4)①Na2S2O5和FeSO4·7H2O与Cr2O72-反应时均消耗H+,使溶液的pH变大 学会了这种信息、限制条件与答案的“一对一”,我们用来做当前流行的“化学工艺流程图”题,也一样是得心顺手,同学们不妨一试,成就感自然爆棚。查看更多