- 2021-04-15 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学物质检验提纯分离专题有答案
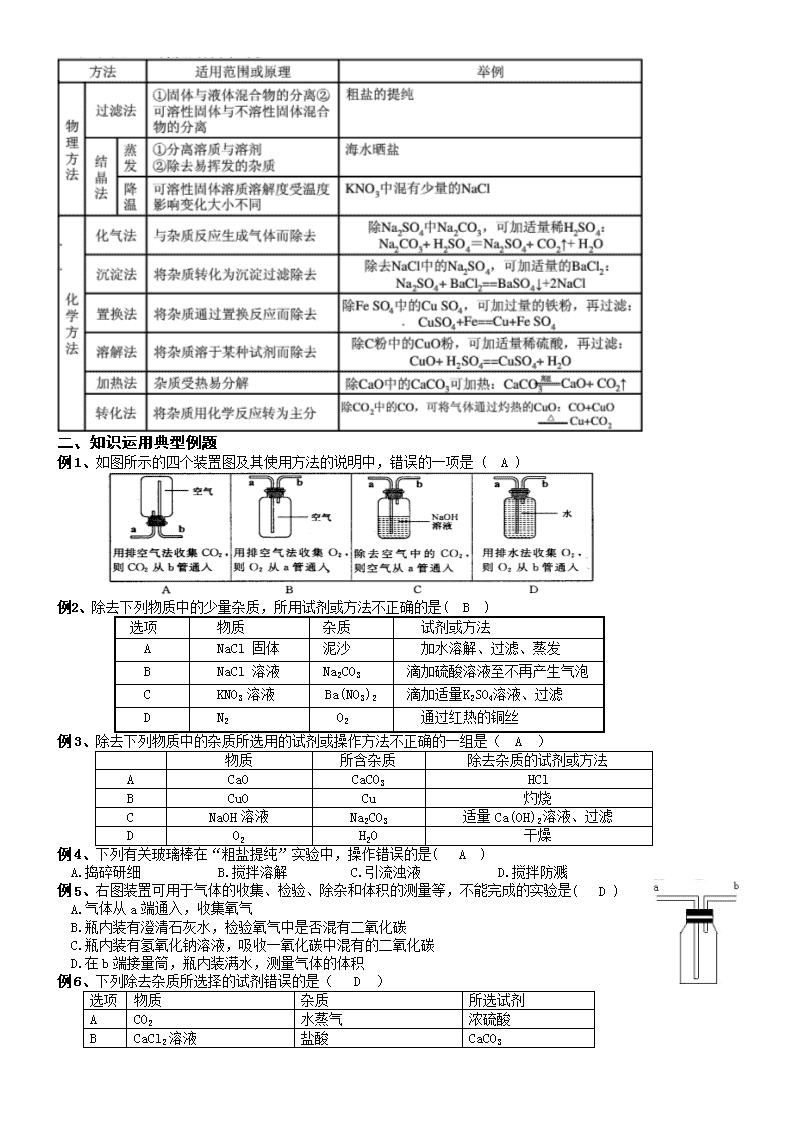
物质的分离提纯检验 一、知识要点 1、常见气体和离子的检验 2、 物质的分离提纯 基本原理 1)物质的分离是把混合物经过处理和转化分开后,要求恢复原来的状态。 2)物质的提纯只要求弃去杂质,不要求将杂质复原。在除去杂质过程中必须遵循: 不增——所选试剂不能带入新的杂质 不减——所选试剂只与杂质反应而不与被提纯的物质反应 易分——试剂与杂质反应的产物与被提纯的物质容易分离 二、知识运用典型例题 例1、如图所示的四个装置图及其使用方法的说明中,错误的一项是 ( A ) 例2、除去下列物质中的少量杂质,所用试剂或方法不正确的是( B ) 选项 物质 杂质 试剂或方法 A NaCl 固体 泥沙 加水溶解、过滤、蒸发 B NaCl 溶液 Na2C03 滴加硫酸溶液至不再产生气泡 C KNO3 溶液 Ba(N03)2 滴加适量K2SO4溶液、过滤 D N2 02 通过红热的铜丝 例3、除去下列物质中的杂质所选用的试剂或操作方法不正确的一组是( A ) 物质 所含杂质 除去杂质的试剂或方法 A CaO CaCO3 HCl B CuO Cu 灼烧 C NaOH溶液 Na2CO3 适量Ca(OH)2溶液、过滤 D O2 H2O 干燥 例4、下列有关玻璃棒在“粗盐提纯”实验中,操作错误的是( A ) A.捣碎研细 B.搅拌溶解 C.引流浊液 D.搅拌防溅 例5、右图装置可用于气体的收集、检验、除杂和体积的测量等,不能完成的实验是( D ) A.气体从a端通入,收集氧气 B.瓶内装有澄清石灰水,检验氧气中是否混有二氧化碳 C.瓶内装有氢氧化钠溶液,吸收一氧化碳中混有的二氧化碳 D.在b端接量筒,瓶内装满水,测量气体的体积 例6、下列除去杂质所选择的试剂错误的是( D ) 选项 物质 杂质 所选试剂 A CO2 水蒸气 浓硫酸 B CaCl2溶液 盐酸 CaCO3 C Cu CuO 稀盐酸 D NaCl溶液 NaOH溶液 BaCl2溶液 例7、现有①粗盐:②液态氧:③纯碱:④洁净的海水。对上述物质的分类正确的是( B ) A.盐--------① B.单质----② C.碱----③ D.纯净物----④ 例8、除去下列物质中混有的少量杂质(括号中的物质为杂质)所设计的试验方案或操作中,合理的是( A ) A.KNO3晶体(NaCl):将固体溶于水,配置成热的饱和溶液,采用降温结晶的方法 B.CO2气体(HCl):将气体通过装有NaOH溶液得洗气瓶 C.BaCl2溶液(Ba(OH)2):加入适量得稀硫酸,过滤 D.O2(N2):将混合气体通过炽热得铜网。 例9、下列几种气体可用右图所示装置干燥、收集的正确组合是( D ) ①H2 ②O2 ③CO2 ④SO2 ⑤CH4 ⑥NH3 A.①②③ B.②③⑤ C.③④⑥ D.①⑤⑥ 例10、不需加任何试剂就能鉴别出来的一组物质是( D ) A.氯化钠、硝酸铵、氯化铁三种固体 B.氢气、甲烷、一氧化碳三种气体 C.氯化铵、氢氧化钾、硝酸钠三种溶液 D.酒精、汽油、蒸馏水三种液体 例11、除去CO中少量的CO2,选用的试剂和装置均正确的是( A ) 例12、下列除去杂质的方法正确的是( D ) A.除去N2中少量的O2:通过灼热的CuO粉末 B.除去CaO中的少量CaCO3:加入足量的稀盐酸,充分反应 C.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤 D.除去Cu(NO3)2溶液中的少量Ag NO3:加入足量铜粉,充分反应后过滤 例13、为达到预期的目的,下列操作中不正确的是( D ) A.按溶解、过滤、蒸发的操作顺序可以分离CaCO3、CaCl2的混合物 B.用磷在密闭容器中燃烧,除去密闭容器内空气中的氧气 C.生活中为了降低水的硬度往往采用加热煮沸的方法 D.某同学将pH试纸润湿后,用玻璃棒蘸取食用白醋滴在试纸上,测定其pH 例14、海水是一种重要的自然资源。以下是我市对海水资源的部分利用。 (1)从海水中获取淡水。常用的操作方法是 ; (2)从海水中获得氯化钠。将海水进行 可得到粗盐; (3)从海水中得到金属镁。下图是从海水中提取镁的简单流程。 上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为 ;由无水MgCl2制取Mg的化学方程式为 。 海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同: 。 例15、某化学兴趣小组同学欲除去固体氯化钠中混有的氯化钙。设计实验方案如下,请参与实验并回答问题。 (1)写出A物质的化学式: ,写出A物质的俗称: 。 (2)写出反应②的化学方程式: 。 (3)反应①中加入过量A物质的目的是 。 反应②中如果加入盐酸也过量,则对所得到的氯化钠纯度 (填“有”或“没有”)影响。 (4)分离后所得氯化钠的质量与分离前原混合物中氯化钠的质量相比较,结果 (填“增大”、“不变”或“减小”)。 例16、化学能转化为电能,在生产、生活中有重要的应用。 I.氢氧燃料电池是符合绿色化学理念的新型电池。 右图是氢氧燃料电池的示意图,电池工作时,H2和O2反应生成水,同时提供电能,溶液的pH (填“变大”“变小”“不变”)。 Ⅱ.某学校研究小组对废干电池筒内的黑色物质(可能含有C、MnO2、ZnCl2、NH4C1等)进行研究,实验过程如下: (1)操作②的名称是 ,操作③中玻璃棒的作用是 。 (2)操作④的试管中产生的气体能使带火星的木条复燃,产生该气体的化学方程式是 。 (3)ZnCl2和NH4Cl混合溶液中含有杂质CuCl2,会加速对电池的腐蚀,欲除去Cu2+,最好选用下列试剂中的 (填序号字母)。 a.NaOH b.Zn c.Fe d.Na2CO3 例17、某学校化学兴趣小组用NaCl固体(含有的杂质CaO)来配制一定质量分数的NaCl溶液,实验的流程图如下: 请回答: (1)写出适量HCl加入到溶液B中所发生反应的化学方程式为__________________________。 (2)操作2的名称是__________,在溶液A中加入过量碳酸钠的目的是________________。 (3)若要配制100g质量分数为10%的氯化钠溶液,除了用到天平、烧杯、量筒外,还需用到的玻璃仪器是__________,其作用是______________________________。 例18、硫酸钠是制造纸浆、燃料稀释剂、医药用品等的重要原料。某硫酸钠粗品中含有少量的氯化钙、氯化镁,实验室进行提纯的流程如下: 回答下列问题: (1) 用氢氧化钠和碳酸钠除杂时,反应的化学方程式分别为 、 (2)氢氧化钠和碳酸钠如果要添加过量了,可加入适量 溶液除去。 (3)“后续处理”的主要操作时蒸发,为了获得纯净的硫酸钠,应蒸发至 (填序号)。 A.完全蒸干时停止加热 B.快干时停止加热,利用余热蒸干 C.有大量固体析出时停止加热,过滤弃去剩余的少量溶液 (4)已知硫酸钠的溶解度随温度变化的曲线如右图所示。40℃时,100g蒸馏水中溶解 g硫酸钠达到饱和。将该饱和溶液升高温度至90℃,观察到的现象是 。 例19、某化工厂排放的废液中只含有ZnCl2和CuCl2两种溶质,为回收金属Cu并得到 ZnCI2固体,化学小组的同学们设计并进行了如下实验: (1)滤液I中的溶质是 (2)B中含有的物质是 ;(3)操作③名称是 。 例20、化学是一门以实验为基础的科学。利用图中仪器和装置回答下列问题。 (1)配制一定质量分数的NaCl溶液,除需要量筒外,还需上述玻璃仪器中的_____ (填序号);用量筒量取一定体积水,读数时视线应____________________。 (2)实验室制取的CO2中常混有HCl气体,为除去CO2中少量的HCl气体,不纯的气体应从E装置____________管口进入;实验室收集二氧化碳时,可选用的收集装置是____________ (填字母代号)。 例21、某学习小组在探究“从空气中制取氮气”时,提出以下实验方案: 空气→除去二氧化碳和水蒸气→除去氧气→氮气 (1)除去二氧化碳和水蒸气:在甲装置的A中所装溶液是 。 (2)除去氧气:他们分别收集一瓶(1)中得到的气体,用图乙装置进行实验,小红选用红磷,小明选用木炭。他们俩中有一位同学选用的药品不合理,理由是 。 (3)分析误差:此法得到的氮气其密度与氮气的实际密度有误差,你认为产生误差的可能原因是(任写一种) 。 例22、A、B、C、D、E是初中化学中的五种常见物质。C、D是单质,C为紫红色固体,D被认为是最清洁的能源。B的浓溶液常用做干燥剂。已知Fe和A、B的水溶液分别能发生反应: ①Fe + A → C + E; ②Fe + B → D + E 。 (1)写出A、B、C的化学式: A , B ,C 。 (2)现有Fe和A、C三种固体组成的混合物,小刚想测定该混合物中C物质的质量分数,他设 计并完成了以下实验: 你认为,小刚的实验数据处理是否正确(填“正确”或“ 不正确”) ,理由是 。 答案:1、(1)蒸馏法(2)蒸发结晶 (3)Mg(OH)2, MgCI2 通电 Mg+Cl2↑后者是经过富集和分离后的溶液(或海水中含有氯化钠等多种溶质,氯化镁的浓度很低) 2.(1)Na2CO3,纯碱 (2)Na2CO3+2HCl=2NaCl+H2O+CO2↑ (3)使氯化钙完全反应(合理即可);没有 (4)增大 3、 I.变小 Ⅱ.(1)过滤 搅拌,防止滤渣飞溅(迸溅)(1分) 转移固体 (2) 2H2O2 == 2H2O + O2↑ (3)b 4、(1)Na2CO3+2HCl==2NaCl+H2O+CO2↑ NaOH+HCl==NaCl+H2O (2) 过滤 充分除尽溶液中的氢氧化钙 (3)玻璃棒 搅拌,加快溶液 5、(1)2NaOH+MgCl2=Mg(OH)2↓+2NaCl CaCl2+Na2CO3=CaCO3↓+2NaCl (2)稀硫酸(3)C(4)50,有晶体析出 6、(1)ZnCl2(2)Zn和Cu (3)蒸发 7、(1)②③(其余答案不得分) 与凹液面最低处相平 (2)a A 8、(1)氢氧化钠溶液(2)选用木炭燃烧又会产生新的气体杂质二氧化碳(3)装置气密性不好 9、(1)CuSO4 H2SO4 Cu (2)不正确 4.2g紫红色固体中包含有铁和硫酸铜反应生成的铜(铁和硫酸铜反应生成了铜 或 4.2g紫红色固体不只是原来的C物质 或 4.2g紫红色固体的质量大于原来C物质的质量。其它合理答案均可。没有文字说明不给分) 三、知识运用典型例题 1、用硬水洗衣服不如用软水洗得干净,下列方法可区分硬水和软水的是 ( ) A.加肥皂水 B.加氯化钠溶液 C.加稀盐酸 D.加洗洁精 2、从抹有石灰浆的墙壁上掉下的一块白色固体,为鉴定其成分,进行了如下实验: 实验步骤 实验现象 将固体研磨成粉末,加水搅拌 固体没有全部溶解 取上层清液,滴加酚酞 溶液呈红色 取不溶物,滴加稀盐酸 有气泡产生 由此得出的结论正确的是 ( ) A.一定有Ca(OH)2和CaCO3 B.一定有Ca(OH)2,可能有CaCO3 C.一定没有Ca(OH)2和CaCO3 D.一定有CaCO3,可能有Ca(OH)2 3、能用溶解、过滤、蒸发、结晶分离的一组混合物是( ) A.酒精和水 B.氯化钠和碳酸钠 C.碳酸钙和二氧化锰 D.碳酸钙和氯化钠 4、除去混入下列各组物质中的杂质,选择试剂(括号内为试剂)合理的是( ) A.氯化钠溶液中混有碳酸钠溶液(稀盐酸) B.氢氧化钠溶液中混有碳酸钠(盐酸) C.硫酸亚铁溶液中混有硫酸铜(锌粉) D.氧气中混有氮气(浓硫酸) 5、欲除去混入CO中的少量H2O、O2、CO2,所用试剂为:①热的铜网;②浓硫酸;③NaOH溶液。正确的顺序是( ) A.①②③ B.②③① C.③②① D.①③② 6、将下表内每一组无色溶液都能区别开来的试剂是 ( ) 第一组 第二组 第三组 淀粉、氯化钠 淀粉、碳酸钠 淀粉、葡萄糖 A.碘水 B.酚酞试液 C.稀盐酸 D.石蕊试液 7、鉴别下列各组物质,括号中所选择的试剂或方法错误的是 ( ) A.CuSO4溶液和KNO3溶液(观察颜色) B.硬水和软水(过滤) C.蔗糖和NH4NO3固体(水) D.汽油和蒸馏水(闻气味) 8、除去下列物质中的杂质(括号内为杂质),所选的试剂及操作方法均正确的一组( ) 选项 待提纯的物质 选用的试剂 操作的方法 A Ca(CaCO3) 水 溶解、过滤、结晶 B Cu(CuO) 稀盐酸 溶解、过滤、洗涤、干燥 C CuSO4(H2SO4) 氢氧化钠溶液 过滤 D CO2(CO) 氧气 点燃 9、下列实验的现象和结论不合理的是( ) 10、 利用化学实验可以鉴别生活中的一些物质。下表中各组物质的鉴别方法能将本组待鉴别物质都区分出来的是( ) 待鉴别的物质 鉴别方法 A 硬水、软水 加肥皂水,搅拌,观察产生泡沫多少 B N2、O2、CO2、空气 用燃着的木条检验,观察木条燃烧情况 C 棉纤维、羊毛纤维、涤纶 灼烧,闻燃烧产生的气味,观察燃烧情况 D 化肥氯化钾、硫酸钾、磷矿粉 看外观,再加水,观察是否溶于水 11、用实验方法除去下列①~④各物质中的少量杂质,限从A~D提供的试剂及操作方法中进行选择,并将其序号填在相应的短线上。 A.加适量的稀盐酸、搅拌、蒸发、结晶 B.加适量的稀盐酸、搅拌、过滤、洗涤沉淀 C.加适量水溶解、过滤、洗涤沉淀 D.加适量水溶解、过滤、蒸发 ①CaCO3中含有少量杂质NaCO3 ;②Cu粉中含有少量杂质Fe粉 ; ③CaCl2中含有少量CaCO3 ;④NaCl中含有少量杂质MnO2 。 12、下列各物质都含有少量杂质(括号内的物质为杂质),写出除去杂质的简要操作步骤和有关化学方程式。 (1)CO2(CO) ; (2)Na2SO4溶液(CuSO4) ; (3)NaCl溶液(NaOH) ; (4)ZnSO4溶液(CuSO4) 。 13、为了用含有少量CaCl2的NaCl固体样品配制溶质质量分数为a%的食盐溶液,设计了下图所示的操作方案:(已知:CaCl2+Na2CO3=CaCO3↓+2NaCl) 试回答下列问题: (1)用托盘天平称量样品时,若一开始未将游码移至标尺的零处(其他操作均正确),则称出的样品真实质量 读数质量(Wg)(用“大于”、“小于”或“等于”回答)。 (2)组成过滤装置的主要仪器是 。 (3)加过量的碳酸钠溶液是为了除尽样品中的 (填物质名称),检验其是否过量的方法是 。 (4)加入过量的盐酸是为了除去滤液中剩余的 物质,反应的化学方程式是 ,剩余的盐酸是在 (写操作名称)时除去。 (5)在蒸发操作中,液体应放在 里加热,用11g提取好的固体配制溶质质量分数为a%的实验溶液时,需加水 mL。 14、某淡黄色的颗粒状固体,其化学性质比较活泼,在通常状况下能跟许多物质发生化学反应。例如:它与CO2反应时,只生成了Na2CO3和O2,它与稀盐酸反应时,只生成了NaCl、H2O、O2。上课时,老师做了如下实验: a.取少量的淡黄色的颗粒状固体投入到盛有少量水的试管中,可观察到产生了一种无色无味的气体; b.再向试管中滴加几滴酚酞试液,可观察到烧杯中溶液变红。 根据实验现象,回答下列问题: (1)淡黄色的颗粒状固体中一定含有 元素。你做出这个判断的理由是 。 (2)实验a中产生的气体,可用 法收集。 (3)同学们对实验a中产生的气体组成看法不一,提出了以下几种假设: ①该气体是CO;②该气体是H2。 请你推测该气体还可能是 (写化学式) (4)设计一个实验,证明你在(3)中的推测(写出简要操作步骤,反应现象和结论)。 操作步骤 反应现象 结论 15、 现有失去标签的两瓶无色溶液:氯化钠溶液和稀盐酸。某化学探究小组打算用物理和化学两种方法加以区别。请回答: (1)化学方法 在不选用酸碱指示剂、pH试纸的情况下,按表中方法一(示例)填写。所选试剂必须属于不同物质类别(单质、氧化物、酸、碱、盐、有机物等) 所选试剂 判断方法 方法一 锌 取少量样品分别与锌反应,有气体产生的是稀盐酸,没有的是氯化钠溶液 方法二 方法三 (2)物理方法 同学小王使用了酒精灯和玻璃棒两种仪器,这把这两种无色溶液区分开了。请你猜测一下他的做法: 操作方法: ; 判断方法 。 16、在科学探究学习活动中,教师将三包黑色粉末(分别是细铁粉、氧化铜和二氧化锰)和在瓶无色溶液,分别发给三个学习小组进行物质鉴别等问题的探究;每组一包黑色粉末和一瓶无色溶液;各组取样放入试管中混合后,甲、乙两组都观察到有无色气体产生,丙观察到无色溶液变蓝色。请你和他们一起探究: (1)写出丙组试管中无色溶液变蓝的化学反应方程式 。 (2)请你对甲、乙两组黑色粉末和无色溶液是什么物质进行大胆猜想: 甲组:黑色粉末和无色溶液分别是 ; 乙组:黑色粉末和无色溶液分别是 。 (3)请你设计一个实验来验证甲组或乙组的黑色粉末是哪一种。 操作 现象 结论 18、某工厂的废水中只含有硫酸镁和少量硫酸,课外活动小组以此作为课题,探讨如何从中回收纯净的硫酸镁固体。他们设计了两种不同的方案,请你参与讨论: (1)方案一:选用镁粉作为试剂。①往废水中逐次加入镁粉,当观察到 时,说明加入镁粉的量已经足够。此过程发生反应的化学方程式是 。 ②接下来的操作方法依次是 和 。 (2)方案二:选用氢氧化钠溶液作为试剂。①向废水中逐滴加入氢氧化钠溶液,当 时,停止滴入氢氧化钠溶液,此过程发生反应的化学方程是 。②为了得到纯净的硫酸镁溶液,接着应进行的实验操作是 (请简要写出操作过程)。③…得到硫酸镁固体。 (3)比较两个方案,假设实验中都没有损耗,那么,最后得到的硫酸镁固体的质量是否相同? ,原因是 。 (4)请你继续探究,设计新的方案(要求使用的试剂必须是与镁粉和氢氧化钠属不同的物质类别),你选择的一种试剂是 ,该试剂发生反应的化学方程式是 。 19、一同学用某种粗盐(主要含有泥沙、CaCl2、MgCl2等物质)进行提纯实验,步骤如下图所示。 请回答下列问题: (1)步骤①和②的操作名称是 。 (2)步骤②中加入过量Na2CO3的目的是 , 步骤②中发生反应的化学方程式是 、 。 固体A中含有的固体是 (写物质的化学式) (3)步骤③中加入适量盐酸的目的是 ,判断加入盐酸“适量”的方法是 。 (4)步骤④蒸发液体时要用玻璃棒不断搅拌液体,目的是 。 20、某研究性学习小组设计的实验装置(如右图),既可用于 制取气体,又可用于验证物质性质。 (1)写出仪器A和B的名称: A: ;B: 。 (2)当打开K1、关闭K2时,利用Ⅰ、Ⅱ装置可直接进行的实验是 (填序号)。 ①大理石与稀盐酸反应制取二氧化碳 ②锌与稀硫酸反应制取氢气 小颖认为在不改变Ⅰ、Ⅱ装置的仪器及位置的前提下,该装置可用于双氧水制取氧气, 她的做法是 ; 实验室还可以用高锰酸钾制取氧气,化学方程式为 。 (3)当打开K2、关闭K1时,利用Ⅰ、Ⅲ装置可验证二氧化碳与水反应,生成了碳酸,此时试管中盛放的物质是 ,可以观察到的现象是 (C为干燥管,用于防止液体倒吸)。查看更多