- 2021-04-15 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
备战2021 高考化学 加餐练2 物质的量在化学实验中的应用
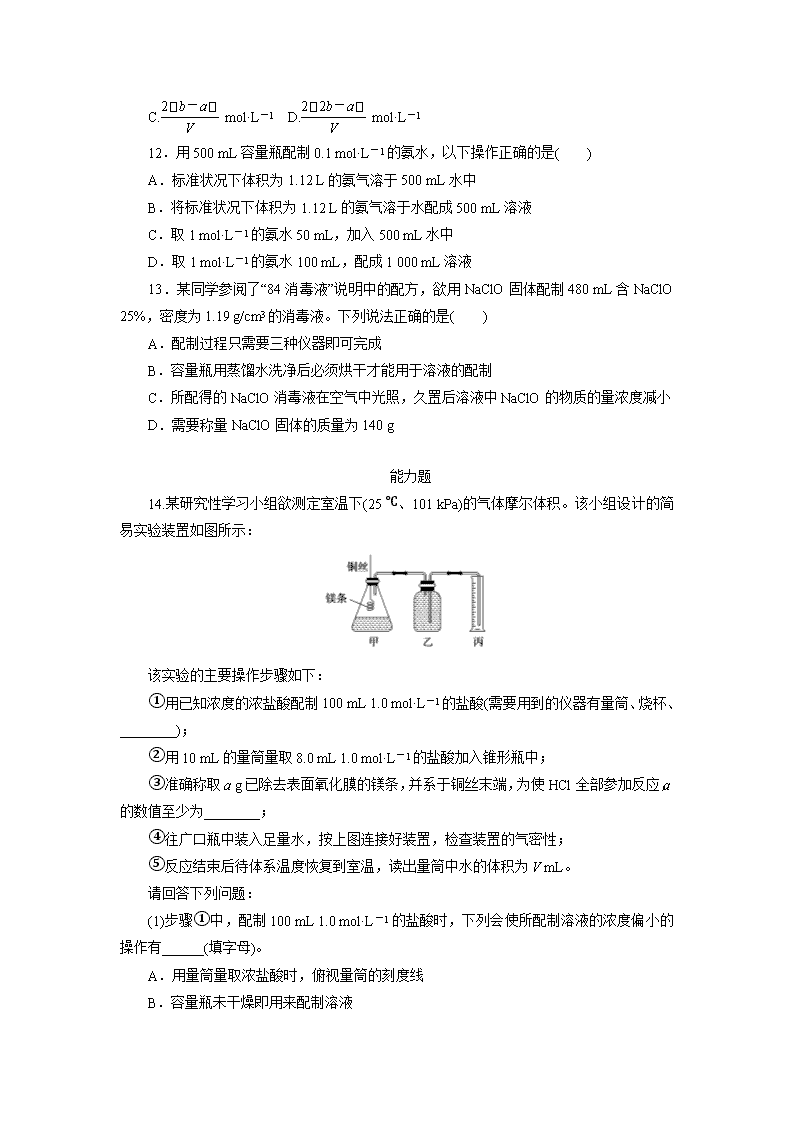
加餐练 2 物质的量在化学实验中的应用 基础题 1.下列溶液中,物质的量浓度为 1 mol·L-1 的是( ) A.将 40 g NaOH 溶解在 1 L 水中 B.将 22.4 L HCl 气体溶解于 1 L 水配成溶液 C.将 1 L 10 mol·L-1 的浓盐酸加入 9 L 水中 D.将 10 g NaOH 固体溶解在少量水中后,定容成 250 mL 溶液 2.下列关于容量瓶及其使用方法的叙述,正确的是( ) A.是配制一定物质的量浓度的溶液的专用仪器 B.容量瓶可以用来加热 C.能用容量瓶贮存配制好的溶液 D.可以用 500 mL 容量瓶配制 250 mL 溶液 3.在 200 mL 某硫酸盐溶液中含有 1.5NA 个硫酸根离子(设 NA 为阿伏加德罗常数的值), 同时含有 NA 个金属阳离子,则该硫酸盐的物质的量浓度为( ) A.1 mol·L-1 B.2.5 mol·L-1 C.5 mol·L-1 D.2 mol·L-1 4.某氯化镁溶液的密度为 1.18 g·cm-3,其中镁离子的质量分数为 5.1%,300 mL 该溶液 中 Cl-的物质的量约等于( ) A.0.37 mol B.0.63 mol C.0.74 mol D.1.50 mol 5.将 30 mL 0.5 mol·L-1 NaOH 溶液加水稀释到 500 mL,关于稀释后的溶液叙述不正确 的是( ) A.浓度为 0.03 mol·L-1 B.从中取出 10 mL 溶液,其浓度为 0.03 mol·L-1 C.含 NaOH 0.6 g D.从中取出 10 mL 溶液,含 NaOH 0.015 mol 6.用已准确称量过的 NaCl 固体配制 0.20 mol·L-1 的 NaCl 溶液 250 mL,要用到的仪器 是( ) ①250 mL 容量瓶;②托盘天平;③烧瓶;④胶头滴管;⑤烧杯;⑥玻璃棒;⑦试管; ⑧药匙 A.①④⑤⑥ B.①②④⑤ C.①②④⑤⑥⑧ D.全部 7.某学生在配制一定物质的量浓度氢氧化钠溶液时,结果所配溶液的浓度偏高,其原 因可能是( ) A.所用氢氧化钠已经潮解 B.向容量瓶中加水未到刻度线 C.有少量氢氧化钠溶液残留在烧杯里 D.用带游码的托盘天平称 2.4 g NaOH 时误用了“左码右物”方法 8.下图是某同学用 500 mL 容量瓶配制 0.10 mol·L-1 NaOH 溶液的过程: 该同学的错误步骤有( ) A.1 处 B.2 处 C.3 处 D.4 处 9.设 NA 为阿伏加德罗常数的值,下列对 0.3 mol·L-1K2SO4 溶液的叙述正确的是( ) A.1 L 溶液中含有 0.3NA 个 K+ B.1 L 溶液中含有 K+和 SO 2- 4 的总数为 0.9NA C.2 L 溶液中 K+的浓度为 1.2 mol·L-1 D.将 0.3 mol 硫酸钾溶于 1 L 水中,所得硫酸钾溶液的浓度为 0.3 mol·L-1 10.取 100 mL 0.3 mol·L-1 和 300 mL 0.25 mol·L-1 的硫酸注入 500 mL 容量瓶中,加水 稀释至刻度线,该混合溶液中 H+的物质的量浓度是( ) A.0.21 mol·L-1 B.0.42 mol·L-1 C.0.56 mol·L-1 D.0.26 mol·L-1 11.把 V L 含有 MgSO4 和 K2SO4 的混合溶液分成两等份,一份加入含 a mol NaOH 的 溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含 b mol BaCl2 的溶液,恰好使硫酸 根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( ) A.b-a V mol·L-1 B.2b-a V mol·L-1 C.2 b-a V mol·L-1 D.2 2b-a V mol·L-1 12.用 500 mL 容量瓶配制 0.1 mol·L-1 的氨水,以下操作正确的是( ) A.标准状况下体积为 1.12 L 的氨气溶于 500 mL 水中 B.将标准状况下体积为 1.12 L 的氨气溶于水配成 500 mL 溶液 C.取 1 mol·L-1 的氨水 50 mL,加入 500 mL 水中 D.取 1 mol·L-1 的氨水 100 mL,配成 1 000 mL 溶液 13.某同学参阅了“84 消毒液”说明中的配方,欲用 NaClO 固体配制 480 mL 含 NaClO 25%,密度为 1.19 g/cm3 的消毒液。下列说法正确的是( ) A.配制过程只需要三种仪器即可完成 B.容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制 C.所配得的 NaClO 消毒液在空气中光照,久置后溶液中 NaClO 的物质的量浓度减小 D.需要称量 NaClO 固体的质量为 140 g 能力题 14.某研究性学习小组欲测定室温下(25 ℃、101 kPa)的气体摩尔体积。该小组设计的简 易实验装置如图所示: 该实验的主要操作步骤如下: ①用已知浓度的浓盐酸配制 100 mL 1.0 mol·L-1 的盐酸(需要用到的仪器有量筒、烧杯、 ________); ②用 10 mL 的量筒量取 8.0 mL 1.0 mol·L-1 的盐酸加入锥形瓶中; ③准确称取 a g 已除去表面氧化膜的镁条,并系于铜丝末端,为使 HCl 全部参加反应, a 的数值至少为________; ④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性; ⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为 V mL。 请回答下列问题: (1)步骤①中,配制 100 mL 1.0 mol·L-1 的盐酸时,下列会使所配制溶液的浓度偏小的操 作有______(填字母)。 A.用量筒量取浓盐酸时,俯视量筒的刻度线 B.容量瓶未干燥即用来配制溶液 C.浓盐酸在烧杯中稀释时,搅拌时间过长 D.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线未做处理 E.在容量瓶中定容时俯视容量瓶刻度线 F.烧杯中有少量水 G.未冷却至室温即定容 (2)请填写操作步骤中的空格: 步骤①: ________________________________________________________________________, 步骤③:____________。 (3)实验步骤⑤中应选用的量筒规格是 ________________________________________________________________________。 (4)读数时需要注意(至少写两点): ________________________________________________________________________ ________________________________________________________________________。 (5)忽略水蒸气影响,在该条件下测得气体摩尔体积的计算式为 Vm=________L·mol-1。 15.奶粉中蛋白质含量的测定往往采用“凯氏定氮法”,其原理是食品与硫酸和催化剂一 同加热,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸 吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。 操作步骤: ①样品处理:准确称取一定量的固体奶粉样品,移入干燥的烧杯中,经过一系列的处理, 待冷却后移入一定体积的容量瓶中。 ②NH3 的蒸馏和吸收:把制得的溶液(取一定量)通过定氮装置,经过一系列的反应,使 氨转化成硫酸铵,再经过碱化蒸馏后,使氨转变为游离态,游离氨经硼酸吸收。 ③氨的滴定:用标准盐酸滴定所生成的硼酸铵,由消耗的盐酸标准液计算出总氮量,再 折算为粗蛋白质含量。 试回答下列问题: (1)在配制过程中,下列哪项操作可能使配制的溶液的浓度偏大________(填字母)。 A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯 B.定容时,俯视刻度线 C.定容时,仰视刻度线 D.移液时,有少量液体溅出 (2)若称取样品的质量为 1.5 g,共配制 100 mL 的溶液,取其中的 20 mL,经过一系列处 理后,使 N 转变为硼酸铵后用 0.1 mol·L-1 盐酸滴定,其用去盐酸的体积为 23.0 mL,则该 样品中 N 的含量为________(保留两位小数)。 已知滴定过程中涉及的反应方程式: (NH4)2B4O7+2HCl+5H2O===2NH4Cl+4H3BO3 加餐练 2 物质的量在化学实验中的应用 1.解析:物质的量浓度是以单位体积溶液中所含溶质 B 的物质的量来表示溶液组成的 物理量。A、B 中将溶剂的体积理解为溶液的体积;C 中将溶液的体积理解为溶剂的体积和 溶质的体积之和,只有 D 符合要求。 答案:D 2.解析:容量瓶是用来配制一定物质的量浓度的溶液的专用仪器,故 A 正确;容量瓶 不能用来加热,故 B 错误。 答案:A 3.解析:硫酸根离子和金属阳离子的个数之比是 3:2,根据溶液呈电中性,溶液中阴 阳离子所带总电荷相等,设 1 个金属阳离子带 x 个正电荷,即为 Mx+,所以 3×2=2x,x=3, 则该盐的化学式为 M2(SO4)3,所以该盐的物质的量浓度是0.5 mol 0.2 L =2.5 mol·L-1,故选 B。 答案:B 4.解析:c(Mg2+)=1 000ρw M =1 000×1.18×5.1% 24 mol·L-1≈2.5 mol·L-1 c(Cl-)=2.5 mol·L-1×2=5.0 mol·L-1 n(Cl-)=5.0 mol·L-1×0.3 L=1.50 mol。 答案:D 5.解析:溶液稀释前后溶质的物质的量不变。从一定物质的量浓度的溶液中取出任意 体积的溶液,其浓度不变,但所含溶质的物质的量或质量因体积的不同而不同。 答案:D 6.解析:由于只需要进行溶解、转移、洗涤和定容操作,故需用的仪器只是①④⑤⑥。 答案:A 7.解析:A 项,所用 NaOH 已经潮解,实际称量的氢氧化钠的质量减小,氢氧化钠的 物质的量减小,所配溶液浓度偏低,错误;B 项,向容量瓶中加水未到刻度线时溶液的体积 偏小,溶液的浓度偏大,正确;C 项,有少量氢氧化钠溶液残留在烧杯里,造成了溶质的损 耗,溶液浓度偏低,错误;D 项,称量时误用“左码右物”,若不使用游码,对称取的氢氧化 钠的质量无影响,对所配溶液浓度无影响;若使用游码,实际称取氢氧化钠的质量减小,所 配溶液浓度偏低,错误。 答案:B 8.解析:第①步不能把 NaOH 放在称量纸上称量;第④步玻璃棒应接触容量瓶内壁刻 度线以下的部分;第⑤步定容时应平视刻度线。 答案:C 9.解析:0.3 mol·L-1K2SO4 溶液中,c(K+)=0.6 mol·L-1,c(SO2- 4 )=0.3 mol·L-1,则 1 L 溶液中含 K+的数目为 0.6NA,K+和 SO 2- 4 的总数为 0.9NA,A 项错误,B 项正确;物质的量 浓度表示的是 1 L 溶液中所含溶质的物质的量,不受溶液体积大小的影响,2 L 0.3 mol·L- 1K2SO4 溶液中 K+的浓度为 0.6 mol·L-1,C 项错误;物质的量浓度中的体积指的是溶液体积 而不是溶剂的体积,D 项错误。 答案:B 10.解析:混合溶液中 H+物质的量为 n(H+)=(0.1 L×0.3 mol·L-1+0.3 L×0.25 mol·L-1)×2 =0.21 mol,所以 c(H+)=0.21 mol 0.5 L =0.42 mol·L-1。 答案:B 11.解析:注意混合溶液分成了两等份,由 Mg2 + +2OH - ===Mg(OH)2↓、Ba2 + + SO2- 4 ===BaSO4↓可知,原溶液中含有 n(Mg2+)=2a 2 mol=a mol、n(SO2- 4 )=2b mol,依据电荷 守恒可知,原溶液中 n(K+)=2n(SO2- 4 )-2n(Mg2+)=2(2b-a) mol,故 c(K+)=2 2b-a V mol·L-1。 答案:D 12.解析:A 项和 C 项形成溶液的体积不是 500 mL,D 项不能配制,因为题目提供的 容量瓶的体积是 500 mL,而不是 1 000 mL。 答案:B 13.解析:配制过程中需要用到托盘天平、烧杯、玻璃棒、容量瓶、胶头滴管等,A 项 错误;容量瓶用蒸馏水洗净后不需要烘干,B 项错误;需要称量 NaClO 固体的质量为 500 mL×1.19 g/cm3×25%=148.8 g,D 项错误。 答案:C 14.解析:(2)步骤①用浓盐酸配制 100 mL 1.0 mol·L-1 的盐酸时,需用量筒量取浓盐酸, 在烧杯中稀释,要用玻璃棒不断搅拌,最后用胶头滴管对 100 mL 容量瓶进行定容。步骤 ③Mg 与盐酸发生的反应为 Mg+2HCl===MgCl2+H2↑,8.0 mL 1.0 mol·L-1 盐酸中 n(HCl)= 8.0×10-3 L×1.0 mol·L-1=8.0×10-3 mol,完全反应时消耗 Mg 为 4.0×10-3 mol,其质量为 m(Mg) =4.0×10-3 mol×24 g·mol-1=0.096 g。 (3)8.0×10-3 mol HCl 与 Mg 完全反应放出 4.0×10-3 mol H2,其在标准状况下的体积为 4.0×10-3 mol×22.4 L·mol-1=0.089 6 L= 89.6 mL,故应选取体积为 100 mL 的量筒。 (5) HCl 完全反应时生成 4.0×10-3 mol H2,实验中收集到 V mL H2,则该条件下的气体 摩尔体积为 Vm= V×10-3 L 4.0×10-3 mol =0.25V L·mol-1。 答案:(1)AC (2)玻璃棒、100 mL 容量瓶、胶头滴管 0.096 (3)100 mL (4)①恢复到室温再读数;②调节量筒高度,使量筒内的液面与集气瓶内的液面相平; ③读数时视线应与量筒中液体的凹液面最低处保持相平 (5)0.25V 15.解析:(1)由 c=n V 判断 A、D 操作会使 n 偏小,浓度偏小;B 中俯视刻度线,使 V 偏小,浓度偏大;C 中仰视刻度线,使 V 偏大,浓度偏小。 (2)2N~(NH4)2B4O7~2HCl 2 2 n 0.1 mol·L-1×0.023 L n=0.002 3 mol,100 mL 溶液中含 N 元素的物质的量=0.002 3 mol×100 mL 20 mL =0.011 5 mol,该样品中 N 的含量 w=0.011 5 mol×14 g·mol-1 1.5 g ×100%≈10.73%。 答案:(1)B (2)10.73%查看更多