- 2021-04-15 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高三化学上学期期末教学质量检测试题 新版 新人教版
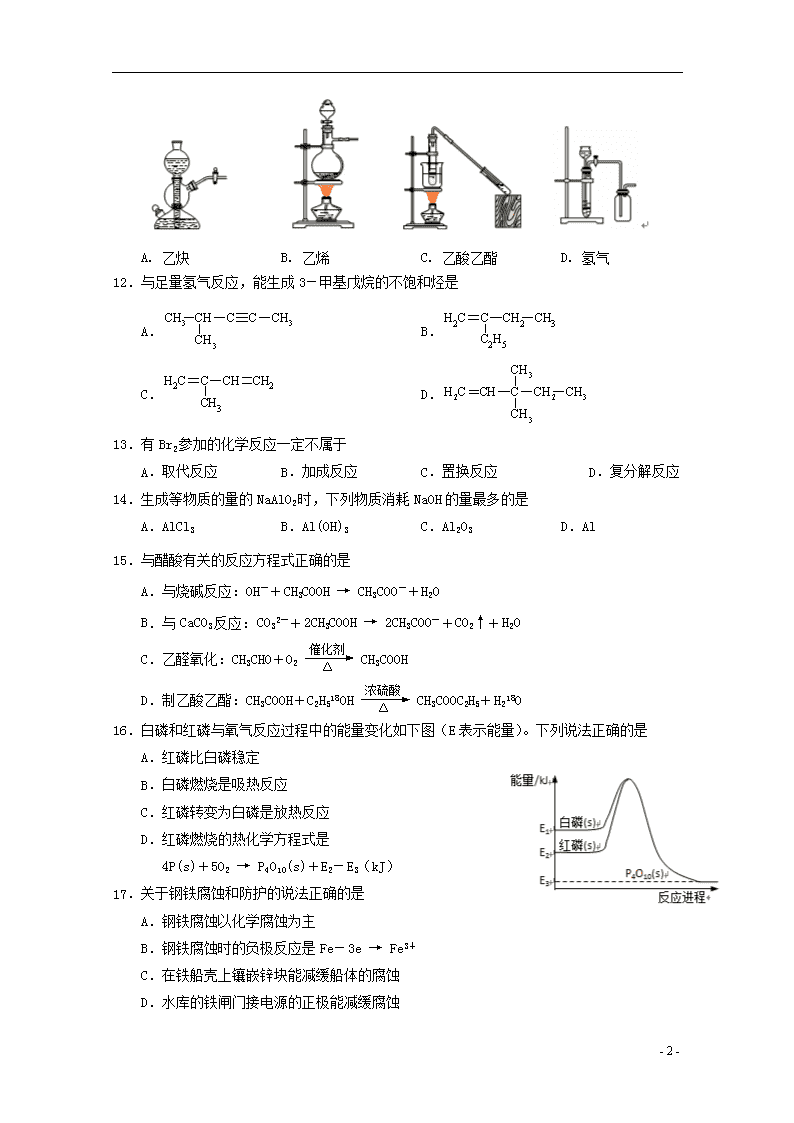
2019届高三化学上学期期末教学质量检测试题 相对原子质量:O-16 Na-23 S-32 一、选择题(共40分,每小题2分,每小题只有一个正确答案) 1.常用于医学PET显像,这里的“7”是指该原子的 A.质子数 B.中子数 C.质量数 D.原子个数 2.能形成离子化合物的元素组是 A.H、Cl B.Na、S C.Si、C D.Al、Mg 3.第ⅦA族元素具有相似的化学性质,其原因是它们的原子具有相同的 A.电子层数 B.核外电子数 C.最外层电子数 D.原子半径 4.属于石油分馏产品的是 A.焦炉气 B.汽油 C.丙烯 D.乙醇 5.乙烯分子中不存在 A.非极性键 B.极性键 C.范德华力 D.共用电子对 6.可用于检验久置的FeSO4溶液是否含有Fe3+的试剂是 A.过氧化钠 B.铁粉 C.盐酸 D.KSCN溶液 7.属于定量仪器的是 A.蒸馏烧瓶 B.容量瓶 C.干燥器 D.分液漏斗 8.物质分离和提纯操作中,可能含有化学变化的是 A.洗气 B.萃取 C.升华 D.过滤 9.铝制品不易被腐蚀,其主要原因是因为铝 A.化学性质不活泼 B.熔点高 C.表面有致密氧化膜 D.密度小 10.将新制氯水滴入以下溶液中,无明显现象的是 A.氢氧化钠 B.硝酸银 C.氢硫酸 D.石蕊 11.实验室制备下列物质的装置正确的是 - 7 - A. 乙炔 B. 乙烯 C. 乙酸乙酯 D. 氢气 12.与足量氢气反应,能生成3-甲基戊烷的不饱和烃是 A. B. C. D. 13.有Br2参加的化学反应一定不属于 A.取代反应 B.加成反应 C.置换反应 D.复分解反应 14.生成等物质的量的NaAlO2时,下列物质消耗NaOH的量最多的是 A.AlCl3 B.Al(OH)3 C.Al2O3 D.Al 15.与醋酸有关的反应方程式正确的是 A.与烧碱反应:OH-+CH3COOH → CH3COO-+H2O B.与CaCO3反应:CO32-+2CH3COOH → 2CH3COO-+CO2↑+H2O C.乙醛氧化:CH3CHO+O2 催化剂 △ CH3COOH D.制乙酸乙酯:CH3COOH+C2H518OH 浓硫酸 △ CH3COOC2H5+H218O 16.白磷和红磷与氧气反应过程中的能量变化如下图(E表示能量)。下列说法正确的是 A.红磷比白磷稳定 B.白磷燃烧是吸热反应 C.红磷转变为白磷是放热反应 D.红磷燃烧的热化学方程式是 4P(s)+5O2 → P4O10(s)+E2-E3(kJ) 17.关于钢铁腐蚀和防护的说法正确的是 A.钢铁腐蚀以化学腐蚀为主 B.钢铁腐蚀时的负极反应是Fe-3e → Fe3+ C.在铁船壳上镶嵌锌块能减缓船体的腐蚀 D.水库的铁闸门接电源的正极能减缓腐蚀 - 7 - 18.关于苯乙烯()的说法正确的是 A.分子式为C8H10 B.加聚产物为: C.属于苯的同系物 D.可以使酸性高锰酸钾溶液褪色 19.与盐类水解无关的化学应用是 A.明矾用于净水 B.氯化铁溶液腐蚀铜板 C.热的纯碱溶液洗涤除去油污 D.草木灰不能与铵态氮肥混合使用 20.有关侯氏制碱法的说法错误的是 A.在制备纯碱的同时,得到副产品氯化铵 B.通过母液的循环利用,提高氯化钠的利用率 C.通过与合成氨厂的联合,获得原料氨气和二氧化碳 D.在析出NaHCO3的母液中加入消石灰以循环利用NH3 二、综合题(共60分) (一)(本题共15分) 焦亚硫酸钠(Na2S2O5)是常用的脱氧剂,其制备方法是向Na2CO3溶液中通入SO2,生成NaHSO3和CO2,一定条件下NaHSO3转化为Na2S2O5。 完成下列填空: 21.碳原子的原子结构示意图是 。氧原子核外能量不同的电子有 种。CO2的电子式是 。 22.从原子结构的角度,解释氧元素的非金属性比硫元素强的原因。______________________ 23. SO2与Na2CO3溶液反应生成NaHSO3和CO2,其化学方程式为_______________。 证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是 。 24.Na2S2O5作脱氧剂时的反应原理为Na2S2O5+O2+H2O→Na2SO4+H2SO4,该反应中,氧化产物是_____;若反应中转移了0.04 mol的电子,有 g Na2S2O5参加反应。 (二)(本题共16分) 合成氨的反应为N2+3H22NH3+Q。下表是某次反应时NH3的浓度变化: 时间(min) 0 5 10 15 20 c(NH3)(mol/L) 0 0.30 0.44 0.50 0.50 - 7 - 完成下列填空: 25.由表中数据计算0~10 min时,用H2表示的平均反应速率为 。降低温度,反应的平衡常数将______________(填“增大”、“减小”或“不变”)。若要增大反应速率且提高H2利用率,可采取的措施有 。 26.若反应中气体混合物的密度保持不变,能否说明该反应已经达到平衡状态?并说明理由。 27.用右图所示装置进行有关氨气性质的实验,挤出胶头滴管中的水,打开止水夹后的实验现象是 。 28.氨气溶于水后溶液显碱性的原因是(用方程式表示) 。 若在氨水中逐滴滴加盐酸,则溶液的pH将 (填“增大”、“减小”或“不变”);当恰好完全反应时, 则c(NH4+) c(Cl-)(填“>”、“<”或“=”)。 (三)(本题共14分) 实验室用下图装置制取并研究SO2的性质。 完成下列填空: 29.圆底烧瓶中反应的化学方程式为 。 30.若A中盛放品红溶液,可以验证的SO2性质是 。若要验证SO2的还原性,A中应盛放 溶液。B中应盛放 溶液。 为测定反应后的溶液中残留的硫酸浓度,实验小组进行如下探究。 锌粒 10mL 稀释液 水 量 气 管 水 准 管 31.甲组:取1 mL反应液加水稀释至100 mL,再取10 mL稀释液与足量锌粒用右图装置进行测定。 在读取反应前后量气管中液面读数时应先调节水准管与量气管中液面等高,这样操作的目的是 。 实验测得反应生成的氢气体积为22.4 mL(已换算到标准状况),计算原反应液中残留的硫酸浓度为 mol/L。 - 7 - 32.乙组:欲通过加入足量的BaCl2溶液,测定生成的BaSO4沉淀质量来达到实验目的。该设计思路不可行,理由是 。 (四)(本题共15分) 乙烯是重要的有机化工初始原料,可以由它出发合成很多有机产品,油漆软化剂丁烯酸乙酯的合成途径如下: 完成下列填空: 33.丁烯酸乙酯的结构简式为 。 34.C→D的反应类型是 。 A→B的化学方程式为 。 35.写出一种D的同分异构体(与D含有完全相同的官能团)。 36.请设计实验,检验D是否完全氧化为丁烯酸。 37.设计一条由C制备ClCH2CH=CHCH2Cl的合成路线。 (合成路线常用的表示方式为:A 反应试剂 反应条件 B ∙∙∙∙∙∙ 反应试剂 反应条件 目标产物) - 7 - 参考答案 一.选择题(每题只有一个正确答案,共40分) 题号 1 2 3 4 5 6 7 8 9 10 答案 A B C B C D B A C A 题号 11 12 13 14 15 16 17 18 19 20 答案 C B D A A A C D B D 二、综合题(共60分)(除标明的以外,每空2分) (一)(15分) 21.+6 4 2 (1分)。3。。 22.氧原子和硫原子最外层电子数相等,但是氧原子的半径比硫原子小,核对核外电子的吸引力强,得电子能力强,所以氧元素非金属性比硫强。 23.2SO2+Na2CO3+H2O →2 NaHSO3+CO2。取样,测定溶液的pH,若pH小于7,说明电离程度大于水解程度。(合理就给分) 24.Na2SO4、H2SO4;1.90。 (二)(16分) 25.0.066mol/(L·min)。增大。增大氮气的浓度、加压。 26.不能。题目中没有指明是恒容容器还是恒压容器。 27.烧杯中的水面下降;烧瓶中产生喷泉,出现红褐色沉淀(3分)。 28. NH3+H2ONH3·H2ONH4++OH-(或分步书写)。减小(1分);<。 (三)(14分) 29.Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。 30.漂白性。溴水(或高锰酸钾溶液)。氢氧化钠。 31.使量气管内压强与大气压一致。10 mol/L。 32.反应液中除了硫酸,还有硫酸铜,也会与氯化钡反应生成硫酸钡沉淀,所以不能通过沉淀的质量计算硫酸的质量。 - 7 - (四)(15分) 33.CH3CH=CHCOOC2H5 34.消去反应(1分)。2C2H5OH+O2Cu △ 2CH3CHO+2H2O。 35.或CH2=CHCH2CHO 36.取样,加入过量氢氧化钠溶液,然后加入新制氢氧化铜,加热煮沸,若出现砖红色沉淀,则D没有完全氧化;若不出现砖红色沉淀,则D完全氧化了(3分)。 37. H2 催化剂,△ 浓硫酸 △ (5分) - 7 -查看更多