- 2021-04-15 发布 |
- 37.5 KB |
- 16页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020-2021学年人教版初三化学上单元检测 第三单元 物质构成的奥秘
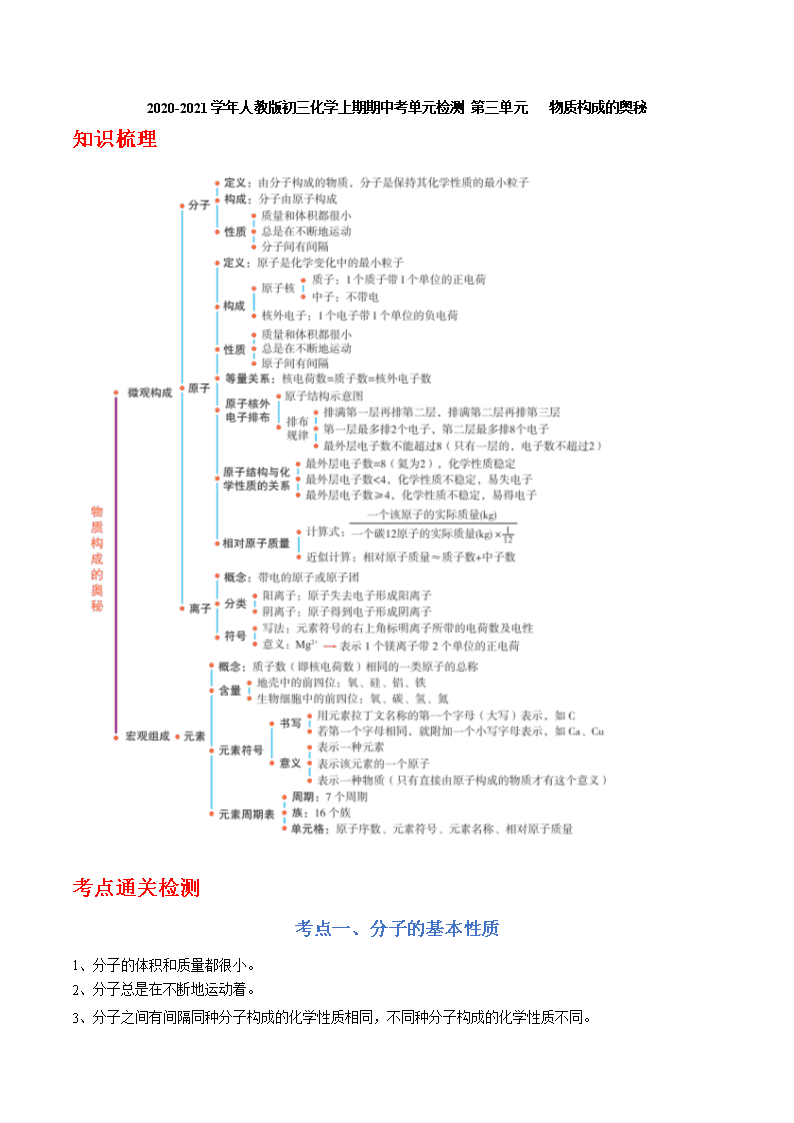
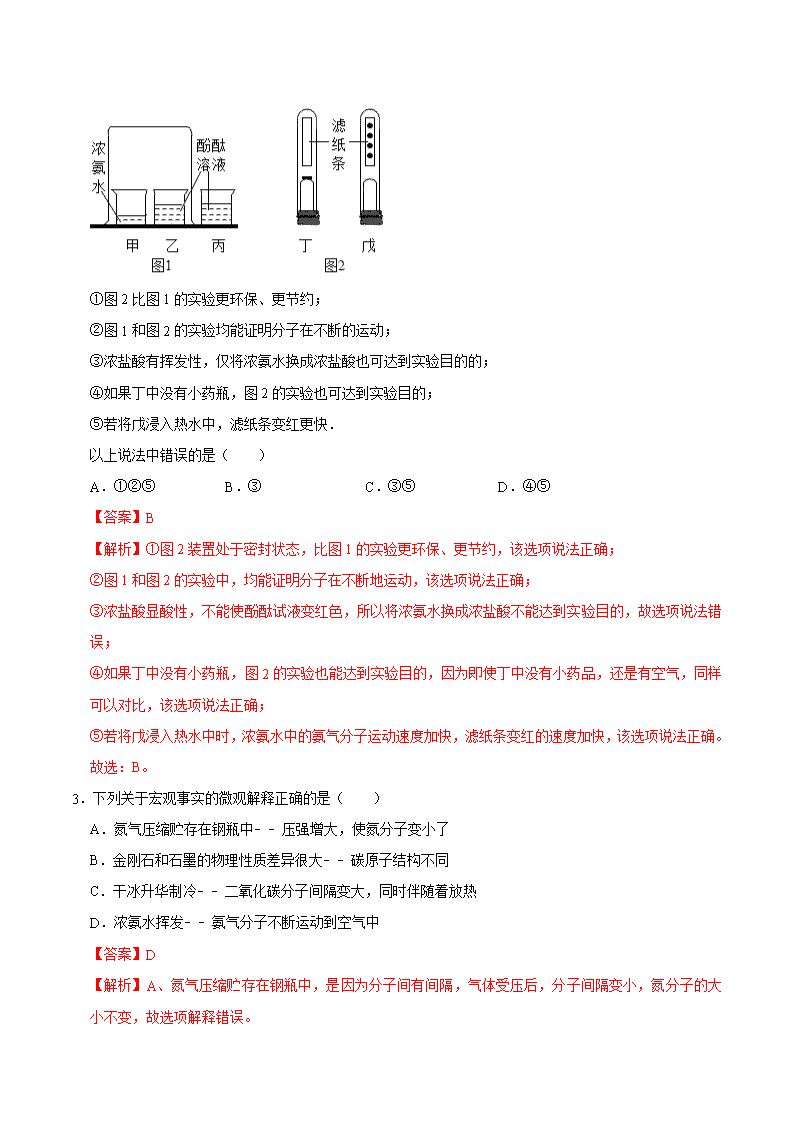
2020-2021学年人教版初三化学上期期中考单元检测 第三单元 物质构成的奥秘 知识梳理 考点通关检测 考点一、分子的基本性质 1、分子的体积和质量都很小。 2、分子总是在不断地运动着。 3、分子之间有间隔同种分子构成的化学性质相同,不同种分子构成的化学性质不同。 二、分子和原子的异同 分子 原子 定义 分子是保持物质化学性质的最小粒子。 原子是化学变化中的最小粒子。 性质 质量小、体积小;不断运动;有间隔;同种粒子的化学性质相同。 联系 分子是由原子构成的。分子、原子都是构成物质的微粒。 区别 在化学变化中,分子可以再分,而原子不可以再分。 备注 1. 所有金属、稀有气体、金刚石(石墨)和硅是由原子构成的,其他大多数物质是由分子构成的。 2. 在受热的情况下,粒子能量增大,运动速率加快。 3. 物体的热胀冷缩现象,原因是构成物质的粒子的间隔受热时增大,遇冷时缩小。 4. 气体容易压缩是因为构成气体的粒子的间隔较大。 5. 不同液体混合后总体积小于原体积的和,说明粒子间是有间隔的。 6. 一种物质如果由分子构成,那么保持它化学性质的最小粒子是分子;如果它由原子构成,那么保持它化学性质的最小粒子是原子。 1.目前学校每天为同学们测量体温,水银温度计量体温时汞柱上升的原因是( ) A.原子在不断运动 B.原子间间隔增大 C.原子是化学变化中的最小粒子 D.原子质量和体积很小 【答案】B 【解析】水银是金属汞的俗称,是由汞原子直接构成的,水银温度计量体温时汞柱上升,是因为汞原子间的间隔随着温度的改变而改变。 故选:B。 2.小明同学对探究分子性质的实验(图1)进行了改进.如图2所示,试管丁、戊中各有一张每隔2厘米滴有一滴酚酞溶液的滤纸条,装有适量浓氨水的小药瓶固定在橡皮塞上,试管丁中小药瓶上的瓶塞已塞紧,试管戊中的小药瓶上无瓶塞.关于图1、图2中的实验有以下说法: ①图2比图1的实验更环保、更节约; ②图1和图2的实验均能证明分子在不断的运动; ③浓盐酸有挥发性,仅将浓氨水换成浓盐酸也可达到实验目的的; ④如果丁中没有小药瓶,图2的实验也可达到实验目的; ⑤若将戊浸入热水中,滤纸条变红更快. 以上说法中错误的是( ) A.①②⑤ B.③ C.③⑤ D.④⑤ 【答案】B 【解析】①图2装置处于密封状态,比图1的实验更环保、更节约,该选项说法正确; ②图1和图2的实验中,均能证明分子在不断地运动,该选项说法正确; ③浓盐酸显酸性,不能使酚酞试液变红色,所以将浓氨水换成浓盐酸不能达到实验目的,故选项说法错误; ④如果丁中没有小药瓶,图2的实验也能达到实验目的,因为即使丁中没有小药品,还是有空气,同样可以对比,该选项说法正确; ⑤若将戊浸入热水中时,浓氨水中的氨气分子运动速度加快,滤纸条变红的速度加快,该选项说法正确。 故选:B。 3.下列关于宏观事实的微观解释正确的是( ) A.氮气压缩贮存在钢瓶中﹣﹣压强增大,使氮分子变小了 B.金刚石和石墨的物理性质差异很大﹣﹣碳原子结构不同 C.干冰升华制冷﹣﹣二氧化碳分子间隔变大,同时伴随着放热 D.浓氨水挥发﹣﹣氨气分子不断运动到空气中 【答案】D 【解析】A、氮气压缩贮存在钢瓶中,是因为分子间有间隔,气体受压后,分子间隔变小,氮分子的大小不变,故选项解释错误。 B、金刚石和石墨的物理性质差异很大,是由于金刚石和石墨中碳原子的排列方式不同决定了性质不同,碳原子结构相同,故选项解释错误。 C、干冰升华制冷,是由于二氧化碳分子间隔变大,同时伴随着吸热,故选项解释错误。 D、浓氨水挥发,是由于分子是不断运动的,氨气分子不断运动到空气中,故选项解释正确。 故选:D。 4.下列对分子、原子的认识错误的是( ) A.化学是在原子、分子水平上研宄物质及其变化规律 B.化学反应中,分子、原子都不可分 C.分子是由原子构成的,分子、原子的体积都很小 D.天然水的循环过程中水分子的排列方式发生变化 【答案】B 【解析】A、化学是在原子、分子水平上研宄物质及其变化规律的学科,说法正确; B、在化学反应中,分子是可以再分的,说法错误; C、分子是由原子构成的,分子、原子的体积都很小,说法正确; D、天然水的循环是物理变化,在变化的过程中水分子的排列方式发生变化,说法正确; 故选:B。 5.下列图示中能表示保持氢气化学性质的微粒是( ) A. B. C. D. 【答案】B 【解析】氢气是由氢分子构成的,故保持氢气化学性质的微粒是氢分子,氢分子的微观模型为; 故选:B。 二.填空题(共1小题) 6.构成物质的微观粒子有多种,如图所示是构成物质的粒子之间的关系: (1)甲是 。 (2)在氧气、水、汞、氯化钠、铁,这五种物质中,由原子构成的物质是 。 (3)二氧化碳是由 (填具体粒子的名称)构成的。 【答案】(1)原子; (2)汞、铁; (3)二氧化碳分子。 【解析】(1)分子是由原子构成的,原子得失电子形成离子,所以甲表示的是原子;故填:原子; (2)氧气和水是由分子构成的,汞是由原子构成的,氯化钠是由钠离子与氯离子构成的,铁是由原子构成的;故填:汞、铁; (3)二氧化碳是由二氧化碳分子构成的;故填:二氧化碳分子。 三.实验探究题(共1小题) 7.同学们为研究分子的性质,做了如下三个实验 (1)实验1中,观察到品红在 (填“冷”或“热”)水中扩散更快。 (2)实验2中,观察到A烧杯溶液无明显变化,B烧杯溶液由无色变为红色,该现象说明分子具有的性质是 。 (3)实验3中,称取ag酚酞溶液,放置1小时后读数变为a1g.若用ag浓氨水代替酚酞溶液重复上述实验,1小时后读数变为a2g.则a1 a2(填“>”、“=”、“<”) 【答案】(1)热。 (2)不断运动的。 (3)>。 【解析】(1)实验1中,观察到品红在热水中扩散更快。 故填:热。 (2)实验2中,观察到A烧杯溶液无明显变化,B烧杯溶液由无色变为红色,该现象说明分子是不断运动的。 故填:不断运动的。 (3)实验3中,称取ag酚酞溶液,放置1小时后读数变为a1g,若用a2g浓氨水代替酚酞溶液重复上述实验,由于氨分子运动的比酚酞分子快,因此1小时后读数变为a2g.则a1>a2。 故填:故填:>。 考点二、原子的构成 原子 (不带电) 原子核(带正电) 核外电子(每个电子带一个单位负电荷;电子分层排布) 质子(每个质子带 一个单位正电荷) 中子(不带电) 在核外一个相对很大的空间内做着高速运动动 体积很小,约占原子体积的十万分之一 原子一般是由质子、中子和电子构成,有的原子不一定有中子,质子数也不一定等于中子数。 ※构成原子的各种粒子间的关系:在原子中,原子序数=核电荷数=核内质子数=核外电子数。 原子核外电子排布 1、 原子的核外电子最少的只有一层,最多的有七层;最外层电子数不超过8个(只有一层的,电子数不超过2个)。 2、 原子结构示意图。(以氧原子的结构示意图为例) 离子 概念:带电的原子(或原子团) 表示:在元素符号的右上角用“+”或“-”号表示离子的电性,数字表示离子所带的电荷数,先写数字,后写“+”或“-”号,当数字为1,时省略不写。 种类:阳离子:带正电的原子(或原子团) 阴离子:带负电的原子(或原子团) 符号意义:表示离子(或一个离子)2Mg2+ 相对原子质量 相对原子质量≈质子数+中子数 1.在原子中,质子数等于( ) A.中子数 B.电子数 C.中子数和电子数之和 D.中子数和电子数之差 【答案】B 【解析】由原子中微粒的等量关系可知:原子核内的质子数等于原子核外的电子数。 故选:B。 2.原子质量的大小主要决定于( ) A.核内质子的数目 B.核内中子的数目 C.核内质子、中子的质量 D.核外电子数目 【答案】C 【解析】原子的质量主要集中在原子核上,电子的质量很小,几乎可以忽略,原子核是由质子和中子构成的,所以原子质量大小由质子和中子决定。 故选:C。 3.下列粒子结构示意图中,表示阴离子的是( ) A. B. C. D. 【答案】A 【解析】A、质子数=9,核外电子数=10,为阴离子,故正确; B、质子数=核外电子数=10,为原子,故错误; C、质子数=11>核外电子数=10,为阳离子,故错误; D、质子数=12>核外电子数=10,为阳离子,故错误; 故选:A。 4.济阳“仁风”西瓜富含硒元素而闻名,硒元素被誉为“抗癌大王”.已知硒原子的核电荷数为34,相对原子质量为79,下列关于该原子的说法正确的是( ) A.质子数为45 B.核外电子数为34 C.中子数为34 D.原子序数为79 【答案】B 【解析】A、硒原子的核电荷数为34,根据在原子中,核电荷数=质子数,可知硒原子的质子数为34,故错误; B、硒原子的核电荷数为34,根据在原子中,核电荷数=核外电子数,可知硒原子的核外电子数为34,故正确; C、在原子中,核电荷数=质子数、相对原子质量=中子数+质子数,已知硒原子的核电荷数为34,相对原子质量为79,则中子数=79﹣34=45,故错误; D、硒原子的核电荷数为34,根据在原子中,核电荷数=原子序数,可知硒原子的原子序数为34,故错误。 故选:B。 5.如图是某原子的结构示意图。下列关于该原子的说法不正确的是( ) A.属于金属元素原子 B.最外层电子数为6 C.容易得到电子 D.有3个电子层 【答案】A 【解析】A、由某元素的原子结构示意图,圆圈内数字表示核内质子数,其核内质子数为16,为硫元素,属于非金属元素,故选项说法错误。 B、由某元素的原子结构示意图,弧线表示电子层,弧线上的数字表示该层上的电子数,则最外层电子数为6,故选项说法正确。 C、由某元素的原子结构示意图,最外层电子数是6,大于4,在化学反应中易得,2个电子而形成阴离子,故选项说法正确。 D、由某元素的原子结构示意图,有3个电子层,故选项说法正确。 故选:A。 6.下列四种粒子的结构示意图中,说法正确的是( ) A.它们表示四种不同的元素 B.②表示的元素在化合物中通常显+2价 C.①③④表示的元素都是非金属元素 D.①④表示的是阳离子 【答案】B 【解析】A、质子数决定元素种类,上述②④中质子数都是11,属于同种元素,故上图表示三种不同元素;错误; B、②的最外层电子数是2,所以化学反应中易失掉最外层的2个电子,而达到稳定结构;表示的元素在化合物中通常显+2价;正确; C、①中质子数为8,属于氧元素,④的质子数是12,是镁元素,③的质子数是11,是钠元素,所以①是非金属元素,③④属于金属元素;错误; D、①中质子数为8,核外电子数为10,质子数小于核外电子数,是阴离子;④质子数为12,核外电子数为10,质子数大于核外电子数,是阳离子。故D错误。 故选:B。 7.中国科研团队首次证实了天然铀单质的存在。用于核电工业的一种铀原子中含有92个质子和143个中子。有关该原子的说法不正确的是( ) A.相对原子质量为143 B.原子序数为92 C.核外电子数为92 D.属于金属元素 【答案】A 【解析】A、由于相对原子质量≈质子数+中子数,143是中子数,不是相对原子质量,故说法错误; B、原子中质子数等于原子序数,质子数是92,则原子序数为92,故说法正确; C、原子中质子数等于核外电子数,故铀核外含有92个电子,故说法正确; D、由于铀的元素名称铀中含有偏旁“钅”故该元素属于金属元素,故说法正确; 故选:A。 8.下列微粒结构示意图中,表示阳离子的是( ) A. B. C. D. 【答案】D 【解析】A、质子数=核外电子数=11,为原子,故选项错误。 B、质子数=核外电子数=10,为原子,故选项错误。 C、质子数=核外电子数=8,为原子,故选项错误。 D、质子数=11,核外电子数=10,质子数>核外电子数,为阳离子,故选项正确。 故选:D。 9.原子和离子既有联系又有差别,下列对于同元素原子和离子差别表述错误的是( ) A.原子整体上不显电性,离子显电性 B.原子中质子数等于电子数,离子中质子数不等于电子数 C.很多离子具有相对稳定的结构,而原子(稀有气体元素的原子除外)一般不是相对稳定的结构 D.离子的相对原子质量不等于原子的相对原子质量 【答案】D 【解析】A.原子整体上不显电性,离子显电性,故A正确; B.原子中质子数等于电子数,离子中质子数不等于电子数,故B正确; C.很多离子具有相对稳定的结构,而原子(稀有气体元素的原子除外)一般不是相对稳定的结构,故C正确; D.原子的相对原子质量主要集中在原子核上,离子和原子的主要区别是最外层电子不同,所以离子的相对原子质量等于原子的相对原子质量,故D错误; 故选:D。 二.填空题(共1小题) 10.试依据核电荷数为1﹣10的元素的原子结构示意图(图1),回答下列问题: (1)核电荷数为8的元素的原子得到两个电子后,形成的粒子的符号是 ; (2)由氟原子的结构示意图知,氟原子在化学反应中易 (填“失”或“得”) 电子。氟化钠常用作牙膏添加剂,能有效预防龋齿。氟化钠和氯化钠一样,都是由 (填“分子”、“原子”或“离子”) 直接构成。 【答案】(1)O2﹣; (2)得,离子; 【解析】(1)根据离子符号的表示法:在元素符号的右上角标明离子所带电荷数及电性,所以核电荷数为8的元素的原子得到两个电子后,形成的粒子的符号为:O2﹣;故填:O2﹣; (2) 氟是9号元素,其原子结构示意图为:;其最外层有7个电子,大于4个,在化学变化中易得到电子;由题干信息可知,氟化钠是由离子直接构成。故填:得,离子; 考点四、元素 1)定义:元素是质子数(即核电荷数)相同的一类原子的总称。 元素与原子的区别和联系: 元素 原子 区别 只表示一类原子的总称;只表示种类,不论个数,是宏观概念 既表示种类,又表示数量含义原子 是微观概念 化学变化中元素种类不变,但形态可能变化 化学变化中,原子种类和数量不变,但最外层电子数可能变化 联系 元素是同一类原子的总称,原子是构成元素的基本单元 元素之最:地壳中含量(质量分数)排在前五位的元素:氧、硅、铝、铁、钙 2)元素符号的意义:元素符号不仅表示一种元素,还表示这种元素的一个原子。如果物质由原子构成,元素符号还可以表示一种物质。 如果元素符号前加上系数,就只表示该原子的个数,只具有微观意义。 3)元素周期表 1、原子序数:原子序数=核内质子数=核电荷数=核外电子数 2、横行(周期):每一个横行叫一个周期,共有七个周期。同一周期元素原子的电子层数相等。 1、 纵行(族):每一个纵行叫一个族,共有18个纵行16个族,其中8、9、10三个纵行共同组成一个族。 4、每一格:能够表示该元素的名称、符号、原子序数、相对原子质量。 1.如图是碘元素在元素周期表中的部分信息,下列说法正确的是( ) A.碘的相对原子质量为126.9g B.碘原子的核外电子数为53 C.碘原子的中子数为53 D.碘元素属于金属元素 【答案】B 【解析】A、碘的相对原子质量为126.9,单位不是g,该选项说法不正确; B、碘原子的核外电子数为53,该选项说法正确; C、碘原子的中子数不是53,约等于相对原子质量和质子数之差,该选项说法不正确; D、碘的偏旁是“石”,因此碘元素属于非金属元素,该选项说法不正确。 故选:B。 2.金属元素种类高达八十余种,性质相似。地球上金属资源广泛存在于地壳和海洋中,地壳中含量最高的金属元素是( ) A.铜 B.铁 C.钠 D.铝 【答案】D 【解析】地壳含量较多的元素(前四种)按含量从高到低的排序为:氧、硅、铝、铁,其中含量最多的金属元素是铝元素。 故选:D。 3.如图为地壳中各元素的含量示意图。则X代表的元素是( ) A.Si B.O C.Fe D.Ca 【答案】A 【解析】地壳含量较多的元素(前四种)按含量从高到低的排序为:氧、硅、铝、铁,则X代表的元素是硅元素,其元素符号为Si。 故选:A。 4.老年人缺钙易导致骨质疏松,这里的“钙”指的是( ) A.分子 B.原子 C.单质 D.元素 【答案】D 【解析】老年人缺钙易导致骨质疏松,这里的“钙”不是以单质、分子、原子等形式存在,这里所指的“钙”是强调存在的元素,与具体形态无关。 故选:D。 5.下列各组元素中,元素符号的第一个字母相同的一组是( ) A.锰、钛 B.镁、金 C.铅、铂 D.银、汞 【答案】C 【解析】A、锰、钛元素的元素符号分别是Mn、Ti,第一个字母不同,故选项错误。 B、镁、金元素的元素符号分别是Mg、Au,第一个字母不同,故选项错误。 C、铅、铂元素的元素符号分别是Pb、Pt,第一个字母相同,故选项正确。 D、银、汞元素的元素符号分别是Ag、Hg,第一个字母不同,故选项错误。 故选:C。 6.元素周期表是学习和研究化学的重要工具,如图是元素周期表的一部分,其中X、Y、Z代表三种不同的元素,下列说法中正确的是( ) A.原子序数X>Y B.核外电子数Y=Z C.Z和X化学性质相似 D.X和Z的电子层数相同 【答案】C 【解析】A、元素周期表是按原子序数递增的顺序排列的,则原子序数X<Y,故选项说法错误。 B、元素周期表是按原子序数递增的顺序排列的,原子中原子序数=核电荷数=质子数=核外电子数,原子序数Y<Z,则核外电子数Y<Z,故选项说法错误。 C、同一族元素的原子最外层电子数相同,Z和X的最外层电子数相同,它们的化学性质相似,故选项说法正确。 D、X和Z位于不同的周期,周期数=原子核外电子层数,X和Z的电子层数不同,故选项说法错误。 故选:C。 7.氢元素与钠元素的本质区别是( ) A.电子数不同 B.质子数不同 C.中子数不同 D.最外层电子数不同 【答案】B 【解析】元素是质子数(即核电荷数)相同的一类原子的总称,不同种元素最本质的区别是质子数(即核电荷数)不同,所以氢元素与钠元素的本质区别是质子数(即核电荷数)不同。 故选:B。 8.中美科学家合作研究证实全硼富勒烯(B40)的存在。如图为硼元素在元素周期表中的信息,下列说法正确的是( ) A.全硼富勒烯是一种新型化合物 B.硼元素属于金属元素 C.硼的相对原子质量为10.81g D.硼原子最外层有3个电子 【答案】D 【解析】A、全硼富勒烯的化学式为B40,属于单质,故选项说法错误。 B、根据元素周期表中的一格可知,中间的汉字表示元素名称,该元素的名称是硼,带“石”字旁,属于非金属元素,故选项说法错误。 C、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为10.81,相对原子质量单位是“1”,不是“克”,故选项说法错误。 D、根据元素周期表中的一格可知,左上角的数字为3,表示原子序数为3;根据原子中原子序数=核电荷数=质子数=核外电子数,则该元素的原子核外电子数为3,故选项说法正确。 故选:D。 二.填空题(共2小题) 9.2019年被定为“国际化学元素周期表年”,以纪念元素周期表诞生150周年,如图为元素周期表的一部分(X元素信息不全),回答下列问题: (1)碳原子的质子数为 ; (2)X属于 (填“金属”或“非金属”)元素; (3)氧的相对原子质量为 ; (4)三种元素原子的核外电子数 (填“相同”或“不相同”) 【答案】(1)6; (2)非金属元素; (3)16.00; (4)6;非金属;16.00;不相同。 【解析】(1)碳原子的质子数为6; (2)X(氮元素)属于非金属元素; (3)氧的相对原子质量为16.00; (4)三种元素原子的核外电子数依次是6、7、8。 故填:6;非金属;16.00;不相同。 10.元素周期表是化学学习和研究的重要工具。如图是元素周期表的一部分。 (1)相对原子质量为22.99的元素属 (填“金属”或“非金属”)。 (2)科学家宣布,现已人工合成了第120号元素,则此元素的核电荷数为 。 (3)与磷元素化学性质相似的元素是 (填元素名称)。 (4)表中不同种元素最本质的区别是 (填字母) A.质子数不同 B.相对原子质量不同 C.中子数不同 (5)根据下列粒子的结构示意图,我能回答下列问题: ①属于阴离子的是 (填序号);②C的电子层数为 ; ③D的符号是 。 【答案】故答案为: (1)金属; (2)120; (3)氮; (4)A; (5)①B;②3;③Al3+。 【解析】(1)汉字下面的数字表示相对原子质量,相对原子质量为22.99的元素为钠元素,属于金属元素。 (2)原子中原子序数=核电荷数=质子数,现已人工合成了第120号元素,则此元素的核电荷数为120。 (3)同一族的元素具有相似的化学性质,则与磷元素化学性质相似的元素是氮元素。 (4)元素是质子数(即核电荷数)相同的一类原子的总称,表中不同种元素最本质的区别是质子数不同。 (5)①B、质子数=9,核外电子数=10,质子数<核外电子数,为阴离子。 ②弧线表示电子层,C的电子层数为3。 ③D质子数=13,核外电子数=10,质子数>核外电子数,为带3个单位正电荷的铝离子,其离子符号为:Al3+。查看更多