- 2021-04-15 发布 |
- 37.5 KB |
- 31页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
全国统一高考化学试卷新课标Ⅱ
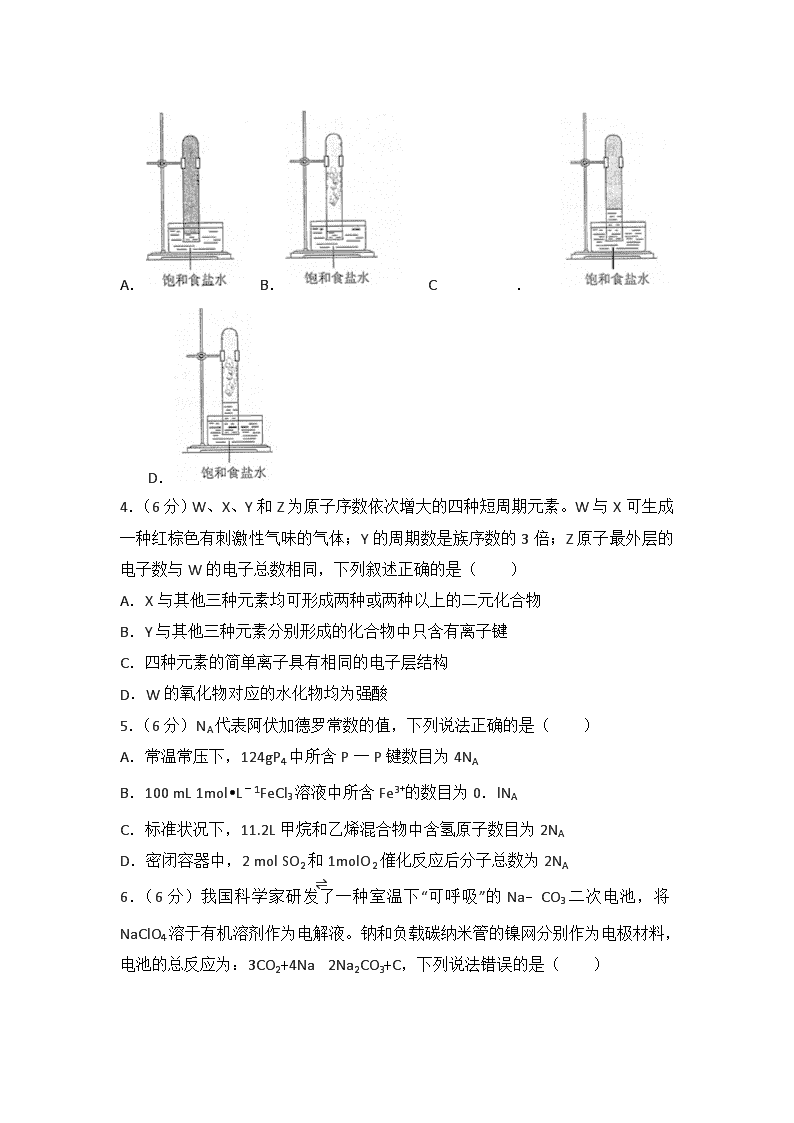
2018年全国统一高考化学试卷(新课标Ⅱ) 一、选择题:本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。 1.(6分)化学与生活密切相关,下列说法错误的是( ) A.碳酸钠可用于去除餐具的油污 B.漂白粉可用于生活用水的消毒 C.氢氧化铝可用于中和过多胃酸 D.碳酸钡可用于胃肠X射线造影检查 2.(6分)研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如图所示)。下列叙述错误的是( ) A.雾和霾的分散剂相同 B.雾霾中含有硝酸铵和硫酸铵 C.NH3是形成无机颗粒物的催化剂 D.雾霾的形成与过度施用氮肥有关 3.(6分)实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。 在光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是( ) A. B. C. D. 4.(6分)W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同,下列叙述正确的是( ) A.X与其他三种元素均可形成两种或两种以上的二元化合物 B.Y与其他三种元素分别形成的化合物中只含有离子键 C.四种元素的简单离子具有相同的电子层结构 D.W的氧化物对应的水化物均为强酸 5.(6分)NA代表阿伏加德罗常数的值,下列说法正确的是( ) A.常温常压下,124gP4中所含P一P键数目为4NA B.100 mL 1mol•L﹣1FeCl3溶液中所含Fe3+的数目为0.lNA C.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA D.密闭容器中,2 mol SO2和1molO2催化反应后分子总数为2NA 6.(6分)我国科学家研发了一种室温下“可呼吸”的Na﹣CO3二次电池,将NaClO4溶于有机溶剂作为电解液。钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na⇌2Na2CO3+C,下列说法错误的是( ) A.放电时,ClO4﹣向负极移动 B.充电时释放CO2,放电时吸收CO2 C.放电时,正极反应为:3CO2+4e﹣═2CO32﹣+C D.充电时,正极反应为:Na++e﹣═Na 7.(6分)下列实验过程可以达到实验目的是( ) 编号 实验目的 实验过程 A 配制 0.4000mol•L﹣1的NaOH溶液 称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250mL容量瓶中定容 B 探究维生素C的还原性 向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 C 制取并纯化氢气 向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸和 KMnO4溶液 D 探究浓度对反应速率的影响 向2支盛有5mL不同浓度 NaHSO3溶液的试管中同时加入2mL5%H2O2溶液,观察实验现象 A.A B.B C.C D.D 二、非选择题:每个试题考生必须作答。 8.(14分)我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示: 相关金属离子[c0(Mn+)=01mol•L﹣1]形成氢氧化物沉淀的pH范围如下: 金属离子 Fe3+ Fe2+ Zn2+ Cd2+ 开始沉淀的pH 1.5 6.3 6.2 7.4 沉淀完全的pH 2.8 8.3 8.2 9.4 回答下列问题: (1)焙烧过程中主要反应的化学方程式为 。 (2)滤渣1的主要成分除SiO2外还有 ;氧化除杂工序中ZnO的作用是 ,若不通入氧气,其后果是 。 (3)溶液中的Cd2+用锌粉除去,还原除杂工序中反应的离子方程式为 。 (4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为 ;沉积锌后的电解液可返回 工序继续使用。 9.(14分)CH4﹣CO2的催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题: (1)CH4﹣CO2催化重整反应为:CH4(g)+CO2(g)═2CO(g)+2H2(g)。 已知:C(s)+2H2(g)═CH4(g)△H=﹣75kJ•mol﹣1 C(s)+O2(g)=CO2(g)△H=﹣394kJ•mol﹣1 C(s)+(g)=CO(g)△H=﹣111kJ•mol﹣1 该催化重整反应的△H= kJ•mol﹣1.有利于提高CH4平衡转化率的条件是 (填标号)。 A.高温低压 B.低温高压 C.高温高压 D.低温低压 某温度下,在体积为2L的容器中加入2mol CH4、1molCO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为 mol2•L﹣2。 (2)反中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳碳量减少。相关数据如下表: 积碳反应 CH4(g)═C(s)+2H2(g) 消碳反应 CH2(g)═C(s)+2CO(g) △H/(kJ•mol﹣1) 75 172 活化能/(kJ•mol﹣1) 催化剂X 33 91 催化剂Y 43 72 ①由上表判断,催化剂X Y(填“优于或劣于”),理由是 。在反应进料气组成,压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如右图所示。升高温度时,下列关于积碳反应,消碳反应的平衡常数(K)和速率(v)的叙述正确的是 (填标号)。 A.K积、K消均增加 B.V积减小、V消增加 C.K积减小、K消增加 D.V消增加的倍数比V积增加的倍数大 ②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k•p(CH4)•[p(CO2)]﹣0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2 )下积碳量随时间的变化趋势如图所示,则Pa(CO2)、Pb(CO2)、Pc(CO2)从大到小的顺序为 。 10.(15分)K3[Fe(C2O4)3]•3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图,回答下列问题: (1)晒制蓝图时,用K3[Fe(C2O4)3]•3H2O作感光剂,以K3Fe[(CN)6]溶液为显色剂。其光解反应的化学方程式为2k3[Fe(C2O4)3]2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为 。 (2)某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。 ①通入氮气的目的是 。 ②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有 、 。 ③为防止倒吸,停止实验时应进行的操作是 。 ④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是: 。 (3)测定三草酸合铁酸钾中铁的含量。 ①称量mg样品于锥形瓶中,溶解后加稀H2SO4酸化,用cmol•L﹣1KMnO4溶液滴定至终点。滴定终点的现象是 。 ②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用cmol•L﹣1KMnO4溶液滴定至终点,消耗KMnO4溶液VmL.该晶体中铁的质量分数的表达式为 。 [化学一选修3:物质结构与性质](15分) 11.(15分)硫及其化合物有许多用途。相关物质的物理常数如表所示: H2S S8 FeS2 SO2 SO3 H2SO4 熔点/℃ ﹣85.5 115.2 >600(分解) ﹣75.5 16.8 10.3 沸点/℃ ﹣60.3 444.6 ﹣10.0 45.0 337.0 回答下列问题: (1)基态Fe原子价层电子的电子排布图(轨道表达式)为 ,基态S原子电子占据最高能级的电子云轮廓图为 形。 (2)根据价层电子对互斥理论,H2S,SO2,SO3的气态分子中,中心原子价层电子对数不同于其他分子的是 。 (3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为 。 (4)气态三氧化硫以单分子形式存在,其分子的立体构型为 形,其中共价键的类型有 种;固体三氧化硫中存在如图(b)所示的三氯分子。该分子中S原子的杂化轨道类型为 。 (5)FeS2晶体的晶胞如图(c)所示,晶胞边长为anm,FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为 g•cm﹣3;晶胞中Fe2+位于S22﹣所形成的八面体的体心,该正八面体的边长为 nm。 [化学一选修5:有机化学基础](15分) 12.以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物。由葡萄糖为原料合成E的路线如下: 回答下列问题: (1)葡萄糖的分子式为 。 (2)A中含有的官能团的名称为 。 (3)由B到C的反应类型为 。 (4)C的结构简式为 。 (5)由D到E的反应方程式为 。 (6)F是B的同分异构体,7.30g的F与足量饱和碳酸氢钠反应可释放出2.24L二氧化碳(标准状况),F的可能结构共有 种(不考虑立体异构);其中核磁共振氢谱为三组峰,峰面积比为3:1:1的结构简式为 。 2018年全国统一高考化学试卷(新课标Ⅱ) 参考答案与试题解析 一、选择题:本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。 1.(6分)化学与生活密切相关,下列说法错误的是( ) A.碳酸钠可用于去除餐具的油污 B.漂白粉可用于生活用水的消毒 C.氢氧化铝可用于中和过多胃酸 D.碳酸钡可用于胃肠X射线造影检查 【分析】A.碳酸钠水溶液呈碱性,碱性条件下促进油脂水解; B.当把漂白粉撒到水中时,发生反应Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,HClO具有强氧化性; C.氢氧化铝属于弱碱,能中和酸; D.碳酸钡能和稀盐酸反应生成有毒的氯化钡,但是硫酸钡不溶于稀盐酸、不溶于水。 【解答】解:A.碳酸钠水解生成NaOH而导致其水溶液呈碱性,碱性条件下促进油脂水解,从而除去油污,故A正确; B.当把漂白粉撒到水中时,发生反应Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,HClO具有强氧化性而杀菌消毒,所以漂白粉可用于生活用水的消毒,故B正确; C.氢氧化铝属于弱碱,能中和胃酸中的盐酸而降低胃液酸性,所以氢氧化铝可以用于中和过多胃酸,故C正确; D.碳酸钡能和稀盐酸反应生成有毒的氯化钡,但是硫酸钡不溶于稀盐酸、不溶于水,所以应该用硫酸钡而不是碳酸钡作胃肠X射线造影检查,故D错误; 故选:D。 【点评】本题考查物质结构和性质,侧重考查化学在生产生活中的应用,明确物质性质是解本题关键,会运用化学知识正确解释生产生活现象,题目难度不大。 2.(6分)研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如图所示)。下列叙述错误的是( ) A.雾和霾的分散剂相同 B.雾霾中含有硝酸铵和硫酸铵 C.NH3是形成无机颗粒物的催化剂 D.雾霾的形成与过度施用氮肥有关 【分析】由图示可知雾霾的主要成分为颗粒物,其中无机颗粒物的主要成分为铵盐,可由氨气和硝酸、硫酸反应生成,以此解答该题。 【解答】解:A.雾和霾的分散剂都是空气,故A正确; B.由图示可知雾霾中含有硝酸铵和硫酸铵,故B正确; C.由图示可知氨气参与反应生成铵盐,为反应物,不是催化剂,故C错误; D.无机颗粒物的主要成分为铵盐,可形成雾霾,可知雾霾的形成与过度施用氮肥有关,故D正确。 故选:C。 【点评】本题考查环境污染问题,侧重于化学与生活、生产以及环境保护的考查,有利于培养学生良好的科学素养,树立环保意识,难度不大。 3.(6分)实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。 在光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是( ) A. B. C. D. 【分析】CH4与Cl2在光照条件下发生取代反应,取代反应的产物有CH3Cl(g),CH2Cl2(l),CHCl3(l),CCl4(l)和HCl。 【解答】解:CH4与Cl2在光照条件下发生取代反应,取代反应的产物有CH3Cl(g),CH2Cl2(l),CHCl3(l),CCl4(l)和HCl,产生的CH2Cl2(l),CHCl3(l),CCl4(l)能附着在管壁上形成油状液滴,由于试管连接饱和食盐水,HCl在其中的溶解度降低,所以HCl能和管内部的空气中的水蒸气形成白雾附着在管内壁上,整个反应是气体体积减少的反应,管内液面上升,所以D选项正确, 故选:D。 【点评】本题考查CH4与Cl2在光照下的取代反应,明确反应过程,产物及其物理状态和化学性质是解题的关键,为高频考点,题目难度不大,是基础题。 4.(6分)W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同,下列叙述正确的是( ) A.X与其他三种元素均可形成两种或两种以上的二元化合物 B.Y与其他三种元素分别形成的化合物中只含有离子键 C.四种元素的简单离子具有相同的电子层结构 D.W的氧化物对应的水化物均为强酸 【分析】W、X、Y和Z为原子序数依次增大的四种短周期元素,W与X可生成一种红棕色有刺激性气味的气体,该气体是NO2,则W、X分别是N、O元素;Y的周期数是族序数的3倍,其原子序数大于O,则Y为Na元素;Z原子最外层的电子数与W的电子总数相同,为Cl元素; A.X是O元素,与W形成的二元化合物有NO、NO2、N2O5等;与Y元素形成的二元化合物有Na2O、Na2O2;有Z元素形成的二元化合物有ClO2、Cl2O7等; B.Na与O元素形成的化合物Na2O2中含有共价键; C.形成的简单离子中W、X、Y电子层结构相同; D.W的氧化物的水化物HNO2是弱酸。 【解答】解:W、X、Y和Z为原子序数依次增大的四种短周期元素,W与X可生成一种红棕色有刺激性气味的气体,该气体是NO2,则W、X分别是N、O元素;Y的周期数是族序数的3倍,其原子序数大于O,则Y为Na元素;Z原子最外层的电子数与W的电子总数相同,为Cl元素; A.X是O元素,与W形成的二元化合物有NO、NO2、N2O5等;与Y元素形成的二元化合物有Na2O、Na2O2;有Z元素形成的二元化合物有ClO2、Cl2O7等,所以X与其他三种元素均可形成两种或两种以上的二元化合物,故A正确; B.Na与O元素形成的化合物Na2O2的电子式为,含有共价键和离子键,故B错误; C.形成的简单离子中W、X、Y电子层有2个,而Z离子核外电子层有3个,所以这四种元素简单离子电子层结构不相同,故C错误; D.W的氧化物的水化物HNO3是强酸,而HNO2为弱酸,故D错误; 故选:A。 【点评】本题考查原子结构和元素周期律,侧重考查学生分析、判断及知识综合运用能力,明确原子结构、物质结构、元素周期表结构、元素周期律即可解答,注意规律中的特殊现象,题目难度不大。 5.(6分)NA代表阿伏加德罗常数的值,下列说法正确的是( ) A.常温常压下,124gP4中所含P一P键数目为4NA B.100 mL 1mol•L﹣1FeCl3溶液中所含Fe3+的数目为0.lNA C.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA D.密闭容器中,2 mol SO2和1molO2催化反应后分子总数为2NA 【分析】A.1molP4含有6molP﹣P键; B.FeCl3溶液中存在Fe3+的水解; C.1mol乙烷含有4molH,1mol乙烯含有4molH; D.SO2和O2的催化反应为可逆反应。 【解答】解:A.124gP4的物质的量为=1mol,根据P4的结构式,1molP4含有6molP﹣P键,即含有P﹣P键数目为6NA,故A错误; B.FeCl3溶液中存在Fe3+的水解,所以100 mL 1mol•L﹣1FeCl3溶液中所含Fe3+的数目小于0.1mol,即小于0.1NA,故B错误; C.1mol乙烷含有4molH,1mol乙烯含有4molH,二者无论按何种比例,相当于1mol混合气体含有4molH,则标准状况下,11.2L甲烷和乙烯混合物中含H有=2mol,即含氢原子数目为2NA,故C正确; D.SO2和O2的催化反应为可逆反应,反应不可能完全进行,存在一个化学平衡,所以密闭容器中,2 mol SO2和1molO2催化反应后分子总数不一定为2mol,即不一定为2NA,故D错误, 故选:C。 【点评】本题考查阿伏伽德罗常数的简单计算,注意盐类水解知识和化学平衡知识的运用,明确P4的结构是解题的关键,为易错点,题目难度不大,是基础题。 6.(6分)我国科学家研发了一种室温下“可呼吸”的Na﹣CO3二次电池,将NaClO4溶于有机溶剂作为电解液。钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na⇌2Na2CO3+C,下列说法错误的是( ) A.放电时,ClO4﹣向负极移动 B.充电时释放CO2,放电时吸收CO2 C.放电时,正极反应为:3CO2+4e﹣═2CO32﹣+C D.充电时,正极反应为:Na++e﹣═Na 【分析】A.放电时,Na失电子作负极、Ni作正极,电解质溶液中阴离子向负极移动; B.放电时Na作负极、Ni作正极,充电时Ni作阳极、Na作阴极,则放电电池反应式为3CO2+4Na⇌2Na2CO3+C、充电电池反应式为2Na2CO3+C⇌3CO2+4Na; C.放电时负极反应式为Na﹣e﹣=Na+、正极反应式为3CO2+4e﹣═2CO32﹣+C; D.充电时,原来的正极作电解池的阳极,失电子发生氧化反应。 【解答】解:A.放电时,Na失电子作负极、Ni作正极,电解质溶液中阴离子向负极移动,所以ClO4﹣向负极移动,故A正确; B.放电时Na作负极、Ni作正极,充电时Ni作阳极、Na作阴极,则放电电池反应式为3CO2+4Na⇌2Na2CO3+C、充电电池反应式为2Na2CO3+C⇌3CO2+4Na,所以充电时释放CO2,放电时吸收CO2,故B正确; C.放电时负极反应式为Na﹣e﹣=Na+、正极反应式为3CO2+4e﹣═2CO32﹣+C,故C正确; D.充电时,原来的正极Ni作电解池的阳极,Na作电解池阴极,则正极发生的反应为原来正极反应式的逆反应,即2CO32﹣+C﹣4e﹣=3CO2,负极发生的反应为Na++e﹣═Na,故D错误; 故选:D。 【点评】 本题考查原电池原理,明确充电电池中正负极、阴阳极发生反应关系是解本题关键,侧重考查学生分析判断能力,难点是电极反应式的书写,题目难度不大。 7.(6分)下列实验过程可以达到实验目的是( ) 编号 实验目的 实验过程 A 配制 0.4000mol•L﹣1的NaOH溶液 称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250mL容量瓶中定容 B 探究维生素C的还原性 向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 C 制取并纯化氢气 向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸和 KMnO4溶液 D 探究浓度对反应速率的影响 向2支盛有5mL不同浓度 NaHSO3溶液的试管中同时加入2mL5%H2O2溶液,观察实验现象 A.A B.B C.C D.D 【分析】A.在转移溶液之前应该将溶液冷却至室温,否则配制的溶液浓度偏高; B.氯化铁具有氧化性、维生素C具有还原性,二者发生氧化还原反应而使溶液变色; C.高锰酸钾溶液和氢气、HCl都不反应,且最后通过酸性高锰酸钾溶液会导致得到的氢气中含有水蒸气; D.要探究浓度对化学反应速率影响实验时,应该只有浓度不同其它条件必须完全相同。 【解答】解:A.NaOH溶解过程是放热的,导致溶液浓度高于室温,如果在转移溶液之前未将溶液冷却至室温,否则配制的溶液体积偏小,则配制溶液浓度偏高,所以不能实现实验目的,故A不选; B.氯化铁具有氧化性、维生素C具有还原性,二者发生氧化还原反应而生成亚铁离子,导致溶液由黄色变为浅绿色,则溶液变色,所以能实现实验目的,故B选; C.高锰酸钾溶液和氢气、HCl都不反应,且最后通过酸性高锰酸钾溶液会导致得到的氢气中含有水蒸气,所以不能实现实验目的,用NaOH吸收HCl、用浓硫酸干燥气体即可,故C不选; D.要探究浓度对化学反应速率影响实验时,应该只有浓度不同其它条件必须完全相同,该实验没有明确说明温度是否相同,并且实验现象也不明显,所以不能实现实验目的,故D不选, 故选:B。 【点评】本题考查化学实验评价,涉及溶液配制、性质检验、物质的分离提纯、化学反应速率影响因素探究等知识点,侧重考查学生实验操作、实验分析和判断能力,明确实验原理及物质性质是解本题关键,题目难度不大。 二、非选择题:每个试题考生必须作答。 8.(14分)我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示: 相关金属离子[c0(Mn+)=01mol•L﹣1]形成氢氧化物沉淀的pH范围如下: 金属离子 Fe3+ Fe2+ Zn2+ Cd2+ 开始沉淀的pH 1.5 6.3 6.2 7.4 沉淀完全的pH 2.8 8.3 8.2 9.4 回答下列问题: (1)焙烧过程中主要反应的化学方程式为 2ZnS+3O22ZnO+2SO2 。 (2)滤渣1的主要成分除SiO2外还有 PbSO4 ;氧化除杂工序中ZnO的作用是 调节溶液的pH到2.8﹣6.2之间,使Fe3+完全沉淀 ,若不通入氧气,其后果是 无法除去溶液中Fe2+ 。 (3)溶液中的Cd2+用锌粉除去,还原除杂工序中反应的离子方程式为 Cd2++Zn=Cd+Zn2+ 。 (4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为 Zn2++2e﹣=Zn ;沉积锌后的电解液可返回 溶浸 工序继续使用。 【分析】焙烧过程中发生的反应有2ZnS+3O22ZnO+2SO2、4FeS+7O22Fe2O3+4SO2、2PbS+3O22PbO+2SO2、2CdS+3O22CdO+2SO2,所以焙烧过程中生成的气体是SO2;然后加入稀硫酸酸浸,FeS(未焙烧)、ZnO、Fe2O3、PbO、CdO和稀硫酸反应生成Fe 2+、Zn 2+、Fe 3+、PbSO4、Cd2+,所以滤渣1为未反应的SiO2和生成的PbSO4; 氧化除杂时通入氧气,使Fe 2+转化为Fe 3+,加入ZnO和稀硫酸反应调节溶液的pH值,将Fe 3+转化为Fe(OH)3而除去Fe 3+,滤渣2为生成的Fe(OH)3;然后向溶液中加入Zn,Zn和Cd2+发生氧化还原生成Cd,然后过滤得到滤液,滤渣3为Cd;将滤液电解得到Zn; (1)焙烧过程中ZnS、FeS、CdS、PbS都和氧气发生氧化还原反应,但是ZnS的反应是主要反应; (2)滤渣1的主要成分除SiO2外还有生成的硫酸铅;ZnO能和酸反应生成盐和水,从而改变溶液的pH值;如果不通入氧气,亚铁离子影响Zn的制备; (3)Cd2+和Zn发生氧化还原反应生成Cd; (4)电解硫酸锌溶液制备单质锌时,阴极上溶液中Zn 2+ 得电子生成Zn;沉积锌后的电解液中锌离子浓度降低,可以通过返回溶浸工序继续使用。 【解答】解:焙烧过程中发生的反应有2ZnS+3O22ZnO+2SO2、4FeS+7O22Fe2O3+4SO2、2PbS+3O22PbO+2SO2、2CdS+3O22CdO+2SO2,所以焙烧过程中生成的气体是SO2;然后加入稀硫酸酸浸,FeS(未焙烧)、ZnO、Fe2O3、PbO、CdO和稀硫酸反应生成Fe 2+、Zn 2+、Fe 3+、PbSO4、Cd2+,所以滤渣1为未反应的SiO2和生成的PbSO4; 氧化除杂时通入氧气,使Fe 2+转化为Fe 3+,加入ZnO和稀硫酸反应调节溶液的pH值,将Fe 3+转化为Fe(OH)3而除去Fe 3+,滤渣2为生成的Fe(OH)3;然后向溶液中加入Zn,Zn和Cd2+发生氧化还原生成Cd,然后过滤得到滤液,滤渣3为Cd;将滤液电解得到Zn; (1)焙烧过程中ZnS、FeS、CdS、PbS都和氧气发生氧化还原反应,但是ZnS的反应是主要反应,所以其主要方程式为2ZnS+3O22ZnO+2SO2, 故答案为:2ZnS+3O22ZnO+2SO2; (2)滤渣1的主要成分除SiO2外还有PbO和稀硫酸生成的沉淀PbSO4;ZnO能和酸反应生成盐和水,从而改变溶液的pH值,使溶液的pH调节在2.8﹣6.2之间,从而Fe 3+将转化为沉淀除去Fe 3+;Fe2+、Zn2+开始沉淀、完全沉淀的pH相近,如果不通入氧气,Fe2+不能完全除去而影响Zn的制备, 故答案为:PbSO4;调节溶液的pH到2.8﹣6.2之间,使Fe3+完全沉淀;无法除去溶液中Fe2+; (3)Cd2+和Zn发生氧化还原反应生成Cd,离子方程式为Cd2++Zn=Cd+Zn2+, 故答案为:Cd2++Zn=Cd+Zn2+; (4)电解硫酸锌溶液制备单质锌时,阴极上溶液中Zn 2+ 得电子生成Zn,电极反应式为Zn2++2e﹣=Zn;沉积锌后的电解液中锌离子浓度降低,可以通过返回溶浸工序继续使用,从而减少资源浪费, 故答案为:Zn2++2e﹣=Zn;溶浸。 【点评】本题考查物质制备,综合性较强,涉及物质分离提纯、电解原理、氧化还原反应、方程式的书写等知识点,明确流程图中各物质的性质、发生的反应及物质分离提纯方法是解本题关键,知道每一步的目的及原理,题目难度中等。 9.(14分)CH4﹣CO2的催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题: (1)CH4﹣CO2催化重整反应为:CH4(g)+CO2(g)═2CO(g)+2H2(g)。 已知:C(s)+2H2(g)═CH4(g)△H=﹣75kJ•mol﹣1 C(s)+O2(g)=CO2(g)△H=﹣394kJ•mol﹣1 C(s)+(g)=CO(g)△H=﹣111kJ•mol﹣1 该催化重整反应的△H= +247 kJ•mol﹣1.有利于提高CH4平衡转化率的条件是 A (填标号)。 A.高温低压 B.低温高压 C.高温高压 D.低温低压 某温度下,在体积为2L的容器中加入2mol CH4、1molCO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为 mol2•L﹣2。 (2)反中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳碳量减少。相关数据如下表: 积碳反应 CH4(g)═C(s)+2H2(g) 消碳反应 CH2(g)═C(s)+2CO(g) △H/(kJ•mol﹣1) 75 172 活化能/(kJ•mol﹣1) 催化剂X 33 91 催化剂Y 43 72 ①由上表判断,催化剂X 劣于 Y(填“优于或劣于”),理由是 催化剂X较催化剂Y,积碳反应时,活化能低,反应速率快,消碳反应时,活化能高,反应速率慢,综合考虑,催化剂X较催化剂Y更利于积碳反应,不利于消碳反应,会降低催化剂活性 。在反应进料气组成,压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如右图所示。升高温度时,下列关于积碳反应,消碳反应的平衡常数(K)和速率(v)的叙述正确的是 AD (填标号)。 A.K积、K消均增加 B.V积减小、V消增加 C.K积减小、K消增加 D.V消增加的倍数比V积增加的倍数大 ②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k•p(CH4)•[p(CO2)]﹣0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则Pa(CO2)、Pb(CO2)、Pc(CO2)从大到小的顺序为 pc(CO2)>pb(CO2)>pa(CO2) 。 【分析】(1)①C(s)+2H2(g)═CH4(g)△H=﹣75kJ•mol﹣1 ②C(s)+O2(g)=CO2(g)△H=﹣394kJ•mol﹣1 ③C(s)+(g)=CO(g)△H=﹣111kJ•mol﹣1 将方程式2③﹣①﹣②得CH4(g)+CO2(g)═2CO(g)+2H2(g),△H进行相应的改变; 要提高CH4平衡转化率应该使平衡正向移动,但是不能通过增大甲烷浓度实现; 达到平衡时CO2的转化率是50%,根据方程式知,参加反应的n(CO2)=n(CH4)=1mol×50%=0.5mol,生成的n(CO)=n(H2)=1mol, 该化学反应CH4(g)+CO2(g)═2CO(g)+2H2(g), 开始(mol/L)1 0.5 0 0 反应(mol/L)0.25 0.25 0.5 0.5 平衡(mol/L)0.75 0.25 0.5 0.5 化学平衡常数K=; (2)①消碳反应越容易发生,催化剂活性越好,消碳反应所需活化能越低,消碳反应越容易进行; 积碳反应和消碳反应的正反应都是吸热反应,升高温度平衡正向移动,但是积碳反应更容易进行,生成物浓度增大、反应物浓度降低; ②在一定温度下,相同时间内,沉积的碳越多,则沉积碳生成速率越快,根据v=k•p(CH4)•[p(CO2)]﹣0.5(k为速率常数)知,p(CH4)一定时,沉积碳生成速率与二氧化碳压强成反比。 【解答】解:(1)①C(s)+2H2(g)═CH4(g)△H=﹣75kJ•mol﹣1 ②C(s)+O2(g)=CO2(g)△H=﹣394kJ•mol﹣1 ③C(s)+(g)=CO(g)△H=﹣111kJ•mol﹣1 将方程式2③﹣①﹣②得CH4(g)+CO2(g)═2CO(g)+2H2(g),△H=2(﹣111kJ•mol﹣1)﹣(﹣75kJ•mol﹣1)﹣(﹣394kJ•mol﹣1)=+247kJ/mol; 要提高CH4平衡转化率应该使平衡正向移动,但是不能通过增大甲烷浓度实现,该反应的正反应是一个反应前后气体体积增加的吸热反应,升高温度、减小压强能使平衡正向移动,增大甲烷转化率, 达到平衡时CO2的转化率是50%,根据方程式知,参加反应的n(CO2)=n(CH4)=1mol×50%=0.5mol,生成的n(CO)=n(H2)=1mol, 该化学反应CH4(g)+CO2(g)═2CO(g)+2H2(g), 开始(mol/L)1 0.5 0 0 反应(mol/L)0.25 0.25 0.5 0.5 平衡(mol/L)0.75 0.25 0.5 0.5 化学平衡常数K===; 故答案为:+247;高温低压;; (2)① 根据表中数据知,催化剂X较催化剂Y,积碳反应时,活化能低,反应速率快,消碳反应时,活化能高,反应速率慢,综合考虑,催化剂X较催化剂Y更利于积碳反应,不利于消碳反应,会降低催化剂活性; 积碳反应和消碳反应的正反应都是吸热反应,升高温度平衡正向移动,生成物浓度增大、反应物浓度降低,所以积碳反应、消碳反应平衡常数都增大,但是积碳反应更容易进行,所以积碳反应平衡常数增大倍数大于消碳反应,V积增加的倍数比V消增加的倍数大, 所以选AD; 故答案为:劣于;催化剂X较催化剂Y,积碳反应时,活化能低,反应速率快,消碳反应时,活化能高,反应速率慢,综合考虑,催化剂X较催化剂Y更利于积碳反应,不利于消碳反应,会降低催化剂活性; AD; ②在一定温度下,相同时间内,沉积的碳越多,则沉积碳生成速率越快,根据v=k•p(CH4)•[p(CO2)]﹣0.5(k为速率常数)知,p(CH4)一定时,沉积碳生成速率与二氧化碳压强成反比,根据图知,积碳量a>b>c,则pc(CO2)>pb(CO2)>pa(CO2), 故答案为:pc(CO2)>pb(CO2)>pa(CO2)。 【点评】本题考查化学反应原理,涉及盖斯定律、化学平衡计算、外界条件对化学平衡影响等知识点,侧重考查学生分析、推断及图象分析能力,正确理解题给信息及出题人目的是解本题关键,难点是(2)题分析解答。 10.(15分)K3[Fe(C2O4)3]•3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图,回答下列问题: (1)晒制蓝图时,用K3[Fe(C2O4)3]•3H2O作感光剂,以K3Fe[(CN)6]溶液为显色剂。其光解反应的化学方程式为2k3[Fe(C2O4)3]2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为 3FeC2O4+2K3[Fe(CN)6]=Fe3[Fe(CN)6]2↓+3K2C2O4 。 (2)某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。 ①通入氮气的目的是 排出装置中原有空气,避免O2和CO2干扰实验,同时用N2把装置A、E中反应生成的气体排出进行后续检验 。 ②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有 CO 、 CO2 。 ③为防止倒吸,停止实验时应进行的操作是 先关闭A、E中的酒精灯,冷却后再停止通入N2 。 ④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是: 取少量装置A中残留物放入试管中,加入稀硫酸溶解,再滴加几滴KSCN溶液,若观察到溶液变红,则证明A中残留物中含Fe2O3 。 (3)测定三草酸合铁酸钾中铁的含量。 ①称量mg样品于锥形瓶中,溶解后加稀H2SO4酸化,用cmol•L﹣1KMnO4溶液滴定至终点。滴定终点的现象是 当滴入最后一滴滴入后,溶液变成浅红色,且半分钟内不褪色 。 ②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用cmol•L﹣1KMnO4溶液滴定至终点,消耗KMnO4溶液VmL.该晶体中铁的质量分数的表达式为 ×100%或×100%(或%) 。 【分析】(1)显色过程是FeC2O4中的亚铁离子与[Fe(CN)6]3﹣结合成蓝色沉淀,据此写出该后续方程式; (2)①反应开始前通氮气,可排净装置中空气,以免氧气、二氧化碳对实验干扰,同时把装置A、E中反应生成的气体排出; ②B中澄清石灰水变浑浊证明含有二氧化碳,E中固体变红、F中澄清石灰水变浑浊证明分解产物中有一氧化碳; ③为避免倒吸,需先关闭反应装置中的酒精灯,冷却后再停止通入N2; ④检验Fe2O3,需将Fe2O3转化成铁离子,再用硫氰化钾进行检验; (3)①用KMnO4溶液滴定亚铁离子,滴定终点溶液变成浅红色; ②根据n=cV计算出消耗高锰酸根离子的物质的量,根据化合价升降相等可得反应关系式5Fe2+~MnO4﹣,则n(Fe2+)=5n(MnO4﹣),然后根据m=nM计算出样品中含有铁元素的质量,最后根据×100%计算。 【解答】解:(1)显色过程是FeC2O4中的亚铁离子与[Fe(CN)6]3﹣结合成蓝色沉淀的反应,该反应的化学方程式为:3FeC2O4+2K3[Fe(CN)6]=Fe3[Fe(CN)6]2↓+3K2C2O4, 故答案为:3FeC2O4+2K3[Fe(CN)6]=Fe3[Fe(CN)6]2↓+3K2C2O4;(2)①在反应开始前通入N2,可排净装置中的空气,以免O2和CO2对实验干扰,同时用N2把装置A、E中反应生成的气体排出进行后续检验, 故答案为:排出装置中原有空气,避免O2和CO2干扰实验,同时用N2把装置A、E中反应生成的气体排出进行后续检验; ②B中澄清石灰水变浑浊证明分解产物中一定含有CO2,E中固体变红、F中澄清石灰水变浑浊证明分解产物中有还原性气体CO, 故答案为:CO;CO2; ③为防止倒吸,需要先关闭反应装置中的酒精灯,冷却至常温过程中需保持一直通入N2, 故答案为:先关闭A、E中的酒精灯,冷却后再停止通入N2; ④检验固体中是否存在Fe2O3,需将Fe2O3转化成铁离子,再用硫氰化钾进行检验,操作方法为:取少量装置A中残留物放入试管中,加入稀硫酸溶解,再滴加几滴KSCN溶液,若观察到溶液变红,则证明A中残留物中含Fe2O3, 故答案为:取少量装置A中残留物放入试管中,加入稀硫酸溶解,再滴加几滴KSCN溶液,若观察到溶液变红,则证明A中残留物中含Fe2O3; (3)①用KMnO4溶液滴定亚铁离子,滴定终点溶液变成浅红色,则滴定终点为:当滴入最后一滴滴入后,溶液变成浅红色,且半分钟内不褪色, 故答案为:当滴入最后一滴滴入后,溶液变成浅红色,且半分钟内不褪色; ②用cmol•L﹣1KMnO4溶液滴定至终点,消耗KMnO4溶液VmL,消耗MnO4﹣的物质的量为:n(MnO4﹣)=cmol/L×L=mol, 根据化合价升降相等可得反应关系式:5Fe2+~MnO4﹣, 则n(Fe2+)=5n(MnO4﹣)=5×mol,m(Fe2+)=56g/mol×5×mol, 所以铁的质量分数=×100%=×100%或×100%(或%), 故答案为:×100%或×100%(或%)。 【点评】本题考查探究物质组成、测量物质含量,题目难度较大,明确实验原理、实验目的为解答关键,注意掌握常见元素及其化合物性质,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及综合应用能力。 [化学一选修3:物质结构与性质](15分) 11.(15分)硫及其化合物有许多用途。相关物质的物理常数如表所示: H2S S8 FeS2 SO2 SO3 H2SO4 熔点/℃ ﹣85.5 115.2 >600(分解) ﹣75.5 16.8 10.3 沸点/℃ ﹣60.3 444.6 ﹣10.0 45.0 337.0 回答下列问题: (1)基态Fe原子价层电子的电子排布图(轨道表达式)为 ,基态S原子电子占据最高能级的电子云轮廓图为 哑铃 形。 (2)根据价层电子对互斥理论,H2S,SO2,SO3的气态分子中,中心原子价层电子对数不同于其他分子的是 H2S 。 (3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为 S8与SO2都是分子晶体,S8相对分子质量比SO2大,S8的分子间作用力大于SO2,所以熔沸点S8>SO2 。 (4)气态三氧化硫以单分子形式存在,其分子的立体构型为 平面三角 形,其中共价键的类型有 2 种;固体三氧化硫中存在如图(b)所示的三氯分子。该分子中S原子的杂化轨道类型为 sp3 。 (5)FeS2晶体的晶胞如图(c)所示,晶胞边长为anm,FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为 g•cm﹣3;晶胞中Fe2+位于S22﹣所形成的八面体的体心,该正八面体的边长为 a nm。 【分析】(1)基态Fe原子价层电子为其3d、4s能级上电子; 基态S原子电子占据的能级有1s、2s、2p、3s、3p,最高能级为3p,其电子云轮廓图为哑铃形; (2)H2S中S原子价层电子对个数=2+=4、SO2中S原子价层电子对个数=2+=3、SO3中S原子价层电子对个数=3+=3; (3)S8、SO2都分子晶体,分子晶体熔沸点与其分子间作用力成正比,分子间作用力与其相对分子质量成正比; (4)SO3中S原子价层电子对个数=3+=3,且不含孤电子对,根据价层电子对互斥理论判断其空间构型;该分子中S﹣O原子之间存在共价键;该分子中每个S原子价层电子对个数都是4,根据价层电子对互斥理论判断S原子杂化类型; (5)晶胞边长为anm=a×10﹣7cm,晶胞体积=(a×10﹣7cm)3,该晶胞中Fe2+个数=1+12×=4,S22﹣个数=8×+6×=4,其晶体密度=;晶胞中Fe2+ 位于S22﹣所形成的八面体的体心,该正八面体的边长为每个面对角线长度的一半。 【解答】解:(1)基态Fe原子的核外价电子排布式为[Ar]3d64S2,基态Fe原子价层电子为其3d、4s能级上电子,则基态Fe原子的核外价电子排布图为; 基态S原子电子占据的能级有1s、2s、2p、3s、3p,最高能级为3p,其电子云轮廓图为哑铃形, 故答案为:;哑铃; (2)H2S中S原子价层电子对个数=2+=4、SO2中S原子价层电子对个数=2+=3、SO3中S原子价层电子对个数=3+=3,中心原子价层电子对数不同于其他分子的是H2S, 故答案为:H2S; (3)S8、SO2都分子晶体,分子晶体熔沸点与其分子间作用力成正比,分子间作用力与其相对分子质量成正比,S8相对分子质量大于SO2,所以分子间作用力S8大于SO2,导致熔沸点S8大于SO2, 故答案为:S8与SO2都是分子晶体,S8相对分子质量比SO2大,S8的分子间作用力大于SO2,所以熔沸点S8>SO2; (4)SO3中S原子价层电子对个数=3+=3,且不含孤电子对,根据价层电子对互斥理论判断其空间构型为平面正三角形;该分子中S﹣O原子之间存在σ和离域大π键,所以共价键类型2种;该分子中每个S原子价层电子对个数都是4,根据价层电子对互斥理论判断S原子杂化类型为sp3, 故答案为:平面正三角;2;sp3; (5)晶胞边长为anm=a×10﹣7cm,晶胞体积=(a×10﹣7cm)3,该晶胞中Fe2+个数=1+12×=4,S22﹣个数=8×+6×=4,其晶体密度==g/cm3;晶胞中Fe2+位于S22﹣ 所形成的八面体的体心,该正八面体的边长为每个面对角线长度的一半=×anm=anm, 故答案为:;a。 【点评】本题考查物质结构和性质,涉及晶胞计算、微粒空间构型判断、原子核外电子排布等知识点,侧重考查学生分析判断、公式的正确运用及空间想像能力,难点是晶胞计算,注意均摊分在晶胞中的灵活运用及nm与cn之间的换算。 [化学一选修5:有机化学基础](15分) 12.以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物。由葡萄糖为原料合成E的路线如下: 回答下列问题: (1)葡萄糖的分子式为 C6H12O6 。 (2)A中含有的官能团的名称为 羟基 。 (3)由B到C的反应类型为 酯化反应或取代反应 。 (4)C的结构简式为 。 (5)由D到E的反应方程式为 。 (6)F是B的同分异构体,7.30g的F与足量饱和碳酸氢钠反应可释放出2.24L二氧化碳(标准状况),F的可能结构共有 9 种(不考虑立体异构);其中核磁共振氢谱为三组峰,峰面积比为3:1:1的结构简式为 。 【分析】葡萄糖和氢气发生加成反应生成A为HOCH2(CHOH)4CH2OH,A发生消去反应生成B,B和乙酸反应生成C,根据C分子式知,B中一个羟基发生酯化反应,C结构简式为,根据D分子式知,生成D的反应为取代反应,D发生水解反应生成E,根据E结构简式知,D为 ,结合题目分析解答。 【解答】解:葡萄糖和氢气发生加成反应生成A为HOCH2(CHOH)4CH2OH,A发生消去反应生成B,B和乙酸反应生成C,根据C分子式知,B中一个羟基发生酯化反应,C结构简式为,根据D分子式知,生成D的反应为取代反应,D发生水解反应生成E,根据E结构简式知,D为, (1)葡萄糖的分子式为C6H12O6, 故答案为:C6H12O6; (2)A为A为HOCH2(CHOH)4CH2OH,A中含有的官能团的名称为羟基, 故答案为:羟基; (3)由B到C的反应类型为取代反应或酯化反应, 故答案为:取代反应或酯化反应; (4)C的结构简式为, 故答案为:; (5)D为,D发生水解反应生成E,由D到E的反应方程式为, 故答案为:; (6)F是B的同分异构体,B的相对分子质量为146,7.30g的F物质的量==0.05mol,生成n(CO2)==0.1mol,说明该分子中含有2个﹣COOH,B的分子式为C6H10O4,B的不饱和度==2,2个﹣COOH的不饱和度是2,说明F中不含碳碳不饱和键和环, 如果剩余碳链结构为C﹣C﹣C﹣C,羧基排放方式有6种; 如果剩余碳链结构为,羧基排放方式有3种, 所以符合条件的同分异构体有9种; 其中核磁共振氢谱为三组峰,峰面积比为3:1:1的结构简式为, 故答案为:9;。 【点评】本题考查有机物推断,侧重考查学生分析、推断能力,涉及物质推断、官能团判断、反应类型判断、同分异构体种类判断等知识点,明确有机物官能团及其性质关系是解本题关键,难点是同分异构体种类判断。 查看更多