- 2021-04-14 发布 |
- 37.5 KB |
- 40页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020年高考化学一轮复习课件:模块3 第七单元 第4节 金属材料与金属矿物利用
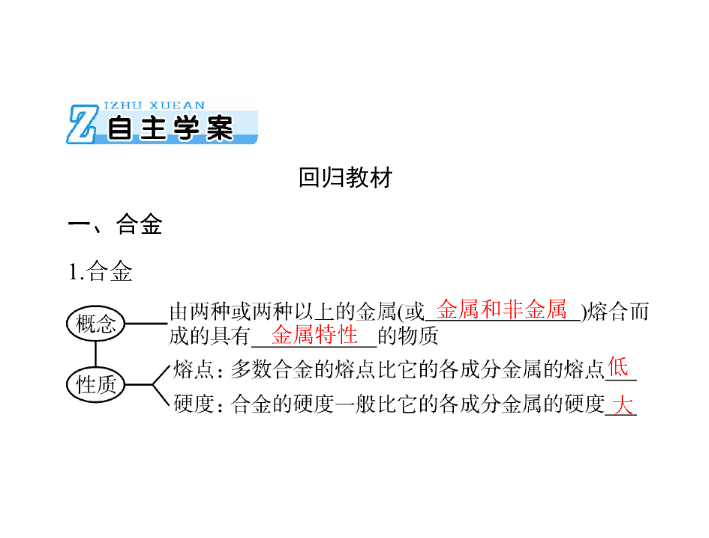
第 4 节 金属材料与金属矿物利用 考纲点击: 1. 了解常见金属的活动顺序。 2. 了解合金的概念 及其重要应用。 回归教材 一、合金 1. 合金 金属和非金属 金属特性 低 大 铁、锰、铬 2. 常见金属材料 (1) 钢铁 正 二、金属矿物的开发和利用 1. 金属在自然界中的存在 2. 金属冶炼的一般步骤 3. 金属冶炼方法 ( 用化学方程式表示 ) 实验 装置 实验 现象 ① 镁带剧烈燃烧,放出大量的热,并发出耀眼的白光,氧化 铁和铝粉在较高温度下发生剧烈的反应; ②纸漏斗的下部被烧穿,有熔融物落入沙中 实验 结论 高温下,铝与氧化铁发生反应,放出大量的热,反应的化学 方程式为 2Al + Fe 2 O 3 Al 2 O 3 + 2Fe 原理 应用 ① 制取熔点较高、活泼性弱于 Al 的金属铬、锰、钨等; ②金属 焊接,如野外焊接钢轨等 4. 铝热反应 [ 特别提醒 ] (1) 铝热反应是在高温干态下进行的置换反应, 铝只能与排在金属活动性顺序中铝后的金属的氧化物反应。 (2) 铝热反应是放热反应,反应引发后不需要持续加热。 (3) 铝热剂是铝粉和金属氧化物的混合物。 (4) 利用铝热反应可以冶炼高熔点金属,例如钨的冶炼。 基础测评 1. 判断正误,正确 的打 “ √ ” ,错误的打 “ × ” 。 (1) 合金的成分都是金属,属于混合物 ( (2) 任何不同的金属都可熔合为合金 ( ) 。 ) 。 (3) 钢和生铁的熔点都比纯铁低 ( ) 。 (4) 常见的铜合金有青铜、黄铜和白铜 ( ) 。 (5) 合金的化学性质一般与其各成分金属的化学性质不同 ( ) 。 答案: (1)× (2)× (3)√ (4)√ (5)× 2.2015 年 6 月 24 日中国载人潜水器“蛟龙”号在西太平洋 的马里亚纳海沟试验海域成功创造了载人深潜的新纪录,首次 突破 7000 米,最深达到 7020 米海底。“蛟龙”号载人潜水器 的外壳是耐超高压的钛合金,下列有关合金的说法中正确的是 ( ) 。 A. 钛合金 是一种新型的金属单质 B. 钛合金的熔点比成分金属的低,硬 度小 C. 钛合金的化学性质与钛单质相同 D. 青铜、碳素钢、合金钢和硬铝均是合 金 答案: D 解析: Al 的活动性比 H 2 强,不能用 H 2 还原法进行冶炼, 而应用电解法进行冶炼。 答案: B 4.(2018 年重庆模拟 ) 下列制备物质的工业生产流程 合理的 是 ( ) 。 解析: A 项,铝土矿的主要成分虽然是氧化铝,但含有很 多的杂质,不能直接电解,错误; B 项,硫酸的制取过程是燃 烧硫铁矿获得 SO 2 后,用氧气在催化剂存在条件下将 SO 2 氧化 为 SO 3 ,再用 98.3% 的浓硫酸吸收 SO 3 ,用水吸收 SO 2 后氧化亚 硫酸的工艺相对困难,不合理; C 项,可以用石灰乳吸收氯碱 工业产生的氯气获得漂白粉,正确; D 项,工业上用氮气、氢 气合成氨气,加热铵盐和碱的混合物的方法适合实验室制取少 量氨气,工业上不可行, 错误。 答案: C 5. 用铝热反应还原下列物质,制得金属各 1 mol 时,消耗铝 ) 。 最少的是 ( A.MnO 2 C.V 2 O 5 B.Cr 2 O 3 D.Fe 3 O 4 解析: 制得 1 mol 金属转移电子最少的则消耗铝最少。 A ~ D 项制得 1 mol 金属转移电子的物质的量依次为 4 mol 、 3 mol 、 5 mol 、 8 3 mol 。 答案: D 关键材料。下列有关高温合金的说法错误的是 ( 考点一 考向 1 合金和常见的金属材料及其防护 合金和常见的金属材料 [ 典例 1 ] 高温合金是一种能够在 600 ℃ 以上及一定应力条 件下长期工作 的金属材料,是涡轮发动机热端部件不可替代的 ) 。 A. 高温合金可能由多种金属 ( 或金属与非金属 ) 组成 B. 高温合金耐腐蚀、耐高温,具有金 属特性 C. 高温合金的熔点比其成分金属熔点更高 D. 高温合金硬度大、密度小,适合制造发动机 答案: C . . [ 方法技巧 ] (1) 构成合金的 成分不一定是两种或两种以上的 金属,也可以是金属与非金属。合金中一定含金属元素。合金 一定是混合物。 (2) 常温下,多数合金是固态,但钾钠合金呈液态。 (3) 合金的性质不是各成分金属的性质之和。合金具有许多 良好的物理、化学和机械性能,在许多方面不同于各成分金属, 不是简单加和;但在化学性质上,一般认为合金体现的是各成 分金属的化学性质。 考向 2 金属材料的防护 的是 ( ) 。 A. 在如图所示环境中,铁被腐蚀速率: Ⅰ > Ⅲ > Ⅱ B. 军事演习期间给坦克的履带上刷上油漆以防止生锈 C. 在海轮的外壳上常焊有锌块,且定期更新 D. 将不锈钢制成刀具和餐具,有的刀具还进行烤 蓝处理 解析: A 项 Ⅰ 中铁做原电池负极腐蚀速率加快, Ⅱ 中铁做 原电池正极被保护,腐蚀速率减慢,所以铁被腐蚀速率: Ⅰ>Ⅲ>Ⅱ ; B 项军事演习期间给坦克的履带上刷上油漆,油漆 会很快脱落起不到保护作用,错误; C 项锌做负极保护海轮, 正确; D 项保护措施正确。 答案: B 金材料。下列关于铝锂合金的认识不正确的是 ( ) 。 【 拓展演练 】 1.2018 年 12 月 28 日,第三架国产大型客机 C919 在上海 浦东国际机场实现首飞。 C919 机身部分采用第三代新型铝锂合 A. 铝锂合金密度较小,强度较大,硬度大于纯铝,熔点低 于锂单质 B. 改变原料的配比,可以制得性能不同的铝锂合金 C. 铝锂合金具有金属光泽,可导电导热 D. 铝锂合金的性质与各成分金属的性质完全相同 答案: D . . . 2. 为防止碳素钢菜刀生锈,在使用后特别是切过咸菜后, 应将其 ( ) 。 A. 洗净、擦干 B. 浸泡在水中 C. 浸泡在食醋中 D. 直接置于空气中 解析: 切过咸菜的菜刀含有电解质,如果不洗干净擦干很 容易形成原电池,原电池会加快菜刀的腐蚀。 答案: A 考点二 考向 1 金属矿物的开发和利用 金属冶炼方法的选择 [ 典例 3 ](2018 年安徽芜湖质检 ) 下列说法正确的是 ( ) 。 A. 工业上通过电解氯化钠溶液制备金属钠和氯气 B. 钢铁厂用热还原法冶炼铁 C. 工业上电解熔融状态的 Al 2 O 3 制备 Al 不涉及氧化还原反 应 解析: 电解 NaCl 溶液生成 NaOH 、 H 2 和 Cl 2 ,得不到单质 钠, A 错误;电解熔融 Al 2 O 3 发生的是氧化还原反应, C 错误; 工业上冶炼镁是电解熔融 MgCl 2 而不是 MgO , D 错误。 答案: B [ 方法技巧 ] 根据金属活 动性判断金属冶炼方法 考向 2 铝热反应 [ 典例 4 ](2018 年山东滨州检测 ) 利用下图做铝热反应实验, 2Fe + Al 2 O 3 A. 该反应的化学方程式是 2Al + Fe 2 O 3 B. 该反应会产生高温,发出强光 C. 根据铝热反应的原理,可以冶炼某些金属 D. 若反应中转移 3 mol 电子,消耗氧化剂的物质的量是 1 mol 解析: D 项,铁元素的化合价从+ 3 价降低到 0 价,因此 1 mol Fe 2 O 3 在反应中得到 6 mol 电子,若反应中转移 3 mol 电子, 则消耗氧化剂的物质的量是 0.5 mol , D 错误。 答案: D 产部分材料的流程示意图如下。下列说法不正确的是 ( 【 拓展演练 】 3.(2018 届甘肃兰州一中三模 ) 工业上利用无机矿物资源生 ) 。 . . . A. 在铝土矿制备较高纯度 Al 的过程中常用到 NaOH 溶液、 CO 2 气体 、冰晶石 B. 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应 C. 在制粗硅时,被氧化的物质与被还原的物质的物质的量 之比为 2∶1 D. 黄铜矿 (CuFeS 2 ) 与 O 2 反应产生的 Cu 2 S 、 FeO 均是还原产 物 解析: A 项,用铝土矿制备较高纯度 Al ,首先用 NaOH 溶 液将铝土矿中的氧化铝溶解转化为偏铝酸钠溶液,然后过滤、向 滤液中通入 CO 2 气体把偏铝酸钠转化为氢氧化铝沉淀,再过滤得 氢氧化铝,接着加热氢氧化铝让其分解 为氧化铝,最后用冰晶石 作助熔剂,电解熔融的氧化铝得到铝, A 正确; B 项,石英的主 要成分是二氧化硅,它属于酸性氧化物,不与盐酸反应,玻璃的 主要成分有二氧化硅、硅酸钠、硅酸钙,组成中有盐,故被称为 硅酸盐产品,它也 不能与盐酸反应,实验室经常用玻璃瓶盛放盐 酸, B 不正确; C 项,在制粗硅时,发生反应 SiO 2 + 2C Si + 2CO ,被氧化的物质 C 与被还原的物质 SiO 2 的物质的量之比 为 2∶1 , C 正确; D 项,黄铜矿 (CuFeS 2 ) 与 O 2 反应,铜由+ 2 价 降为+ 1 价被还原得到 Cu 2 S 、氧由 0 价降至- 2 价得到 FeO ,所 以 Cu 2 S 、 FeO 均是还原产物, D 正确。 答案: B 4.(2018 年山东北镇中学一模 ) 为了确定一批合金废料的成 分并加以回收利用,某同学拟定了以下实验方案: ( 已知 Si + 2NaOH + H 2 O===Na 2 SiO 3 + 2H 2 ↑) 请回答下列问题: (1) 从上述信息可确定该合金中一定含有 Fe 和 _________ ( 填化学式 ) 。 (2)“ 试剂 a” 是一种不引入 杂质的绿色氧化剂,该氧化剂 的化学式为 ________ ;滤渣 D 与稀硫酸和试剂 a 总反应的化学 方程式为 ____________________________________ 。 (3) 若反应①产生的气体是 H 2 ,则验证滤液 A 只含 NaAlO 2 不含 Na 2 SiO 3 的方法是取少量滤液 A 于试管中, ____________ ____________________________________________________ ; 如果滤液 A 只含 NaAlO 2 而不含 Na 2 SiO 3 ,则反应①的离子 方程式为 _______________________________________ 。 解析: (3) 如果含有 Na 2 SiO 3 ,则 Na 2 SiO 3 与酸反应生成 H 2 SiO 3 沉淀,此沉淀不与过量的酸反应,所以最终白色沉淀不 消失。 答案: (1)Cu (2)H 2 O 2 Cu + H 2 O 2 + H 2 SO 4 ===CuSO 4 + 2H 2 O (3) 逐滴滴加稀盐酸 ( 或稀硫酸 ) 至过量,先产生白色沉淀, 然后沉淀完全溶解 定量测定合金组成的两种方法 1. 定量集气法 定量集气法是指收集合金中某种物质溶于酸或碱溶液时所 产生的气体的量,应用化学方程式或关系式来判断合金的组成。 其原理的关键点是某组分具有特殊性质 ( 特别是与酸或碱反应 能产生气体 ) 。其操作要点和注意事项有保证装置的气密性良 好,注意收集气体的读数方法。 2. 沉淀法 沉淀法测定物质含量是常用的一种方法,采用沉淀法时涉 及的基本实验操作和主要问题有称量、溶解 ( 溶解试剂 ) 、沉淀 ( 重 点是沉淀试剂的选择 ) 、过滤、沉淀洗涤、沉淀的干燥、称量及 数据的处理 ( 包括测定结果的误差分析 ) 。 [ 典例 ] (2018 年山东济南一模 ) 有三种镁铝合金样品 A 、 B 、 C( 组分比例不一定相同 ) 。三位同学各取一种样品,对合金 中镁 的质量分数进行下列实验探究: (1) 第一位同学取样品 A m 1 g 和过量的氢氧化钠溶液反应, 然后过滤;再往滤液中通入过量的二氧化碳气体,将所得沉淀 过滤、洗涤、烘干、灼烧,得到固体质量仍为 m 1 g 。则合金中 镁的质量分数为 __________( 小数点后保留 2 位 ) 。 (2) 第二位同学取样品 B m 2 g 和足量的稀硫酸反应,发现固 体完全溶解,标准状况下得到气体的体积为 V L ,则 m 2 的取值 范围是 __________( 结果化为最简分数 ) 。 实验序号 a b c 合金质量 /g 0.51 0.765 0.918 气体体积 /mL 560 672 672 (3) 第三位同学取不同质量的样品 C 分别和 30 mL 同浓度的 盐酸反应,所取合金质量与产生气体 的体积 ( 标准状况下测定 ) 如表所示: Ⅰ. 盐酸的物质的量浓度为 __________ 。 Ⅱ. 合金中镁的质量分数为 __________ 。 Ⅲ. 要使 c 组实验后剩 余合金中的铝恰好完全溶解,还需向 容器中加入 1.0 mol·L - 1 的氢氧化钠溶液 ______ mL 。 (3)Ⅰ.2.0 mol·L 答案: (1)47.06% 45 V (2) < m 2 < 56 15 V 14 - 1 Ⅱ.47.06% Ⅲ.78 [ 演练 ] (2018 年山东潍坊 ) 某同学设计了如下实验测量 m g 铜银合金样品中铜的质量分数: A. 合金的熔点比其成分金属低,通常比成分金属具有更优 良的金属特性 B. 铜银都能与稀硝酸反应,收集到的 V L 气体一定全为 NO C. 操作 Ⅰ 是过滤,操作 Ⅱ 是洗涤,操作 Ⅲ 是烘干 D. 根据反应收集到的气体体积可以计算铜和银的质量分数 解析: 合金的硬度大,熔点低, A 正确;由流程图可知, 气体用排水法 收集,二氧化氮能与水反应生成 NO ,无论金属 与硝酸反应生成的是 NO 或 NO 2 或 NO 、 NO 2 ,最后收集的气体 都为 NO , B 正确;反应生成氯化银沉淀,过滤、洗涤、干燥, 最后得到干燥的 AgCl 固体, C 正确;硝酸的浓度未知,无法计 算铜和银的质量分数, D 错误。 答案: D查看更多