- 2021-04-14 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
济宁中考化学试卷
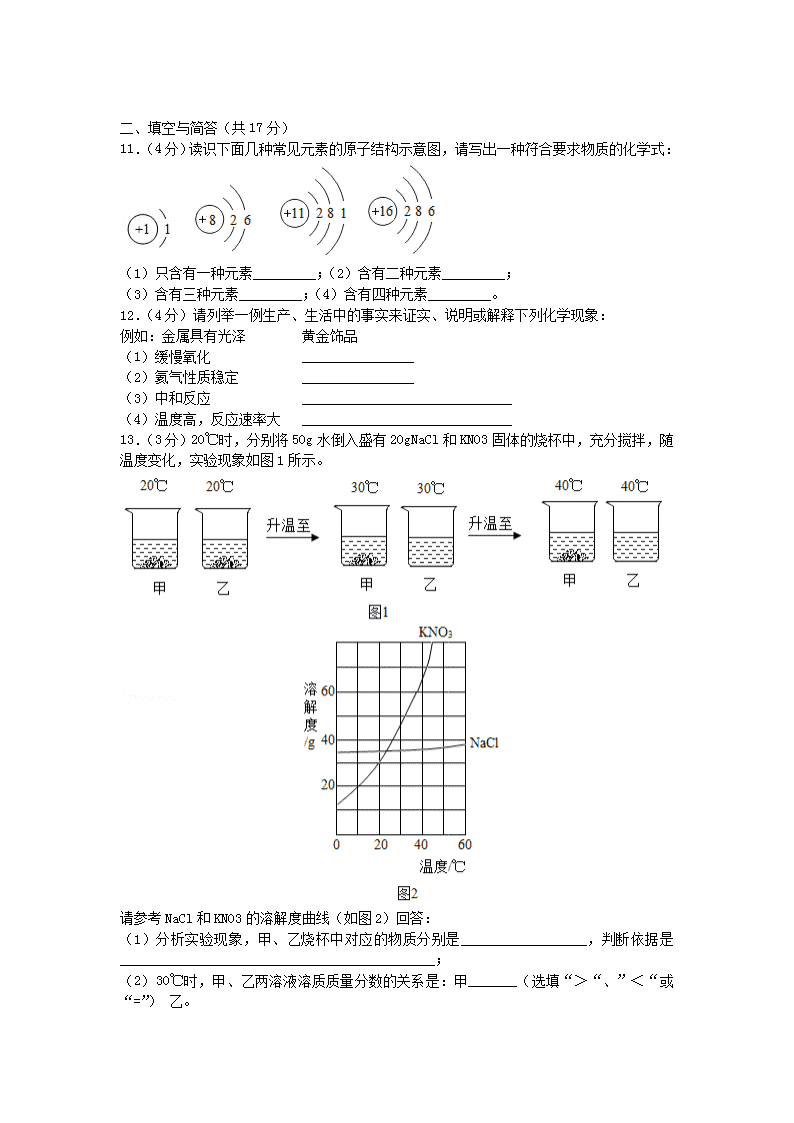
济宁市二〇一七年高中段学校招生考试 第Ⅰ卷(选择题 共16分) 可能用到的相对原子质量:H—1 C—12 O—16 Mg—24 S—32 Cl—35.5 Fe—56 Cu—64 Zn—65 一、选择题(下列各题只有一个正确选项。其中,1~4小题各1分,5~10小题各2分, 共16分) 1.化学与人类生产、生活密切相关,下列应用不涉及化学变化的是( ) A.小苏打用作糕点膨松剂 B.生石灰用作袋装食品干燥剂 C.肥皂水用来区别硬水、软水 D.活性炭用来去除冰箱内异味 2.对下面几种物质的分类,正确的是( ) ①CH4②P2O5③MgO ④BaCl2⑤HNO3⑥NH4HCO3 A.②③⑤属于氧化物 B.⑤⑥属于酸 C.④⑥属于盐 D.①⑥属于有机物 3.某同学为验证“分子是运动的”,设计了甲、乙、丙、丁四个实验,其中,能达到目的是( ) A.甲、乙、丙 B.甲、乙、丁 C.甲、丙、丁 D.乙、丙、丁 4.分析下列反应所得结论中,正确的是( ) ①CO+CuOCu+CO2 ②2Al+Fe2O3Al2O3+2Fe ③2Na2O2+2CO2═2Na2CO3+O2 ④2H2S+SO2═2H2O+3S A.①②属于置换反应 B.③④属于复分解反应 C.③中氧元素化合价不变 D.都有单质生成 5.酸、碱、盐溶解性表为我们确定常见物质的溶解性提供了方便,下表是溶解性表的一部分,结合表格和溶解度知识判断,下列说法不正确的是( ) 常见酸、碱、盐的溶解性表(20℃) OH﹣ NO3﹣ Cl﹣ SO42﹣ CO32﹣ Ca2+ 微 溶 溶 微 不 A.绘制表格的依据是物质的溶解度 B.常见物质一般可分为:溶、微溶和不溶 C.Ca(OH)2、CaSO4和CaCO3的溶解度都大于1g D.Ca2+、NO3﹣、Cl﹣三种离子在溶液中能大量共存 6.下面对有关实验的设计与解释,不合理的是( ) 实验内容 试剂与方法 结论与解释 A 分离CaCO3和CaO 加水溶解、过滤 CaO溶于水 B 除去BaSO4中的BaCO3 加稀盐酸、过滤 BaCO3溶于稀盐酸 C 鉴别NaOH、Na2SO4 滴加酚酞试液 NaOH溶液显碱性 D 检验溶液中的Mg2+ 滴加NaOH溶液 Mg(OH)2不溶于水 7.一同学设计了两种由CuO→Cu的实验方案: 方案一:ZnH2Cu 方案二:CuOCuSO4Cu 大家认为方案二优于方案一,理由是: ①节约能源 ②Cu产率高 ③产品纯净 ④操作安全 其中,评价正确的是( ) A.①②③ B.①②④ C.①③④ D.②③④ 8.在相同质量、相同质量分数的稀硫酸中,分别加入足量的Mg、Fe、Zn三种金属,其发生反应的质量关系如图所示。读识如图并判断,下面推理合理的是( ) ①反应速率:Mg>Fe>Zn ②反应生成氢气质量:Mg=Fe=Zn ③反应后溶液质量:Mg=Fe=Zn ④反应后溶液溶质质量分数:Mg<Fe<Zn. A.①② B.③④ C.①③ D.②④ 9.有四瓶无色溶液,他们分别是AgNO3、BaCl2、K2CO3和Mg(NO3)2溶液,仅利用下面试剂就能将他们区别开的是( ) A.HCl、Na2SO4 B.NaCl、HNO3 C.HNO3、Ba(NO3)2 D.NaCl、NaOH 10.一澄清透明溶液,可能含有H+、Na+、Ba2+、Fe3+、Cl﹣、OH﹣和SO42-离子的一种或几种。为确定溶液中可能存在的离子,进行下面实验: ①经测定,溶液的pH=1; ②取部分样品溶液滴加NaOH溶液,有沉淀生成.继续滴加NaOH溶液至不再产生沉淀为止,过滤; ③向实验②得到的滤液中滴加Na2CO3溶液,又观察到沉淀生成。 分析实验得出的以下结论中,正确的是( ) A.溶液中一定含有H+、Ba2+、Cl﹣,一定不含有Na+、Fe3+、OH﹣、SO B.溶液中一定含有H+、Ba2+、Fe3+、Cl﹣,一定不含有Na+、OH﹣和SO C.溶液中一定含有H+、Ba2+、Fe3+、Cl﹣,一定不含有OH﹣、SO,可能含有Na+ D.溶液中一定含有H+、Ba2+、Na+、Fe3+,一定不含有OH﹣、SO,可能含有Cl﹣ 第Ⅱ卷(非选择题 共34分) 二、填空与简答(共17分) 11.(4分)读识下面几种常见元素的原子结构示意图,请写出一种符合要求物质的化学式: (1)只含有一种元素_________;(2)含有二种元素_________; (3)含有三种元素_________;(4)含有四种元素_________。 12.(4分)请列举一例生产、生活中的事实来证实、说明或解释下列化学现象: 例如:金属具有光泽 黄金饰品 (1)缓慢氧化 ________________ (2)氦气性质稳定 ________________ (3)中和反应 ______________________________ (4)温度高,反应速率大 ______________________________ 13.(3分)20℃时,分别将50g水倒入盛有20gNaCl和KNO3固体的烧杯中,充分搅拌,随温度变化,实验现象如图1所示。 请参考NaCl和KNO3的溶解度曲线(如图2)回答: (1)分析实验现象,甲、乙烧杯中对应的物质分别是__________________,判断依据是_____________________________________________; (2)30℃时,甲、乙两溶液溶质质量分数的关系是:甲_______(选填“>“、”<“或“=”) 乙。 14.(4分)氧化锌广泛用于皮肤病的治疗,工业氧化锌常含有少量杂质(CuO、FeO、SiO2等)不能直接使用。提纯、净化氧化锌的简易流程如图所示: 参考资料:SiO2既不溶于水也不与酸反应 (1) 反应器Ⅰ中加入足量稀硫酸,充分反应后,生成硫酸盐的化学式__________________ ___________; (2)残渣中除金属锌外,还有______________________; (3)操作一、操作二和操作三采用的分离方法是___________; (4)操作四发生反应的化学方程式为_____________________________________。 15.(2分)蛋白粉是由大豆蛋白、酪蛋白、乳清蛋白或上述几种蛋白混合制成的粉剂,其用途是为营养不良或疾病导致蛋白质缺乏的人群补充营养。请回答: (1)蛋白粉补充的营养成分是___________; (2)市售劣质蛋白粉往往添加食用香精、淀粉,从颜色和味道都难以分辨。用少量样品验证这种蛋白粉中含有淀粉的方法是_________________________________________________ __________。 三、实验与探究(共11分) 16.(11分)(1)某实验小组利用如图实验装置探究二氧化碳的化学性质: 请根据实验装置和实验内容,回答下面问题: ①探究二氧化碳与碱反应时,将装置A生成的二氧化碳气体通入装置D未出现浑浊,原因是______________________________;可将二氧化碳先通过装置__________,再通入装置D,理由是_____________________________(用化学方程式表示); ②探究二氧化碳与水反应时,实验分两步进行:首先将二氧化碳通过石蕊溶液浸泡的干燥纸花,再将二氧化碳通过石蕊溶液浸泡的湿润纸花,这样做的目的是______________________ ____________________;结合上面实验,装置正确的连接顺序是__________(填序号)。 (2)家庭生活中食品制作(如面条、馒头等 )经常用到食用碱,食用碱的主要成分是碳酸钠,可能含有少量氯化钠。小莉将家中食用碱带到实验室进行探究,请设计实验验证小莉提供的食用碱样品是否含有氯化钠。 实验步骤 实验现象 结论与解释 1.取一定量的食用碱样品放入试管,加入蒸馏水、振荡 样品溶解 食用碱溶于水 _____________________________ _____________________________ ___________________ ____________________ ____________________ _____________________________ _____________________________ ___________________ _____________________ _____________________ 四、分析与计算(共6分) 17.(2分)观看足球比赛时,经常会看到绿茵场上运动员因拼抢摔倒受伤,医生向受伤部位喷射氯乙烷(CH3CH2Cl),并用药棉不断揉搓,运动员疼痛很快消除,重新投入比赛。 请阅读信息后,回答: (1)氯乙烷中C、H、Cl三种元素的原子个数比为___________; (2)氯乙烷中C、H、Cl三种元素的质量比为_______________。 18.(4分)(1)探究小组欲从含有FeCl3、CuCl2的废液中回收金属铜,取一定量的废液样品加入少量铁粉,一段时间后铁粉完全溶解,但未发现红色固体沉积。 出现这种现象的可能原因是_____________________________________________; 经查阅资料,铁粉在废液中发生两个化学反应: ①2FeCl3+Fe═3FeCl2 ②CuCl2+Fe═FeCl2+Cu (2)探究小组另取废液,向废液中加入一定且足量的铁粉至充分反应,溶液变为浅绿色,过滤、干燥,称得固体沉积物质量与加入铁粉质量相等。 ①固体沉积物质量与加入铁粉质量相等的原因是___________________________________ ____________________________; ②经测定,反应后得到铜的质量为1.6g,其中,反应①消耗铁粉的质量是_______________,反应②消耗铁粉的质量是_______________。(计算结果精确到0.1) 查看更多