2013高考化学总复习氧化还原反应专题答案及解析
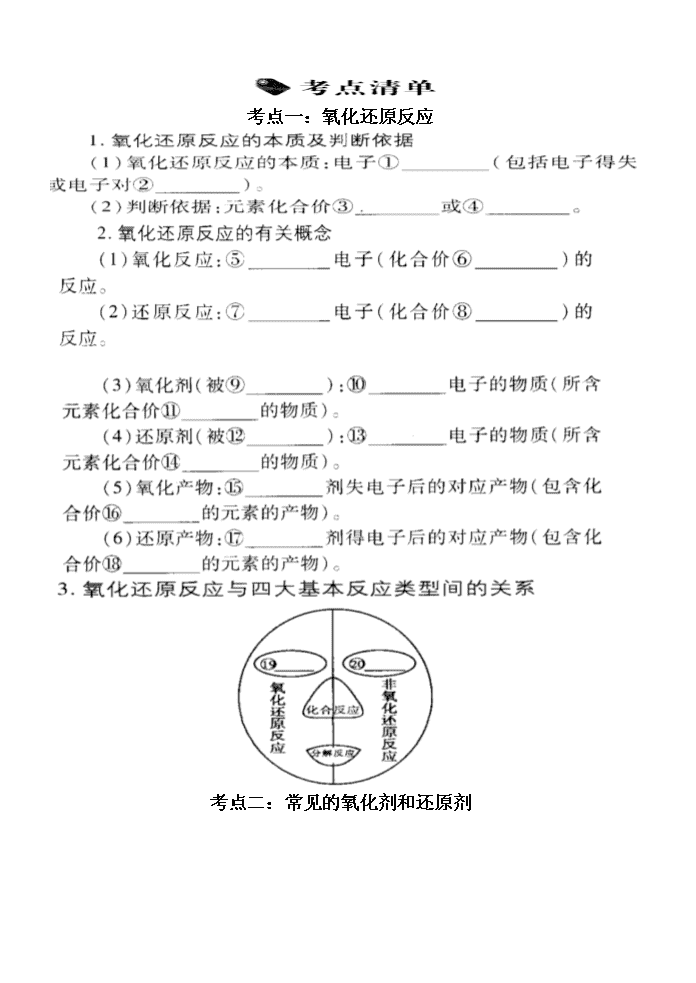
考点一:氧化还原反应
考点二:常见的氧化剂和还原剂
考点三:氧化还原反应中电子转移的表示方法
专题 氧化还原反应
题型一:基本概念的考查
【例1】下列化工生产过程所发生的反应不属于氧化还原反应的是( )
A.用油脂制肥皂 B.用铝土矿制金属铝
C.用氯气和消石灰制漂白粉 D.用氢气和氮气合成氨
【点拨】判断氧化还原反应的最基本的方法是看反应前后有无化合价的变化。
题型二:氧化性、还原性强弱的判断
【例2】氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素
[如:(SCN)2+H2O HSCN+HSCNO]。它们阴离子所谓还原性强弱为:Cl-
(CN)2>(SCN)2。
【规律总结】氧化还原反应的方向:由强到弱
强氧化剂+强还原剂——→氧化产物(弱氧化性)+还原产物(弱还原性)
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
由此可判断反应能否进行;比较氧化性或还原性的强弱
【强调1】已知反应:①Cl2+2KBr=2KCl+Br2, ②KClO3 +6HCl=3Cl2+KCl +3H2O,③2KBrO3 +Cl2=Br2 + 2KClO3,下列说法正确的是( )
A.上述三个反应都有单质生成,所以都是置换反应
B.氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2
C.反应②中还原剂与氧化剂的物质的量之比为6:1
D.③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol
【点拨】该题主要考查氧化还原反应的规律、氧化剂和还原剂的判断、对化学计量数的理解以及得失电子守恒的简单应用)
题型三:氧化还原反应方程式配平的常见题型
【例3】配平以下氧化还原反应方程式:
KMnO4+ H2C2O4+ H2SO4—— CO2+ K2SO4+ MnSO4+ H2O
当KMnO4消耗0.05mol时,产生的CO2的体积为________L(标准状况)。
【点拨】这是一题有机氧化还原反应方程式的配平,有机氧化还原反应方程式的配平与无机氧化还原反应方程式相似,关键是正确标定有机物中碳的化合价。为了方便地标出碳的化合价,在遇到有机物用结构简式表示时,一定要把它写成分子式。
+7 +3 +4 +2
KMnO4 + H2C2O4� + H2SO4 —— CO2 + K2SO4 + MnSO4 + H2O
↓ ↑
5×2 2×5
【规律总结】配平氧化还原反应方程式,判断氧化还原反应电子转移的方向和数目。
依据原则:氧化剂化合价降低总数=还原剂化合价升高总数
方法步骤:划好价、列变化、求总数、配系数。
题型四:有关氧化还原反应的计算
【例4】在100mL溴化亚铁溶液中通入2.24L氯气(标况下),则有1/3的溴离子被氧化,求原溴化亚铁溶液的物质的量浓度?
【点拨】本题重点考查氧化还原反应的先后顺序规律及计算
【规律总结】氧化还原反应的典型计算:依据氧化剂得电子总数与还原剂失电子总数相等,列出守恒关系式求解。
题型五:对一类特殊氧化还原反应的考查。变价元素只有一种的
【例5】在一定条件下,NO跟NH3可以发生反应生成N2和H2O。现有NO和NH3的混合物1 mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g。
(1)写出反应的化学方程式并标出电子转移的方向和数目。
(2)若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多少。
【点拨】6molNO还原得到3molN2,4molNH3氧化得到2molN2,两者相差1mol N2,现相差1.4g,
1.4g÷28g/mol=0.05mol,相当于0.3molNO和NH3反应。
【规律总结】变价元素只有一种的氧化还原反应,在教材中和高考试题中经常出现,可分为三种情况:
歧化反应:Cl2+H2O=HCl+HClO 反歧化反应:2H2S+SO2=3S+2H2O
不交叉规律:
H2S+H2SO4(浓)=S+SO2↑+2H2O
题型六:氧化还原反应考查的新动向
【例6】三聚氰酸可用于消除汽车尾气中的氮氧化物(如)。当加热至一定温度时,它发生如下分解: (异氰酸,其结构是H–N=C=O)能和反应生成、和。
(1)写出和反应的化学方程式。分别指明化合物中哪种元素被氧化?哪种元素被还原?标出电子转移的方向和数目?
(2)如按上述反应式进行反应,试计算吸收气体所消耗的三聚氰酸的质量?
【点拨】首先应根据HNCO的结构,判断HNCO中N的化合价。这个问题明确后,其他问题就简单了。
【总结】该题主要考查了物质结构中的化学键理论、化合价的涵义、氧化还原反应难得基本概念、判断氧化还原反应中电子转移的方向和数目、配平反应方程式和化学计算等多个知识点,体现出高考向学科内综合过渡的命题思想。
【巩固2】将agFe、Mg合金溶解在一定量的稀硝酸中,当合金完全溶解后,收集到标准状况下的NO气体bL(设硝酸的还原产物只有NO)再向反应后的溶液中加入足量的NaOH溶液,得到沉淀。试计算该沉淀的质量(以a、b字母表示)
【随堂练习】
一、选择题
1.下列说法正确的是( )
A.阳离子只有氧化性,阴离子只有还原性
B.金属单质在化学反应中只作还原剂,非金属单质只作氧化剂
C.氧化还原反应中肯定有一种元素被氧化,另一种元素被还原
D.有单质参加的反应不一定是氧化还原反应
3.在2HCHO + NaOH(浓)= HCOONa + CH3OH反应中,HCHO ( )
A.仅被氧化了 B.仅被还原了
C.既被氧化,又被还原 D.既未被氧化,又未被还原
3.下列离子中最易给出电子的是( )
A.Cl— B.Cu2+ C.Fe2+ D.F—
4.已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化 Fe3+→Fe2+;MnO4-→Mn2+;
Cl2→2Cl-; HNO3→NO。 如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是 ( )
A.Fe3+ B.MnO4- C.Cl2 D.HNO3
5.将1.92g铜粉与一定量浓硝酸反应,当铜粉完全作用时收集到气体(无N2O4气体)1.12L(标准状况)。则所消耗硝酸的物质的量是 ( )
A.0.12mol B.0.11 mol C.0.09 mol D.0.08 mol
6.氢化钠(NaH)是一种生氢剂,可发生如下反应:NaH + H2O == NaOH + H2↑对这一反应的描述正确的是( )
A.NaH是氧化剂 B. NaH是氧化产物
C.NaOH是还原产物 D.氧化产物与还原产物的质量比是1:1
7.在BrF3+H2O—Br2+HBrO3+O2↑+HF(未配平)化学反应中,若有10.8g水被氧化,则被水还原的BrF3的物质的量是( ):
A、0.4mol B、0.6mol C、0.8mol D、0.9mol
8.由锌、铁、铝、镁四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的氢气在标准状况下为11.2L,则混合物中一定含有的金属是:( )
A.锌 B.铁 C铝 D.镁
9.电视剧《西游记》中仙境美仑美奂。这些神话仙境中所需的烟幕是用NH4NO3和Zn粉按质量比8:6.5混合放于温热的石棉网上,使用时滴水数滴即产生大量的白烟,又知发生反应后有N2和水生成。有关的说法中正确的是 ( )
A.水起着溶解NH4NO3,发生吸热现象以启动反应的作用
B.每还原1molNO3-需氧化1molZn和1molNH4+
C. 成烟物质是两性氧化物小颗粒
D. 成烟物质是小锌粒,它由NH4NO3反应加热而蒸出
10.从含硒(Se)的废料中提取硒的方法之一是:用硫酸和硝酸处理废料,获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸:2HCl+H2SeO4=H2SeO3+Cl2+H2O然后向亚硒酸中通入SO2,生成粗硒。进一步提纯时,可往熔融的粗硒中通入氧气,使生成的氧化硒挥发,再转变成亚硒酸,还原为单质硒。
根据上述信息,回答下列两题:
(1) 对盐酸与硒酸反应的下述判断中,正确的是
A.该反应是强酸制取弱酸的复分解反应 B.硒酸发生氧化反应
C.硒酸有强氧化性 D.盐酸在反应中是氧化剂
(2) 对SeO2和SO2及它们的水溶液,下列叙述不正确的是
A.SeO2和SO2均是酸性氧化物 B.SeO2和SO2均属于分子晶体类型
C.亚硫酸氧化性弱于亚硒酸 D.SO2与亚硒酸反应的物质的量比为1:1
(3)下列叙述正确的是
A.H2SeO3氧化性强于HNO3 B.亚硒酸氧化性强于H2SO3
C.二氧化硒的还原性强于二氧化硫 D.析出1mol硒,需H2SeO3、SO2各1mol
二、填空题
11.一个完整的氧化-还原反应式可以折写成两个“半反应”,一个是氧化反应,另一个是还原反应;如2Fe3++Cu=2Fe2++Cu2+拆写的结果是:氧化反应:Cu-2e=Cu2+;还原反应:Fe3++e=Fe2+,据此,请将反应3NO2+H2O=2H++2NO3-+NO拆写成两个“半反应”式:
12. 有一种稀有气体化合物六铂氟酸氙XePtF6,研究报告指出:“关于XePtF6的电价有Xe2+[PtF6]2-、Xe+[PtF6]-两种可能,巴特列用不可能参加氧化还原反应的五氟化碘作溶剂,将XePtF6溶解,然后在此溶液中加入RbF可得到RbPtF6;加入CsF可得到CsPtF6,这些化合物都不溶于CCl4等非极性溶剂。”试回答:
(1)XePtF6中各元素的化合价分别是 、 、 。
(2)XePtF6是 (离子、共价)化合物。
(3)写出Xe与PtF6反应生成XePtF6的反应式 。而且O2与PtF6可发生类似反应,其反应式是 ,上述两反应属( )
A、均为氧化还原反应 B、均为非氧化还原反应
C、前者是氧化还原反应,后者是非氧化还原反应
13.在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650mg / L。现用氯氧化法处理,发生如下反应(其中N均为-3价):
KCN+2KOH+Cl2 → KOCN+2KCl+H2O
被氧化的元素是 __________ 。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方向和数目:
KOCN+ KOH+ Cl2 → CO2 + N2 + KCl + H2O
(3)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯 g。
14.实验室为监测空气中汞蒸气的含量;往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI+Hg→Cu2HgI4+2Cu
(1)上述反应产物Cu2HgI4中,Cu元素显 价。
(2)以上反应中的氧化剂为 ,当有1molCuI参与反应时,转移电子 mol。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式。
Cu2++ I-→ CuI+ I3-
15.某元素的氧化物很多,其中常见的有A、B两种。
(1)A为黄绿色气体,氧含量为47.44%,可用于漂泊木浆和水处理,A在液态和浓缩的气态时具有爆炸性,该气体为
(2)B为黄棕色气体,氧含量为18.41%,当加热或遇电火花时会发生爆炸,该气体为
(3)你认为这两种气体是否可以在防SARS中作为消毒剂? (A、都可以
B、都不可以 C、只有气体A可以 D、只有气体B可以)
(4)写出气体A与NaOH反应的化学方程式
由于工业上大量使用的A具有爆炸性,A适宜存放在 (填“酸”或“碱”)性溶液中。
(5)用SO2还原X的+5价的盐,可制得A,写出该反应的离子方程式
三、计算题
16.将10g铁粉置于40mL HNO3溶液中,微热,反应过程中随着硝酸浓度的降低,生成气体的颜色由红棕色逐渐变为无色,充分反应后共收集到1.792L标准状况下的混合气体(NO2、NO),溶液里还残留4.4g固体。
(1)求该反应中被还原的硝酸与未被还原的硝酸的质量比。
(2)求理论上原硝酸的物质的量浓度。
(3)求混合气体中NO2、NO的体积比。
(4)写出上述反应的总的化学方程式。
17.Fe、Fe2O3和CuO组成的混合物投入110mL 4mol/L的盐酸中,充分反应后,生成H2896mL(标准状况),溶液中除尚留有1.28g固体外全部是FeCl2,过滤后将滤液稀释至200mL,从中取出50ml,逐滴加入1mol/L的NaOH溶液,当加到20mL时,开始出现沉淀,求混合物中各物质的质量分数?