- 2021-04-14 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学二轮复习非选择必考题标准练7含解析
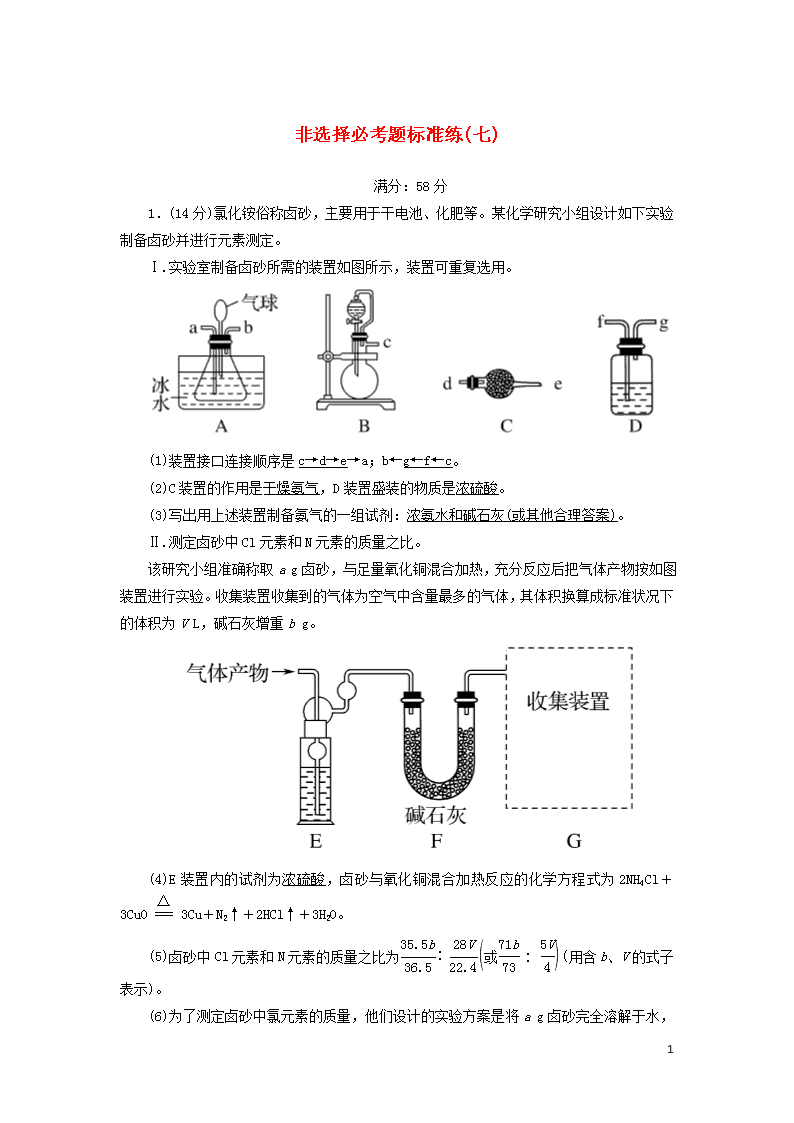
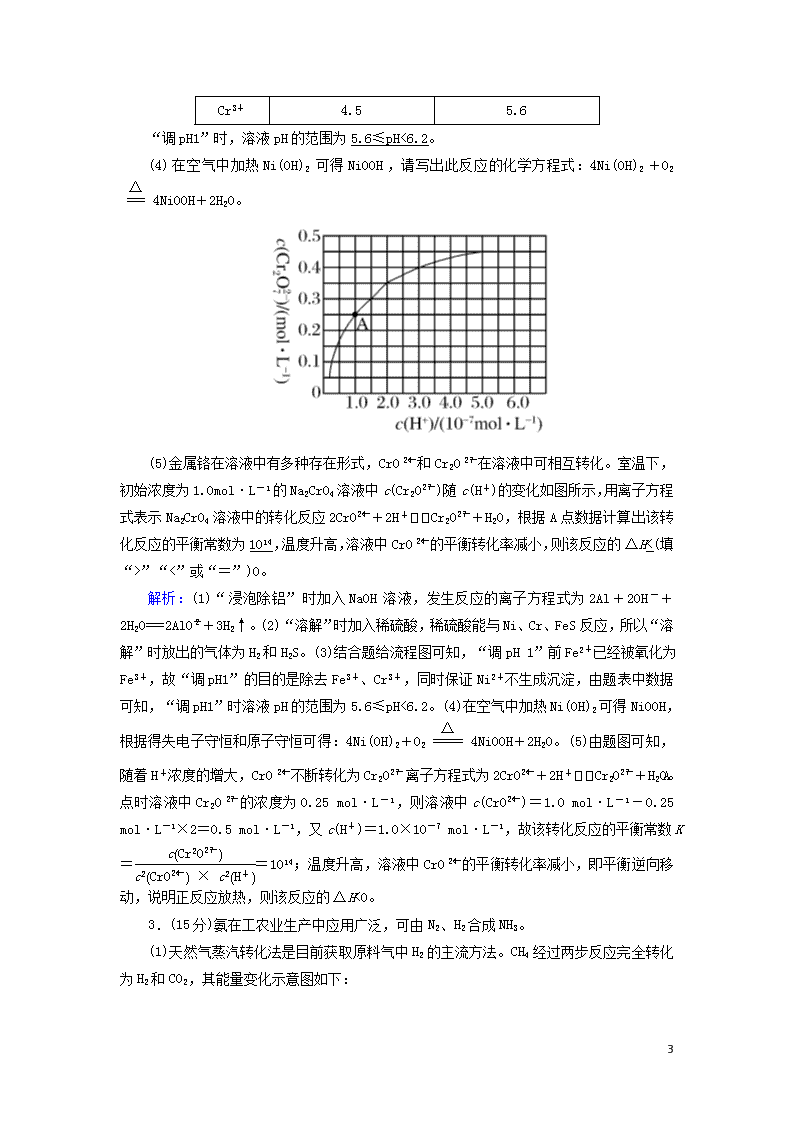
非选择必考题标准练(七) 满分:58分 1.(14分)氯化铵俗称卤砂,主要用于干电池、化肥等。某化学研究小组设计如下实验制备卤砂并进行元素测定。 Ⅰ.实验室制备卤砂所需的装置如图所示,装置可重复选用。 (1)装置接口连接顺序是c→d→e→a;b←g←f←c。 (2)C装置的作用是干燥氨气,D装置盛装的物质是浓硫酸。 (3)写出用上述装置制备氨气的一组试剂:浓氨水和碱石灰(或其他合理答案)。 Ⅱ.测定卤砂中Cl元素和N元素的质量之比。 该研究小组准确称取a g卤砂,与足量氧化铜混合加热,充分反应后把气体产物按如图装置进行实验。收集装置收集到的气体为空气中含量最多的气体,其体积换算成标准状况下的体积为V L,碱石灰增重b g。 (4)E装置内的试剂为浓硫酸,卤砂与氧化铜混合加热反应的化学方程式为2NH4Cl+3CuO3Cu+N2↑+2HCl↑+3H2O。 (5)卤砂中Cl元素和N元素的质量之比为∶(用含b、V的式子表示)。 (6)为了测定卤砂中氯元素的质量,他们设计的实验方案是将a 7 g卤砂完全溶解于水,加入过量AgNO3溶液,然后测定生成沉淀的质量。请你评价该方案是否合理,并说明理由:合理,氯化铵样品纯净,溶于水后其电离出的氯离子全部沉淀,故通过沉淀质量可求得氯元素的质量(或不合理,氨化铵样品不纯,杂质离子也发生了沉淀反应)。 解析:(1)结合实验目的及题给装置可知,从a、b接口分别向锥形瓶中通入NH3和HCl,可用B装置制备HCl,经D装置干燥后通入b,装置接口连接顺序为c→f→g→b;也可用B装置制备NH3,经C装置干燥后通入a,装置接口连接顺序为c→d→e→a。(2)C装置用于干燥NH3,D装置用于干燥HCl,盛装的物质是浓硫酸。(3)用B装置制备NH3可选用浓氨水和碱石灰。(4)NH4Cl与CuO的反应为2NH4Cl+3CuO3Cu+N2↑+2HCl↑+3H2O,装置E内盛装浓硫酸,可用于干燥气体。(5)装置F中碱石灰增加的重量等于HCl的质量,装置G中收集到的气体为N2,则卤砂中Cl元素与N元素的质量之比为∶×28=∶。(6)若NH4Cl样品纯净,其完全溶于水后,加入过量AgNO3溶液,溶液中的Cl-完全转化为AgCl,根据AgCl的质量可确定NH4Cl样品中Cl元素的质量;若NH4Cl样品不纯,混有的杂质离子也发生沉淀反应,则不能根据生成沉淀的质量确定NH4Cl样品中Cl元素的质量。 2.(14分)碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,还含少量Cr、FeS等)来制备,其工艺流程如下: 回答下列问题: (1)“浸泡除铝”时,发生反应的离子方程式为2Al+2OH-+2H2O===2AlO+3H2↑。 (2)“溶解”时放出的气体为H2、H2S(填化学式)。 (3)已知金属离子开始沉淀和完全沉淀的pH如表: 开始沉淀的pH 完全沉淀的pH Ni2+ 6.2 8.6 Fe2+ 7.6 9.1 Fe3+ 2.3 3.3 7 Cr3+ 4.5 5.6 “调pH1”时,溶液pH的范围为5.6≤pH<6.2。 (4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式:4Ni(OH)2+O24NiOOH+2H2O。 (5)金属铬在溶液中有多种存在形式,CrO和Cr2O在溶液中可相互转化。室温下,初始浓度为1.0mol·L-1的Na2CrO4溶液中c(Cr2O)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应2CrO+2H+Cr2O+H2O,根据A点数据计算出该转化反应的平衡常数为1014,温度升高,溶液中CrO的平衡转化率减小,则该反应的ΔH<(填“>”“<”或“=”)0。 解析:(1)“浸泡除铝”时加入NaOH溶液,发生反应的离子方程式为2Al+2OH-+2H2O===2AlO+3H2↑。(2)“溶解”时加入稀硫酸,稀硫酸能与Ni、Cr、FeS反应,所以“溶解”时放出的气体为H2和H2S。(3)结合题给流程图可知,“调pH 1”前Fe2+已经被氧化为Fe3+,故“调pH1”的目的是除去Fe3+、Cr3+,同时保证Ni2+不生成沉淀,由题表中数据可知,“调pH1”时溶液pH的范围为5.6≤pH<6.2。(4)在空气中加热Ni(OH)2可得NiOOH,根据得失电子守恒和原子守恒可得:4Ni(OH)2+O24NiOOH+2H2O。(5)由题图可知,随着H+浓度的增大,CrO不断转化为Cr2O,离子方程式为2CrO+2H+Cr2O+H2O。A点时溶液中Cr2O的浓度为0.25 mol·L-1,则溶液中c(CrO)=1.0 mol·L-1-0.25 mol·L-1×2=0.5 mol·L-1,又c(H+)=1.0×10-7 mol·L-1,故该转化反应的平衡常数K==1014;温度升高,溶液中CrO的平衡转化率减小,即平衡逆向移动,说明正反应放热,则该反应的ΔH<0。 3.(15分)氨在工农业生产中应用广泛,可由N2、H2合成NH3。 (1)天然气蒸汽转化法是目前获取原料气中H2的主流方法。CH4经过两步反应完全转化为H2和CO2,其能量变化示意图如下: 7 结合图象,写出CH4通过蒸汽转化为CO2和H2的热化学方程式:CH4(g)+2H2O(g)===CO2(g)+4H2(g) ΔH=+165.4 kJ·mol-1。 (2)利用透氧膜,一步即获得N2、H2,工作原理如图所示(空气中N2与O2的物质的量之比按4∶1计)。 ①起还原作用的物质是CH4。 ②膜Ⅰ侧所得气体中=2,CH4、H2O、O2反应的化学方程式是10CH4+8H2O+O2===10CO+28H2。 (3)甲小组模拟工业合成氨在一恒温恒容的密闭容器中发生反应:N2(g)+3H2(g)2NH3(g) ΔH<0。t1 min时达到平衡,在t2 min时改变某一条件,其反应过程如图所示,下列说法正确的是D。 7 A.Ⅰ、Ⅱ两过程达到平衡时,平衡常数:KⅠ查看更多