- 2021-02-26 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学二轮复习非选择必考题标准练5含解析
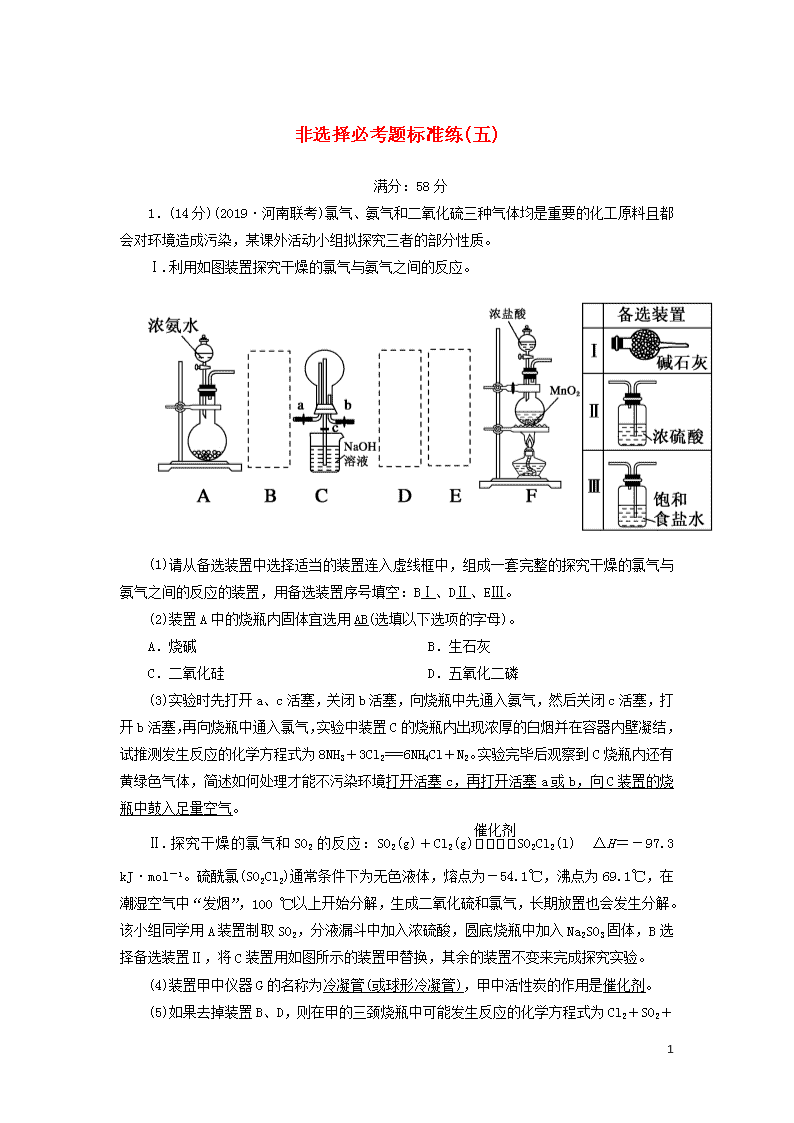
非选择必考题标准练(五) 满分:58分 1.(14分)(2019·河南联考)氯气、氨气和二氧化硫三种气体均是重要的化工原料且都会对环境造成污染,某课外活动小组拟探究三者的部分性质。 Ⅰ.利用如图装置探究干燥的氯气与氨气之间的反应。 (1)请从备选装置中选择适当的装置连入虚线框中,组成一套完整的探究干燥的氯气与氨气之间的反应的装置,用备选装置序号填空:BⅠ、DⅡ、EⅢ。 (2)装置A中的烧瓶内固体宜选用AB(选填以下选项的字母)。 A.烧碱 B.生石灰 C.二氧化硅 D.五氧化二磷 (3)实验时先打开a、c活塞,关闭b活塞,向烧瓶中先通入氨气,然后关闭c活塞,打开b活塞,再向烧瓶中通入氯气,实验中装置C的烧瓶内出现浓厚的白烟并在容器内壁凝结,试推测发生反应的化学方程式为8NH3+3Cl2===6NH4Cl+N2。实验完毕后观察到C烧瓶内还有黄绿色气体,简述如何处理才能不污染环境打开活塞c,再打开活塞a或b,向C装置的烧瓶中鼓入足量空气。 Ⅱ.探究干燥的氯气和SO2的反应:SO2(g)+Cl2(g)SO2Cl2(l) ΔH=-97.3 kJ·mol-1。硫酰氯(SO2Cl2)通常条件下为无色液体,熔点为-54.1 ℃,沸点为69.1 ℃,在潮湿空气中“发烟”,100 ℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。该小组同学用A装置制取SO2,分液漏斗中加入浓硫酸,圆底烧瓶中加入Na2SO3固体,B选择备选装置Ⅱ,将C装置用如图所示的装置甲替换,其余的装置不变来完成探究实验。 (4)装置甲中仪器G的名称为冷凝管(或球形冷凝管),甲中活性炭的作用是催化剂。 (5)如果去掉装置B、D,则在甲的三颈烧瓶中可能发生反应的化学方程式为Cl2+SO2 7 +2H2O===H2SO4+2HCl。 (6)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有ABC(填序号)。 A.先通冷凝水,再通气 B.控制气流速率,宜慢不宜快 C.若三颈烧瓶发烫,可适当降温 D.加热三颈烧瓶 解析:(1)要探究的是干燥的氯气与氨气之间的反应,由题给装置图可知A和F分别是制氨气和氯气的装置,制得的氯气中混有HCl和水蒸气,故通过盛有饱和食盐水的洗气瓶除掉氯化氢,通过盛有浓硫酸的洗气瓶干燥氯气,制得的氨气中也混有水蒸气,氨气用碱石灰干燥,故B、D、E处分别选Ⅰ、Ⅱ、Ⅲ。(2)装置A是以浓氨水和固体药品为原料来制取氨,故可选择的适宜的固体药品为烧碱或者生石灰,二者与浓氨水混合都可以使氨气逸出,故选A、B。(3)根据实验现象装置C的烧瓶内有白烟生成可知氯气和氨气反应生成了NH4Cl,则发生了氧化还原反应,Cl元素化合价降低,则N元素化合价升高,有N2生成,据此可写出化学方程式:8NH3+3Cl2===6NH4Cl+N2。(4)装置甲中仪器G的名称为冷凝管(或球形冷凝管),根据此反应要在催化剂条件下进行,可知甲中活性炭作催化剂。(5)如果去掉装置B、D,就会有水蒸气混入甲中,则可能发生反应的化学方程式为Cl2+SO2+2H2O===H2SO4+2HCl。(6)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有先通冷凝水,再通气,可以减少产品的挥发损失;控制气流速率,宜慢不宜快可以让反应更充分;因为此反应为放热反应,而生成的产物100 ℃以上开始分解,所以当三颈烧瓶发烫时,可适当降温,所以答案为A、B、C。 2.(15分)单质硼是冶金、建材、化工、核工业等部门的重要原料,而金属镁也广泛应用于航空航天等国防军事工业。以铁硼矿为原料,利用碳碱法工艺生产硼和镁,其工艺流程图如下: 7 已知:铁硼矿的主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Al2O3和SiO2杂质;硼砂的化学式为Na2B4O7·10H2O。 (1)铁硼矿研磨粉碎的目的是增大反应物的接触面积;加快化学反应速率;提高原料利用率(任选一条);操作Ⅰ的名称为过滤;硼泥中除杂质SiO2和Al2O3外,其他成分的化学式为Fe3O4、MgCO3。 (2)写出流程图中碳解过程的化学方程式:2Mg2B2O5+Na2CO3+3CO2===Na2B4O7+4MgCO3;在高温条件下金属Mg与A反应制备单质硼的化学方程式为:3Mg+B2O32B+3MgO。 (3)碳碱工艺需两次调节pH:①常用H2SO4调节硼砂溶液pH=2~3制取H3BO3,其离子方程式为B4O+2H++5H2O===4H3BO3;②制取MgCl2·7H2O时,在净化除杂过程中,需先加H2O2溶液,其作用是将Fe2+氧化为Fe3+,然后用MgO调节pH约为5,其目的是使Fe3+形成氢氧化物沉淀而除去。 (4)用MgCl2·7H2O制取MgCl2时,为防止MgCl2水解,反应需在“一定条件下”进行,则该条件是指干燥的HCl气氛、加热。 (5)实验时不小心触碰到NaOH溶液,可用大量清水冲洗,再涂抹H3BO3溶液中和,其化学方程式为:NaOH+H3BO3===Na[B(OH)4],下列关于Na[B(OH)4]溶液中微粒浓度关系正确的是AC。 A.c(Na+)+c(H+)=c([B(OH)4]-)+c(OH-) B.c(Na+)>c([B(OH)4]-)>c(H+)>c(OH-) C.c(Na+)=c([B(OH)4]-)+c(H3BO3) 解析:(1)将铁硼矿研磨粉碎可以增大反应物的接触面积,加快化学反应速率,提高原料的利用率等;铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Al2O3和SiO2)碳解生成硼砂,碳解过程的化学方程式为:2Mg2B2O5+Na2CO3+3CO2===Na2B4O7+4MgCO3,而Fe3O4、Al2O3和SiO2均不与Na2CO3反应。(2)硼酸受热分解的化学方程式为:2H3BO33H2O+B2O3,A为B2O3;Mg与B2O3反应制备硼的化学方程式为:3Mg+B2O32B+3MgO。(3)根据题意确定反应物为硼砂和硫酸,生成物为硼酸,其离子方程式为:B4O+2H++5H2O===4H3BO3 7 ;向硼泥(含Fe3O4、Al2O3、SiO2和MgCO3)中加入氢氧化钠溶液发生反应的化学方程式为:Al2O3+2NaOH===2NaAlO2+H2O和SiO2+2NaOH===Na2SiO3+H2O;过滤后滤渣的成分为Fe3O4和MgCO3,加入盐酸溶解,发生反应的化学方程式为:Fe3O4+8HCl===FeCl2+2FeCl3+4H2O和MgCO3+2HCl===MgCl2+H2O+CO2↑;净化除杂过程中加入H2O2的作用是将Fe2+氧化为Fe3+,其离子方程式为:2H++H2O2+2Fe2+===2Fe3++2H2O,用MgO调节溶液pH约为5,其目的是使Fe3+形成氢氧化物沉淀而除去。(4)用MgCl2·7H2O制取MgCl2时,为防止MgCl2水解,反应需在干燥的HCl气氛和加热条件下进行。(5)根据化学方程式NaOH+H3BO3===Na[B(OH)4],可确定溶液中阳离子为H+和Na+,阴离子为[B(OH)4]-和OH-,由电荷守恒:c(Na+)+c(H+)=c([B(OH)4]-)+c(OH-),A项正确;由物料守恒:c(Na+)=c([B(OH)4]-)+c(H3BO3),C项正确;[B(OH)4]-水解使溶液呈碱性,故c(Na+)>c([B(OH)4]-)>c(OH-)>c(H+),B项错误。 3.(14分)(2019·武汉调研)砷及其化合物有着广泛的用途。砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。已知砷酸(H3AsO4)的pKa1、pKa2、pKa3依次为2.25、6.77、11.40(pKa=-lgKa)。回答下列问题: (1)已知:As(s)+H2(g)+2O2(g)===H3AsO4(s) ΔH1 H2(g)+O2(g)===H2O(l) ΔH2 As(s)+O2(g)===As2O5(s) ΔH3 则反应As2O5(s)+3H2O(l)===2H3AsO4(s) ΔH=2ΔH1-3ΔH2-2ΔH3。 (2)写出砷酸(H3AsO4)的第二步电离方程式H2AsOH++HAsO。 (3)NaH2AsO4溶液呈酸性(填“酸性”“中性”或“碱性”),试通过计算说明Kh3===10-11.75<10-6.77,即Ka2>Kh3,溶液呈酸性。 (4)亚砷酸(H3AsO3)水溶液中存在多种微粒形态,各种微粒分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液的pH关系如图Ⅰ所示。 以酚酞为指示剂(变色范围pH 8.2~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为H3AsO3+OH-===H2AsO+H2O。 (5)某化学兴趣小组同学欲探究可逆反应:AsO+I2+2OH-AsO+2I-+H2O。设计图Ⅱ所示装置。实验操作及现象:按图Ⅱ装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图Ⅱ装置左边烧杯中逐滴加入一定量2 mol·L-1盐酸,发现又产生电流,实验中电流与时间的关系如图Ⅲ所示。 7 ①图Ⅲ中AsO的逆反应速率:a<(填“>”“<”或“=”)b。 ②写出图Ⅲ中c点对应图Ⅱ装置的正极反应式AsO+2e-+2H+===AsO+H2O。 ③能判断该反应达到平衡状态的是bcd。 a.2v(I-)正=v(AsO)逆 b.溶液的pH不再变化 c.电流表示数变为零 d.溶液颜色不再变化 解析:(1)将题中已知热化学方程式依次编号为①、②、③,根据盖斯定律,由①×2-②×3-③×2得As2O5(s)+3H2O(l)===2H3AsO4(s) ΔH=2ΔH1-3ΔH2-2ΔH3。(2)砷酸(H3AsO4)为多元弱酸,分步电离,第二步电离方程式为H2AsOH++HAsO。(3)NaH2AsO4溶液Kh3===10-11.75<10-6.77,即Ka2>Kh3,故溶液呈酸性。(4)酚酞的变色pH范围为8.2~10.0,当溶液由无色变为浅红色时,根据图中曲线变化知,该过程发生的主要反应为H3AsO3转化为H2AsO,离子方程式为H3AsO3+OH-=== H2AsO+H2O。(5)①电流由C2流入C1时,C2作正极,发生还原反应,则可逆反应正向进行,随着反应的进行,粒子浓度减小,电流减小,正反应速率减小,逆反应速率增大,故图Ⅲ中AsO的逆反应速率:a查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档