- 2021-04-14 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习全国非新高考地区版第十二章微考点84破解微粒子间作用力与晶体性质的关系作业
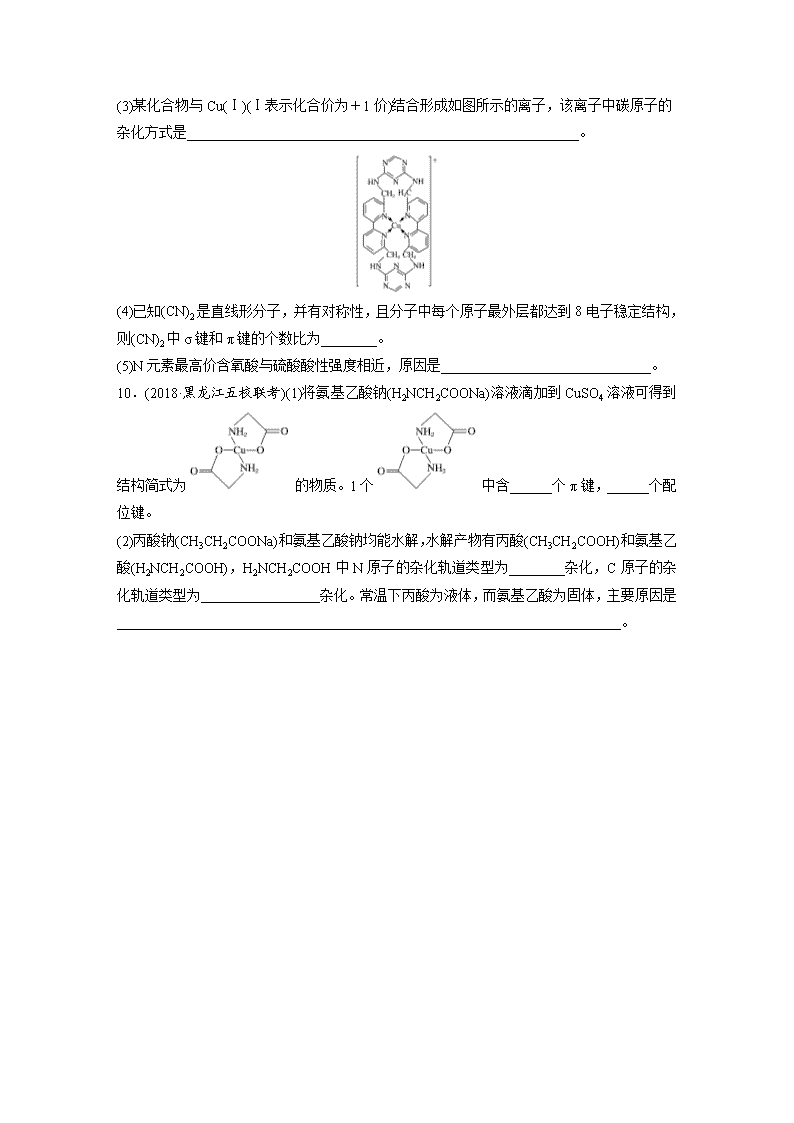
1.(2018·合肥市第一中学高三月考)下表所列物质晶体的类型全部正确的一组是( ) 原子晶体 离子晶体 分子晶体 A 氮化硅 磷酸 单质硫 B 单晶硅 氯化铝 白磷 C 金刚石 烧碱 冰 D 铁 尿素 冰醋酸 2.(2018·江西八校高三联考)下列说法正确的是( ) A.分子晶体中一定存在分子间作用力,不一定存在共价键 B.分子中含两个氢原子的酸一定是二元酸 C.含有金属阳离子的晶体一定是离子晶体 D.元素的非金属性越强,其单质的活泼性一定越强 3.(2018·长沙一中调研)下列有关离子晶体的数据大小比较不正确的是( ) A.熔点:NaF>MgF2>AlF3 B.晶格能:NaF>NaCl>NaBr C.阴离子的配位数:CsCl>NaCl>CaF2 D.硬度:MgO>CaO>BaO 4.(2018·四川绵阳南山中学期中)PH3是一种无色剧毒气体,其分子结构和NH3相似,P—H键键能比N—H键键能低。下列判断错误的是( ) A.PH3是极性分子,呈三角锥形,与NH3是等电子体 B.PH3分子中的原子不都满足8e-结构 C.PH3沸点低于NH3沸点,因为P—H键键能低 D.PH3分子稳定性低于NH3分子,因为N—H键键能高 5.(2018·四川绵阳南山中学期中)氮氧化铝(AlON)是一种硬度超强透明材料,下列描述正确的是( ) A.AlON和石英的化学键类型相同 B.AlON不属于原子晶体 C.AlON和Al2O3的组成微粒相同 D.AlON和AlCl3晶型相同 6.下表给出了几种氯化物的熔点和沸点。 物质 NaCl MgCl2 AlCl3 CCl4 熔点/℃ 801 712 190 -22.6 沸点/℃ 1 413 1 412 182.7 76.8 关于表中4种氯化物有下列说法( ) ①AlCl3在加热时可升化 ②CCl4属于分子晶体 ③1 500 ℃时NaCl的分子组成可用NaCl表示 ④AlCl3是典型的离子晶体 其中说法正确的是( ) A.只有①和② B.只有③ C.只有①②③ D.全部正确 7.(2019·哈尔滨质检)下列对一些实验事实的解释正确的是( ) 选项 实验事实 解释 A 水加热到较高温度都难以分解 水分子间存在氢键 B 白磷为正四面体分子 白磷分子中P—P键间的键角是109°28′ C 用苯萃取碘水中的I2 苯和I2均为非极性分子且苯与水不互溶 D H2O的沸点高于H2S H—O键的键长比H—S键的键长短 8.最近科学家成功地制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价键与氧原子结合为一种空间网状的无限伸展结构,下列对该晶体叙述错误的是( ) A.该物质的化学式为CO2 B.晶体的熔、沸点高,硬度大 C.晶体中碳原子数与C—O化学键数之比为1∶4 D.该物质的性质与二氧化碳相似 9.按要求回答下列问题: (1)下列说法错误的是________(填字母)。 A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2 B.电负性顺序:C<N<O C.N2与CO互为等电子体,结构相似,化学性质相似 D.稳定性:H2O>H2S,是由于水分子间存在氢键 (2)铜离子是人体内多种酶的辅因子,人工模拟酶是当前研究的特点。向硫酸铜溶液中通入过量的氨气可生成[Cu(NH3)4]2+,该离子的结构式为____________________(用元素符号表示)。 (3)某化合物与Cu(Ⅰ)(Ⅰ表示化合价为+1价)结合形成如图所示的离子,该离子中碳原子的杂化方式是________________________________________________________。 (4)已知(CN)2是直线形分子,并有对称性,且分子中每个原子最外层都达到8电子稳定结构,则(CN)2中σ键和π键的个数比为________。 (5)N元素最高价含氧酸与硫酸酸性强度相近,原因是______________________________。 10.(2018·黑龙江五校联考)(1)将氨基乙酸钠(H2NCH2COONa)溶液滴加到CuSO4溶液可得到结构简式为的物质。1个中含______个π键,______个配位键。 (2)丙酸钠(CH3CH2COONa)和氨基乙酸钠均能水解,水解产物有丙酸(CH3CH2COOH)和氨基乙酸(H2NCH2COOH),H2NCH2COOH中N原子的杂化轨道类型为________杂化,C原子的杂化轨道类型为_________________杂化。常温下丙酸为液体,而氨基乙酸为固体,主要原因是________________________________________________________________________。 答案精析 1.C [磷酸属于分子晶体,A错误;氯化铝属于分子晶体,B错误;铁属于金属晶体,尿素属于分子晶体,D错误。] 2.A [分子晶体中一定含有分子间作用力,但不一定含有共价键,如稀有气体分子中不含共价键,A正确;分子中含有2个氢原子的酸不一定是二元酸,如甲酸为一元酸,B错误;含有金属阳离子的晶体还可能是金属晶体,C错误;元素的非金属性越强,其单质的活泼性不一定越强,如N元素的非金属性大于P元素的,但氮气比P单质稳定,D错误。] 3.A [由于r(Na+)>r(Mg2+)>r(Al3+),且Na+、Mg2+、Al3+所带电荷依次增大,所以 NaF、MgF2、AlF3的离子键依次增强,晶格能依次增大,故熔点依次升高,A错误;r(F-)<r(Cl-)<r(Br-),故 NaF、NaCl、NaBr 的晶格能依次减小,B正确;在CsCl、NaCl、CaF2中阴离子的配位数分别为8、6、4,C正确;r(Mg2+)<r(Ca2+)<r(Ba2+),故MgO、CaO、BaO 中离子键依次减弱,晶格能依次减小,硬度依次减小,D正确。] 4.C [PH3是极性分子,呈三角锥形,与NH3是等电子体,故A正确;PH3分子中的氢原子只能满足2e-结构,故B正确;PH3和NH3都属于分子晶体,分子晶体熔、沸点高低取决于分子间作用力大小,与共价键键能大小没有直接关系,PH3沸点低于NH3沸点,因为NH3分子之间存在氢键,故C错误;PH3分子稳定性低于NH3分子,因为N—H键键能高,故D正确。] 5.A [氮氧化铝(AlON)因硬度超强而属于原子晶体。AlON和石英都属于原子晶体,它们的化学键都是共价键,所以化学键类型相同,故A正确、B错误;原子晶体AlON的组成微粒是原子,离子晶体Al2O3的组成微粒是离子,它们的组成微粒不同,故C错误;原子晶体AlON和分子晶体AlCl3晶型不同,故D错误。] 6.C [①由表格中的数据可知AlCl3的熔、沸点较低,则AlCl3属于分子晶体,且其沸点低于熔点,故加热时能升华,故正确;②由表格中的数据可知CCl4的熔、沸点较低,则CCl4是分子晶体,故正确;③由表格中的数据可知,NaCl的沸点为1 413 ℃,则1 500 ℃时,NaCl可形成气态分子,组成可用NaCl表示,故正确;④由表格中的数据可知AlCl3的熔、沸点较低,则AlCl3属于分子晶体,故错误;故选C。] 7.C [A项,水分子的稳定性与化学键有关,与氢键无关,水加热到较高温度都难以分解,说明水中存在的化学键较强,错误;B项,白磷是正四面体结构,四个顶点上分别有一个P原子,键角为60°,错误;C项,非极性分子的溶质易溶于非极性分子的溶剂,碘和苯都是非极性分子,水是极性分子,所以苯与水不互溶,可以用苯萃取碘水中的I2,正确;D项,氢化物的熔、沸点与范德华力和氢键有关,H2O的沸点高于H2S,说明水中含有氢键,错误。] 8.D [晶体中每个碳原子均以四个共价单键与氧原子结合,每个氧原子和2个碳原子以共价单键相结合,所以碳氧原子个数比为1∶2,化学式为CO2,A正确;该化合物属于原子晶体,熔、沸点高,硬度大,B正确;该晶体中,每个碳原子含有4个C—O共价键,C原子与C—O化学键数目之比为1∶4,C正确;该化合物晶体属于原子晶体,二氧化碳为分子晶体,性质与二氧化碳不相似,D错误。] 9.(1)ACD (2) (3)sp2、sp3 (4)3∶4 (5)HNO3的非羟基氧个数与H2SO4的非羟基氧个数相同 解析 (1)沸点:SiO2>CO2,是由于二氧化硅属于原子晶体,二氧化碳属于分子晶体,A项错误;同周期元素随原子序数增大电负性增大,故电负性顺序:C<N<O,B正确;N2与CO分子都含有2个原子,价电子总数都是10,二者为等电子体,结构相似,但化学性质不相似,C错误;稳定性:H2O>H2S,是因为非金属性O>S,与分子之间是否存在氢键无关,D错误。(3)杂环上的碳原子含有3个σ键,没有孤电子对,采用sp2杂化,亚甲基上碳原子含有4个共价单键,采用sp3杂化。(4)(CN)2的结构式为N≡C—C≡N,分子中σ键和π键的个数比为3∶4。(5)HNO3和H2SO4中都含两个非羟基氧,故酸性相近。 10.(1)2 2 (2)sp3 sp3、sp2 羧基的存在使丙酸形成分子间氢键,而氨基乙酸分子中,羧基和氨基均能形成分子间氢键 解析 (1)1个中含有2个π键,Cu与2个N形成2个配位键。(2)H2NCH2COOH中N原子上有3对成键电子和1对孤电子对,故为sp3杂化;H2NCH2COOH中—CH2—的C原子为sp3杂化,羧基上C原子为sp2杂化。分子间氢键能影响物质的熔、沸点。查看更多