- 2021-04-14 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2019届江西省南康中学高二上学期第三次月考(2017
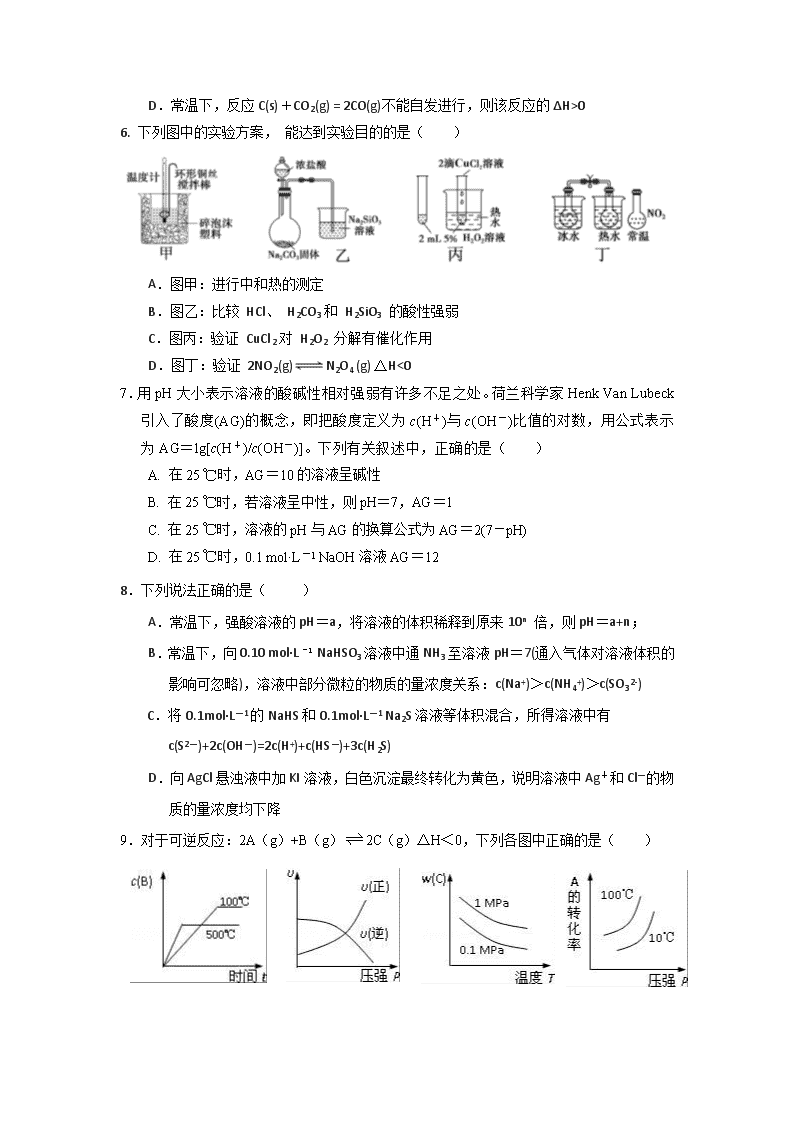
南康中学2017~2018学年度第一学期高二第三次大考 化 学 试 卷 可能用到的相对原子质量: H-1 C-12 O-16 N-14 Na-23 Mg-24 Al-27 S-32 Zn-65 一、选择题(本题包括16小题,每小题只有一个正确答案,每小题3分,共48分) 1.我国清代《本草纲目拾遗》中记载药物“鼻冲水”,写道:“贮以玻璃瓶,紧塞其口,勿使泄气,则药力不减,气甚辛烈,触人脑,非有病不可嗅。……虚弱者忌之。宜外用,勿服。……”这里的“鼻冲水”是指( ) A.硝酸 B.氨水 C.醋 D.卤水 2.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( ) A.标准状况下,22.4 L HF中含有的共价键数目为1.0NA B.常温常压下,12.0 gNaHSO4中含有离子总数为0.3NA C.在1 L 0.1 mol·L-1碳酸钠溶液中,阴离子总数大于0.1NA D.某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA 3.能用勒夏特列原理解释的是( ) A.煅烧粉碎的硫铁矿有利于SO2生成 B.由H2、I2、HI三种气体组成的平衡体系加压后颜色变深 C.使用铁触媒,使N2和H2的混合气体有利于合成NH3 D.实验室常用排饱和食盐水法收集Cl2 4.下列各选项中所述的两个量,前者比后者大的是( ) A.25℃时,pH均为3的HCl和FeCl3溶液中水的电离程度 B.25℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度 C.物质的量浓度相等的(NH4)2SO4溶液和(NH4)2SO3溶液中NH4+的浓度 D.将pH=4的盐酸和醋酸分别稀释成pH=5的溶液,所加水的量 5.下列有关化学反应方向及其判据的说法中错误的是( ) A.1 mol H2O在不同状态时的熵值:S[H2O(s)]<S[H2O(g)] B.凡是放热反应都是自发的,因为吸热反应都是非自发的 C.CaCO3(s)CaO(s)+CO2(g) △H>0 能否自发进行与温度有关 D.常温下,反应C(s)+CO2(g) = 2CO(g)不能自发进行,则该反应的ΔH>0 6. 下列图中的实验方案, 能达到实验目的的是( ) A.图甲:进行中和热的测定 B.图乙:比较 HCl、 H2CO3和 H2SiO3 的酸性强弱 C.图丙:验证 CuCl2对 H2O2 分解有催化作用 D.图丁:验证 2NO2(g)N2O4 (g) △H<0 7.用pH大小表示溶液的酸碱性相对强弱有许多不足之处。荷兰科学家Henk Van Lubeck引入了酸度(AG)的概念,即把酸度定义为c(H+)与c(OH-)比值的对数,用公式表示为AG=lg[c(H+)/c(OH-)]。下列有关叙述中,正确的是( ) A. 在25 ℃时,AG=10的溶液呈碱性 B. 在25 ℃时,若溶液呈中性,则pH=7,AG=1 C. 在25 ℃时,溶液的pH与AG的换算公式为AG=2(7-pH) D. 在25 ℃时,0.1 mol·L-1 NaOH溶液AG=12 8.下列说法正确的是( ) A.常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n 倍,则pH=a+n; B.常温下,向0.10 mol·L -1 NaHSO3溶液中通NH3至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系:c(Na+)>c(NH4+)>c(SO32-) C.将0.1mol·L—1的NaHS和0.1mol·L—1 Na2S溶液等体积混合,所得溶液中有 c(S2—)+2c(OH—)=2c(H+)+c(HS—)+3c(H2S) D.向AgCl悬浊液中加KI溶液,白色沉淀最终转化为黄色,说明溶液中Ag+和Cl—的物质的量浓度均下降 9.对于可逆反应:2A(g)+B(g)2C(g)△H<0,下列各图中正确的是( ) A B C D 10.下列表述中,关于“一定”说法正确的个数是( ) ①pH=6的溶液一定是酸性溶液 ②c(H+)>c(OH-)一定是酸性溶液 ③用Na2S溶液和CuSO4溶液反应制取CuS固体 ④25℃时,水溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14 ⑤如果Na2Y的水溶液显中性,该溶液中一定没有电离平衡 ⑥0.2mol/L氢硫酸溶液加水稀释,电离程度增大,c(H+)一定增大 ⑦温度保持不变,向水中加入钠盐对水的电离一定没有影响 ⑧使用pH试纸测定溶液pH时若先润湿,则测得溶液的pH一定有影响 ⑨用Na2S溶液和Al2(SO4)3溶液反应制取Al2S3固体 ⑩用广范pH试纸测得某溶液的pH为2.3 A.2 B.3 C.1 D.4 11.常温下,0.1mol•L﹣1某一元酸(HA)溶液的pH=3.下列叙述正确的是( ) A.该溶液中:2c(H+)=c(A﹣)+c(OH﹣) B.由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中: c(Na+)>c(A﹣)>c(OH﹣)>c(H+) C.浓度均为0.1 mol•L﹣1的HA和NaA溶液等体积混合,所得溶液中: c(A﹣)>c(HA)>c(Na+)>c(OH﹣)>c(H+) D.0.1 mol•L﹣1 HA溶液与0.05 mol•L﹣1 NaOH溶液等体积混合,所得溶液中: ① ② ③ ④ 2c(H+)+c(HA)═c(A﹣)+2c(OH﹣) 12.25℃时,向20.00ml的NaOH溶液中逐滴加入某浓度的CH3COOH溶液,滴定过程中,溶液的pH与滴入CH3COOH溶液的体积的关系如图所示,②点时NaOH溶液恰好被中和,则下列说法中,正确的是( ) A.该滴定过程应该选择甲基橙作为指示剂 B.点④所示溶液中存在:c(CH3COOH)+c(H+) ﹤c(CH3COO﹣)+c(OH﹣) C.图中点①到点③所示溶液中,水的电离程度先减小后增大 D.点①所示溶液中存在:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+) 13.可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂.医院抢救钡离子中毒患者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液.已知:某温度下,Ksp(BaCO3)=5.1×10﹣9 mol2•L﹣2;Ksp(BaSO4)=l.1×10﹣10 mol2•L﹣2下列推断正确的是( ) A.不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4) B.抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替 C.若误饮c(Ba2+)=1.0×10﹣5 mol•L﹣1的溶液时,会引起钡离子中毒 D.可以用0.36 mol•L﹣1的Na2SO4溶液给钡离子中毒患者洗胃 14. 已知:CO(g)+H2O(g)CO2(g)+H2(g) △H=-41kJ/mol,相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下: 容器编号 起始时各物质物质的量/mol[] 达平衡过程体系能量的变化[] CO H2O CO2 H2 ① 1 4 0 0 放出热量:32.8 kJ ② 0 0 1 4 热量变化: Q 下列说法中,不正确的是( ) A.容器①中反应达平衡时,CO的转化率为80% B.容器①中CO的转化率等于容器②中CO2的转化率 C.平衡时,两容器中CO2的浓度相等 D.容器①中CO反应速率等于H2O的反应速率 15.25 ℃时某些弱酸的电离平衡常数如下表所示: CH3COOH HClO H2CO3 K(CH3COOH) =1.8×10-5 K(HClO) =3.0×10-8 K(H2CO3)a1=4.4×10-7 K(H2CO3)a2=4.7×10-11 常温下,稀释CH3COOH、HClO两种酸时,溶液的pH随加水量变化的曲线如图所示,下列说法正确的是( ) A.相同浓度的CH3COOH和HClO的混合溶液中,各离子浓度的 大小关系是:c(H+)>c(ClO-)>c(CH3COO-)>c(OH-) B.图像中a、c两点所处的溶液中相等(HR代表CH3COOH或HClO) C.图像中a点酸的浓度大于b点酸的浓度 D.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32— 16.可逆反应①X(g)+2Y(g) 2Z(g) 、②2M(g)N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示: 下列判断正确的是( ) A.反应①的正反应是吸热反应 B.达平衡(I)时,X的转化率为5/11 C.在平衡(I)和平衡(II)中M的体积分数相等 D.达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15 二、非选择题(共52分) 17.(8分)(1)下表是不同温度下水的离子积数据: 温度/℃ 25 t1 t2 水的离子积常数 1×10—14 α 1×10—12 试回答以下问题: ①若25<t1<t2,则α 1×10—14 (填“<”“>”或“=”) ②t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2= 。 (2)KI溶液与Pb(NO3)2溶液混合可形成沉淀PbI2,且Ksp(PbI2)=7.0×10—9。 现将浓度为1.0×10—2 mo1•L—1KI溶液与c mo1•L—1Pb(NO3)2溶液等体积混合,则生成PbI2沉淀所需 Pb(NO3)2溶液的最小浓度c= mol·L—1 (3)将1mol NH4Cl粉末完全溶解在50mL稀氨水中,溶液的pH恰好等于7,则稀氨水的浓度为 mol•L﹣1(NH3•H2O的电离平衡常数Kb为2×10﹣5,溶液体积的变化忽略不计). (4)0.05mol某液态有机物2.3g和一定量的氧气混合点燃,恰好完全燃烧,生成2.7g液态水和2.24CO2(标准状况)并放出68.35kJ热量,则能表达该有机物燃烧热的热化学方程式是 . 18.(12分)Ⅰ.工业上可用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示: 化学反应 平衡 常数 温度/℃ 500 800 ①2H2(g)+CO(g) CH3OH(g) K1 2.5 0.15 ②H2(g)+CO2(g) H2O(g)+CO(g) K2 1.0 2.50 ③3H2(g)+CO2(g) CH3OH(g)+H2O(g) K3 4.5 (1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。500℃时测得反应 ③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此 时v正________v逆(填“>”、“=”或“<”)。 (2)在3L容积可变的密闭容器中发生反应②,已知c(CO)—反应时间t变化曲线Ⅰ如图所示,若在t0时刻分 别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是_______________。 当曲线Ⅰ变为曲线Ⅲ时,改变的条件是______________。 Ⅱ.利用CO和H2可以合成甲醇,反应原理为CO(g)+2H2(g) CH3OH(g)。一定条件下,在容积为VL的密闭容器中充入amolCO与2amolH2合成甲醇,平衡转化率与温度、压强的关系如下图所示。 (1)p1________p2(填“>”、“<”或“=”),理由是 。 (2)该甲醇合成反应在A点的平衡常数K= (用a和V表示)。 19.(14分)草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。回答下列问题: (1)甲组同学按照如下图所示的装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象是_______________________,由此可知草酸晶体分解的产物中有_______。装置B的主要作用是_________________________________。 (2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。 ①乙组同学的实验装置中,依次连接的合理顺序为A、B、_____________________________。 ②能证明草酸晶体分解产物中有CO的现象是 。 (3)设计实验证明: ①草酸的酸性比碳酸的强 。 ②草酸为二元酸 。 20.(10分)有A、B、C、D四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复). 阳离子 Na+、Ba2+、NH4+ 阴离子 CH3COO﹣、OH﹣、Cl﹣、SO42﹣ 已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无现象. (1)A是 ,B是 (填化学式). (2)用离子方程式表示A溶液pH大于7的原因: . (3)25℃时,0.1mol•L﹣1 B溶液的pH=a,则B溶液中c(H+)﹣c(NH3•H2O)= (用含有a的关系式表示). (4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是 . 21、(8分) 甲、乙两容器,甲的容积固定,乙的容积可变。在一定温度下,向甲中通入3mol N2和4mol H2,反应达到平衡时,生成NH3的物质的量为amol。 (1)相同温度下,向乙中通入2molNH3,且保持容积与甲相同,当反应达到平衡时,各物质的浓度与甲平衡中相同。起始时乙中还通入了____mol N2和____mol H2。 (2)相同温度下,若向乙中通入6mol N2和8mol H2,且保持压强与甲相等,当反应达到平衡时,生成氨的物质的量为b mol,则a∶b______1∶2;若乙与甲的容积始终相等,达到平衡时,生成氨的物质的量为c mol,则a∶c_____1∶2 (填“>”、“<”或“=”)。 南康中学2017~2018学年度第一学期高二第三次大考 化学参考答案 一、选择题(本题包括16小题,每小题只有一个正确答案,每小题3分,共48分) 题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 答案 B C D C B D C C C A D B D C B B 二、非选择题(共52分) 17、(1)①>, ② 9∶11(或); (2)5.6×10—4 (3)0.1 (4)C2H6O(l)+3O2(g)=2CO2(g)+3H2O(l)△H=﹣1367kJ/mol 18、Ⅰ(1)K1·K2,>; (2)加入催化剂;将容器的体积(快速)压缩至2 L; Ⅱ.(1)<;甲醇的合成反应是分子数减少的反应,相同温度下,增大压强CO的转化率提高;(2); 19、(1)有气泡逸出,澄清石灰水变浑浊;CO2;冷凝(水蒸气、草酸等),避免草酸进入装置C反应生成沉淀,干扰CO2的检验。 (2)①F、D、G、H、D、I; ②H中的粉末有黑色变为红色,其后的D中的石灰水变浑浊; (3)①向盛有少量NaHCO3溶液的试管中滴加草酸溶液,有气泡产生。 ②用氢氧化钠标准溶液滴定草酸溶液,消耗氢氧化钠的物质的量是草酸的两倍 20、(1)CH3COONa NH4Cl (2)CH3COO﹣+H2O⇌CH3COOH+OH﹣ (3)10a﹣14mol•L﹣1 (未写单位扣1分) (4)c(OH﹣)>c(Ba2+)=c(Cl﹣)>c(NH4+)>c(H+) 21、(1)2mol N2和1mol H2 (2)平衡氨的物质的量物质的量b=2a,所以a:b=1:2 平衡时氨的物质的量物质的量c>2a,即a:c<1:2查看更多