- 2021-04-14 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考物构复习专题练习
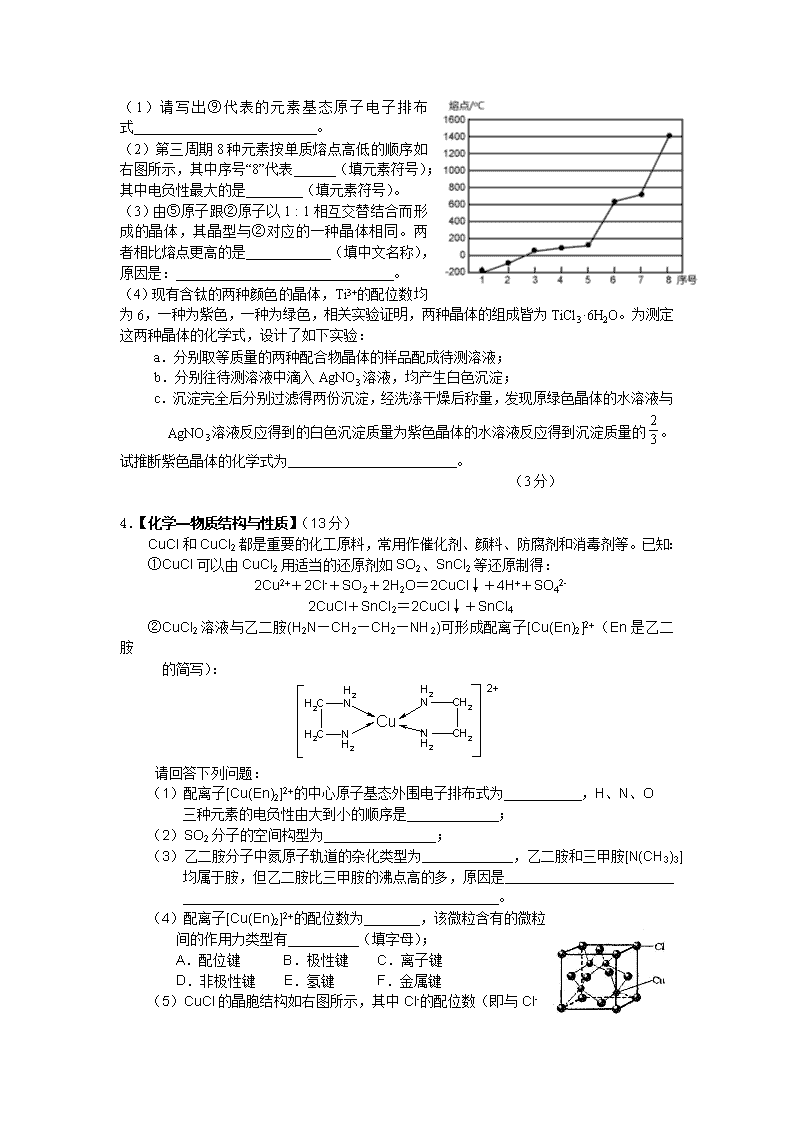
1.【化学—物质结构与性质】(13分) 已知A、B、C、D、E、F、G七种元素,G原子核外有四个电子层,其余原子至多只有三个电子层,且原子序数依次递增。A、B位于周期表的s区,A原子中电子层数和未成对电子数相同,B和A同族且位于A的下一周期,C元素基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,E的基态原子核外成对电子数是未成对电子数的3倍,F与E不同周期且F在其周期中的电负性最大,G原子d轨道有2对成对电子。请回答下列问题: (1)G基态原子的外围电子排布式是 (2)D和F组成的化合物DF3的分子空间构型是 ,属于 分子(填“极性”或“非极性”) (3)下列有关上述元素的说法中,不正确的是 。(填字母) a.第一电离能D>E b.E的氢化物的沸点比D的氢化物沸点高 c.SiO44-与FE4-互为等电子体 d.C3 A6直链分子中C原子采取sp、sp3两种杂化方式 (4)ACD分子中含 个σ键。 (5)GCl3能与NH3反应形成一种六配位的配合物,两个氯离子位于外界,则该配合物的化学式为 。 (6)C的单质是一种层状结构,B和C 形成一种化合物,B的离子位于C单质的层间、其投影位于层面内六圆环的中央, “·”表示B离子的位置,平行四边形表示在此二维图形上画出的一个晶胞。则该化合物的化学式为 2.(化学——物质结构与性质,13分)氮是地球上极为丰富的元素。填写下列空白。 (1)NH4+中N原子的杂化方式为 ,NH4+离子的空间构型为 (2)Li3N晶体中氮以N3-存在,基态N3-的电子排布式为 。 (3)N、P、O三种元素的电负性由小到大的顺序为 。NH3的沸点高于PH3的原因是 (4)CO与N2相似,分子中都存在一个共价叁键,其中含______个π键。右表为CO和N2的有关信息。根据表中数据,说明CO比N2活泼的原因是___ 。 3.【化学——物质结构与性质】(13分) 下表是元素周期表的一部分。表中所列的编号分别代表一种化学元素。 ① ② ③ ④ ⑤ ⑥ ⑦ ⑩ ⑧ ⑨ 试回答下列问题: (1)请写出⑨代表的元素基态原子电子排布式 。 (2)第三周期8种元素按单质熔点高低的顺序如右图所示,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填元素符号)。 (3)由⑤原子跟②原子以1 : 1相互交替结合而形成的晶体,其晶型与②对应的一种晶体相同。两者相比熔点更高的是 (填中文名称), 原因是: 。 (4)现有含钛的两种颜色的晶体,Ti3+的配位数均为6,一种为紫色,一种为绿色,相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验: a.分别取等质量的两种配合物晶体的样品配成待测溶液; b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀; c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的。 试推断紫色晶体的化学式为 。 (3分) 4.【化学—物质结构与性质】(13分) CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知: ①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得: 2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42- 2CuCl+SnCl2=2CuCl↓+SnCl4 ②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺 的简写): 请回答下列问题: (1)配离子[Cu(En)2]2+的中心原子基态外围电子排布式为 ,H、N、O 三种元素的电负性由大到小的顺序是 ; (2)SO2分子的空间构型为 ; (3)乙二胺分子中氮原子轨道的杂化类型为 ,乙二胺和三甲胺[N(CH3)3] 均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 。 (4)配离子[Cu(En)2]2+的配位数为 ,该微粒含有的微粒 间的作用力类型有 (填字母); A.配位键 B.极性键 C.离子键 D.非极性键 E.氢键 F.金属键 (5)CuCl的晶胞结构如右图所示,其中Cl-的配位数(即与Cl- 最近距离的Cu+的个数)为 。 5. B原子 P原子 磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr。 回答下列问题: (1)写出基态磷原子的电子排布式 (2)磷化硼的晶体类型是 ,B原子的杂化方式是 。 (3)电负性:N B (填“>”、“<”) (4)BP中每个B或P原子均形成4个共价键,其中有一个配位键,提供空轨道是 原子。 (5)BBr3分子中,B原子采取sp2杂化,则BBr3属于 (填“极性”或“非极性”)分子 (6)氮化硼晶体的熔点要比磷化硼晶体高,其原因是 。 6.[化学——物质结构号性质](13分) 氯化铍是用于制有机铍化合物和金属铍的重要原料。 (1)Be原子的基态价电子排布式为 ,其元素的第一电离能 B元素(填“>”或“<” 或“=”), 原因是 。 (2)已知BeCl2加热易升华,液态BeCl2不导电,则BeCl2晶体类型为 ; BeCl2中Be原子的杂化轨道类型是 。 (3)Kraus用阴离子树脂交换法提取一种组成元素为氯和铍的阴离子,该阴离子内铍原子最外层达到8电子稳定结构,则该阴离子内存在的微粒间的作用力是 ,阴离子的结构式为 。 7.[化学—物质结构与性质](13分) 第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物。 (1)①H、C、N、O四种元素的电负性由小到大的顺序为 。 ②下列叙述不正确的是 。(填字母) A.因为HCHO与水分子间能形成氢键,所以CH2O易溶于水 B.HCHO 和CO2分子中的中心原子均采用sp2杂化 C.C6H6分子中含有6个键和1个大键,C2H2是非极性分子 D.CO2晶体的熔点、沸点都比二氧化硅晶体的低 ③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 。 (2) Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。 ①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 ②六氰合亚铁离子[Fe(CN)6]4-中不存在__________。 a、共价键 b、非极性键 c、配位键 d、σ键 e、π键 并写出一种与 CN_ 互为等电子体的单质分子式______________________。 ③三氯化铁常温下为固体,熔点,沸点,在 :以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为___________。 (3)①Ti的在周期表中位置______________ 。 根据元素原子的外电子排布的特征,可将元素周期表分成五个区域,其中Ti属于 区。 ②Ti的一种氧化物X,其晶胞结构如上图所示,则X的化学式为 。工业上利用X和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐),制备M的化学反应方程式是________________________________________; 8.[化学-物质结构与性质](13分) 空气质量高低直接影响着人类的生产和生活,它越来越受到人们的关注。被污染的空气中杂质的成分有多种,其中计入《空气质量日报》空气污染指数的项目有SO2、CO、NO2、O3和可吸入颗粒物等。 请回答下列问题: (1)S、N、O的的第一电离能由大到小的顺序为 。 (2)SO2、CO、NO2、O3常温下均为气体,固态时均属于 晶体。 (3)随着人们生活质量的提高,室内的环境安全和食品安全越来越为人们所关注。甲醛(HCHO)是室内主要空气污染物之一(其沸点是–19.5 ℃),甲醇(CH3OH)是“假酒”中的主要有害物质(其沸点是64.65 ℃)。甲醛分子中C原子采取 杂化轨道方式。甲醇的沸点明显高于甲醛的主要原因是: 。 (4)CuCl的盐酸溶液能够与CO发生反应:CuCl+CO+H2O=Cu(CO)Cl·H2O,该反应可用于测定空气中CO含量。 ①写出铜原子的基态电子排布式 。 ②CuCl的晶体结构如下图甲所示,与同一个Cl-距离最近的相邻Cu+有 个。 ③Cu(CO)Cl·H2O的结构如上图乙所示,图中标示出8个共价键,其中6个是配位键,请在图中用箭头标示出。 9.(化学-物质结构与性质,13分) 决定物质性质的重要因素是物质结构。请回答下列问题。 (1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示: 电离能/kJ·mol-1 I1 I2 I3 I4 A 578 1817 2745 11578 B 738 1451 7733 10540 A通常显 价,A的电负性 B的电负性(填“>”、“<”或“=”)。 (2)已知:波长为300nm的紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因 。 (3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如右图所示),其中3种离子晶体的晶格能数据如下表: 离子晶体 NaCl KCl CaO 晶格能/kJ·mol-1 786 715 3401 离子键的强弱可以用离子晶体的晶格能来衡量。KCl、MgO、CaO、TiN四种离子晶体熔点从高到低的顺序是 。MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。 (4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。 (5)某配合物的分子结构如下图所示,其分子内不含有 填标号)。 A.离子键 B.共价键 C.金属键 D.配位键 E.氢键 10.W、X、Y、Z4种元素原子序数依次减小。W的原子序数为24;X原子p轨道共有11个电子;Y是第三周期主族元素,其部分电离能(I)如下表;Z原子价电子排布式为。请回答下列问题: 电离能/kJ·mol-1 Y 584 1823 2751 11584 14837 (1)W基态原子的电子排步式为 。 (2)点负性:X Y(填“>”、“=”或“<”)。 (3)R是与X同主族的短周期元素。R的氢化物沸点比X的氢化物更高,原因是 。 (4)氨为常见化工原料,氨分子中N原子采用 杂化,该分子的空间构型为 ,分子中N、H原子之间形成 (填“”或“”)键;已知能与氨分子形成配离子,该配离子中存在的化学键有 。(填标号) A.金属键 B.离子键 C.共价键 D.配位键 11.已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示) (1)A、B、C的第一电离能由小到大的顺序为 。 (2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。 (3)写出化合物AC2的结构式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。 (4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。 (5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。 答案 1.(13分,每空2分) A:H B:Li C:C D:N E:O F:Cl G:Co (1)3d74s2 (1分) (2)三角锥型 极性 (3)d (4)2 (5)[ CoCl(NH3)5]Cl2 (6)LiC6 2.(13分) (1)sp3 正四面体 (各2分,共4分) (2)1s22s22p6 (2分) (3)P查看更多