2020届一轮复习人教通用版第21讲化学平衡状态和平衡移动作业
练案[21] 第七章 化学反应速率与化学平衡
第21讲 化学平衡状态和平衡移动
A组 基础必做题
1.(2019·济南模拟)在温度和容积不变的条件下,发生反应:3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g),能表明反应达到平衡状态的叙述是( B )
A.容器内压强不再变化
B.Fe3O4的物质的量不变
C.v(H2O)=v(H2)
D.断裂4 mol H—O键的同时,断裂4 mol H—H键
[解析] A.反应前后气体系数之和相等,因此压强不变,不能说明反应达到平衡,故错误;B.物质的量不变,说明反应达到平衡,故正确;C.不同物质的反应速率,表示达到平衡,要求反应方向是一正一逆,且反应速率之比等于化学计量数之比,题目中没有指明反应进行的方向,故错误;D.1 mol水中含有2 mol H—O,因此应是断裂8 mol H—O键的同时有4 mol H—H键断裂,故错误。
2.(2019·试题调研)一定条件下反应2AB(g)A2(g)+B2(g)达到平衡状态的标志是( A )
A.单位时间内生成n mol A2,同时生成2n mol AB
B.容器内,3种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中的总压强不随时间变化而变化
[解析] A.单位时间内生成n mol A2等效于单位时间内生成n mol B2同时消耗2n mol AB,正逆反应速率相等,故A正确;B.容器内,AB、A2、B2三种气体共存,只要反应发生一直共存,故B错误;C.AB的消耗速率等于A2的消耗速率,速率之比不等于计量数之比,故C错误;D.容器的体积不变,混合气体的总物质的量不变,则容器内压强始终不变,无法说明达平衡状态,故D错误。
3.(2019·沧州模拟)一定温度下,在恒容密闭容器中发生反应2HI(g)+Cl2(g)2HCl(g)+I2(s)。下列事实不能说明该反应达到平衡状态的是( D )
A.容器内气体压强不再改变
B.容器内气体密度不再改变
C.容器内气体颜色不再改变
D.断裂1 mol Cl—Cl键同时断裂1 mol H—Cl键
[解析] 在恒容密闭容器中发生反应2Hl(g)+Cl2(g)2HCl(g)+I2(s)
,根据化学方程式,反应过程中压强为变量,压强不再改变一定平衡,故可以说明;在恒容密闭容器中发生反应2HI(g)+Cl2(g)2HCl(g)+I2(s),反应过程中气体质量为变量,所以密度是变量,容器内气体密度不再改变一定平衡。故可以说明;容器内气体颜色不再改变,说明氯气的浓度不变,一定达到平衡状态,故可以说明;平衡时断裂1 mol Cl—Cl键同时断裂2 mol H—Cl键,故D不能说明。
4.(2019·大庆模拟)一定量的混合气体在密闭容器中发生如下反应:xA(g)+yB(g)zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,保持温度不变,将密闭容器的容积压缩为原来的一半再次达到平衡后,测得A浓度为0.8 mol·L-1,则下列叙述正确的是( A )
A.平衡向正反应方向移动 B.x+y
z,选项B错误;C.平衡向正反应方向移动,B的转化率增大,但容器体积减小,B的物质的量浓度增大,选项C错误;D.平衡向正反应移动,增大压强平衡向气体物质的量减小的方向移动,气体的物质的量减小,C物质的量增大,故C的体积分数增大,选项D错误。
5.(2019·山东潍坊检测)下列事实不能用勒夏特列原理来解释的是( B )
A.用排饱和食盐水的方法收集氯气
B.合成氨工业选择高温(合成氨反应为放热反应)
C.增大压强,有利于SO2和O2反应生成SO3
D.在Fe3++3SCN-Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
[解析] Cl2+H2OCl-+H++HClO,用饱和食盐水,增加c(Cl-),平衡向逆反应方向移动,抑制氯气的溶解和反应,符合勒夏特列原理,故A不符合题意;N2+3H22NH3,此反应是放热反应,高温向逆反应方向进行,不利于合成氨,不符合勒夏特列原理,故B符合题意;2SO2+O22SO3,增大压强,平衡向正反应方向移动,有利于SO3的生成,符合勒夏特列原理,故C不符合题意;增加SCN-,增大反应物的浓度,促使反应向正反应方向移动,Fe(SCN)3为血红色溶液,颜色加深,符合勒夏特列原理,故D不符合题意。
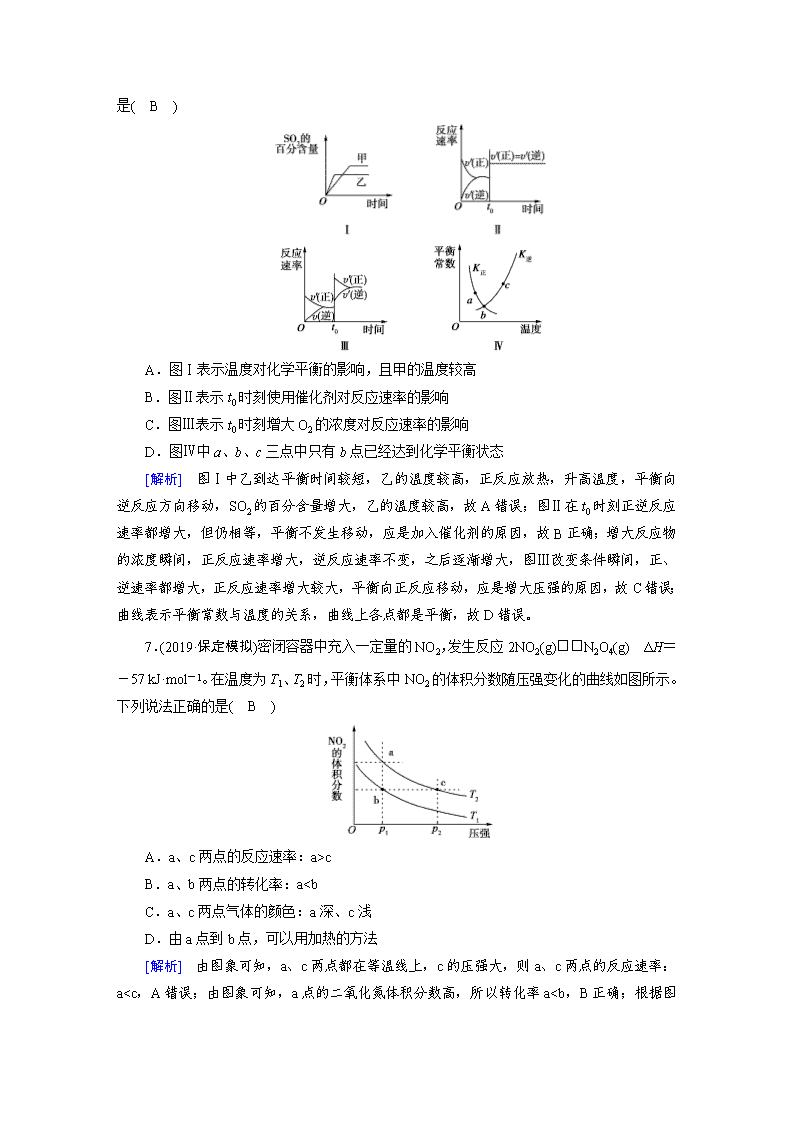
6.(2019·青岛模拟)在容积不变的密闭容器中进行反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,
其中分析正确的是( B )
A.图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B.图Ⅱ表示t0时刻使用催化剂对反应速率的影响
C.图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态
[解析] 图Ⅰ中乙到达平衡时间较短,乙的温度较高,正反应放热,升高温度,平衡向逆反应方向移动,SO2的百分含量增大,乙的温度较高,故A错误;图Ⅱ在t0时刻正逆反应速率都增大,但仍相等,平衡不发生移动,应是加入催化剂的原因,故B正确;增大反应物的浓度瞬间,正反应速率增大,逆反应速率不变,之后逐渐增大,图Ⅲ改变条件瞬间,正、逆速率都增大,正反应速率增大较大,平衡向正反应移动,应是增大压强的原因,故C错误;曲线表示平衡常数与温度的关系,曲线上各点都是平衡,故D错误。
7.(2019·保定模拟)密闭容器中充入一定量的NO2,发生反应2NO2(g)N2O4(g) ΔH=-57 kJ·mol-1。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( B )
A.a、c两点的反应速率:a>c
B.a、b两点的转化率:a0达到平衡后,恒压升高温度过程中,CH3OCH3的转化率变化趋势
[解析] 反应达到平衡后,减小NH3的浓度,平衡正向移动,v正>v逆,且开始减小NH3浓度的瞬间,v正保持不变,v逆减小,图像与题意不符,A项错误;FeCl3溶液与KSCN溶液发生可逆反应:Fe3+(aq)+3SCN-(aq)Fe(SCN)3(aq),K+和Cl-均不是可逆反应的反应物或产物,加入固体KCl,忽略溶液体积变化,平衡不移动,溶液中Fe3+的浓度不变化,图像与题意不符,B项错误;HA为弱酸,HB为强酸,弱酸部分电离,强酸完全电离,起始时,HA溶液、HB溶液的pH相同,c(H+)相等,说明HA溶液的物质的量浓度大于HB溶液,在稀释过程中,未电离的HA继续电离出H+,HA溶液pH的变化幅度小于HB溶液,图像与题意不符,C项错误;该可逆反应的正反应是吸热反应,恒定压强,升高温度,平衡正向移动,CH3OCH3的转化率增大,图像与题意相符,D项正确。
11.(2019·福建漳州模拟)NH3和纯净的O2在一定条件下发生反应:4NH3(g)+3O2(g)2N2(g)+6H2O(g),现向一容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2,4 min后,测得生成的H2O占混合气体体积的40%,则下列表示此段时间内该反应的平均速率不正确的是( C )
A.v(N2)=0.125 mol·L-1·min-1 B.v(H2O)=0.375 mol·L-1·min-1
C.v(O2)=0.225 mol·L-1·min-1 D.v(NH3)=0.250 mol·L-1·min-1
[解析] 设4 min时,生成H2O(g)的物质的量为6x
4NH3(g)+ 3O2(g) 2N2(g)+ 6H2O(g) n(总)
起始/mol 4 3 0 0 7
变化/mol 4x 3x 2x 6x
4 min/mol 4-4x 3-3x 2x 6x 7+x
根据题意,=0.4解得:x=0.5 mol,
则4 min内H2O的变化浓度为:Δc(H2O)==1.5 mol·L-1,v(H2O)==0.375 mol·L-1·min-1,再依据用各物质表示的速率之比等于各物质的化学计量数之比,可得用各物质表示的反应速率分别为v(N2)=0.125 mol·L-1·min-1,v(NH3)=0.250 mol·L-1·min-1,v(O2)=0.1875 mol·L-1·min-1,C项符合题目要求。
12.(2019·山西大同模拟)可逆反应2NO2(g)2NO(g)+O2(g),在容积固定的密闭容器中达到平衡状态的标志是( A )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦
C.①③④⑤ D.①②③④⑤⑥⑦
[解析] ①中单位时间内生成n mol O2的同时生成2n mol NO2,能说明反应达到平衡;②单位时间内生成n mol O2必生成2n mol NO,不能说明反应达到平衡状态;③中无论达到平衡与否,用各物质表示的化学反应速率之比都等于化学计量数之比;④混合气体的颜色不变,则表示有色物质的浓度不再变化,说明反应已达到平衡;⑤容器容积固定且气体质量守恒,故密度始终不变;⑥反应前后气体物质的量不相等,恒容容器中压强不变,说明各物质的物质的量不再变化;⑦由于气体的质量不变,气体的平均相对分子质量不变时,说明气体中各物质的物质的量不变,反应达到平衡。
[点拨] 变量不变可以说明反应达到平衡状态,不变量恒定不能说明反应达到平衡状态。
13.(2019·湖北华中师大附中期中)现有下列四个图像:
下列反应中全部符合上述图像的反应是( B )
A.图甲:N2(g)+3H2(g)2NH3(g) ΔH1<0
B.图乙:2SO3(g)2SO2(g)+O2(g) ΔH2>0
C.图丙:4NH3(g)+5O2(g)4NO+6H2O(g) ΔH3<0
D.图丁:H2(g)+CO(g)C(s)+H2O(g) ΔH4>0
[解析] 由图像甲可知,升高温度,生成物含量增大,平衡正向移动,ΔH>0;相同温度时,增大压强,生成物含量减小,平衡逆向移动,正反应为气体体积增大的反应,A错误。由图像乙可知,升温,生成物含量增大,平衡正向移动,ΔH>0,B正确。由图像丙可知,增大压强,变大,n总变小;升温,变小,n总变大,C错误。由图像丁可知,增大压强,v逆>v正,平衡逆向移动,正反应为气体体积增大的反应,D错误。
14.(2019·安徽师大附中联考)t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)2Z(g),各组分在不同时刻的浓度如表:
物质
X
Y
Z
初始浓度/(mol·L-1)
0.1
0.2
0
2 min末浓度/(mol·L-1)
0.08
a
b
平衡浓度/(mol·L-1)
0.05
0.05
0.1
下列说法正确的是( D )
A.平衡时,X的转化率为20%
B.t℃时,该反应的平衡常数为40
C.增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动
D.前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol·L-1·min-1
[解析] 平衡时,X的转化率为×100%=50%,A错误;t℃时,该反应的平衡常数K===1600,B错误;由于该反应的正反应是气体体积减小的反应,所以增大平衡后的体系压强,v正增大,v逆增大,平衡向正反应方向移动,C错误;前2 min内,v(X)==0.01 mol·L-1·min-1,v(Y)=3v(X)=0.03 mol·L-1·min-1,D正确。
15.(2019·安徽黄山八校联考)(1)一定条件下,将2 mol SO2与1 mol O2置于恒容密闭容器中发生反应2SO2(g)+O2(g)2SO3(g),下列状态能说明该反应达到化学平衡的是__B___(填序号)。
A.混合气体的密度保持不变
B.SO2的转化率保持不变
C.SO2和O2的物质的量之比保持不变
D.O2的消耗速率和SO3的消耗速率相等
(2)已知反应2NO(g)N2(g)+O2(g) ΔH<0,在不同条件时N2的体积分数随时间(t)的变化如图所示。根据图像可以判断曲线R1、R2对应的下列反应条件中不同的是__B___(填序号)。
A.压强 B.温度
C.催化剂
(3)CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g)CH3OH(g) ΔH<0。现在体积为1 L的恒容密闭容器(如图甲所示)中通入1 mol CO和2 mol H2,测定不同时间、不同温度(T/℃)下容器中CO的物质的量,如下表:
0 min
10 min
20 min
30 min
40 min
T1
1 mol
0.8 mol
0.62 mol
0.4 mol
0.4 mol
T2
1 mol
0.7 mol
0.5 mol
a
a
请回答:
①T1__<___(填“>”或“<”或“=”)T2,理由是__相同时间内,T2℃时CO的变化量大于T1℃时CO的变化量___。
已知T2℃时,第20 min时容器内压强不再改变,此时H2的转化率为__50%___,该温度下的化学平衡常数为__1.0___。
②若将1 mol CO和2 mol H2通入原体积为1 L的恒压密闭容器(如图乙所示)中,在T2℃下达到平衡,此时反应的平衡常数为__1.0___;若再向容器中通入1 mol CH3OH(g),重新达到平衡后,CH3OH(g)在体系中的百分含量__不变___(填“变大”或“变小”或“不变”)。
[解析] (1)SO2、O2和SO3都是气体,恒容反应时混合气体的密度始终不变,A错误。反应正向进行,SO2的转化率增大,反应逆向进行,SO2的转化率减小,故SO2的转化率保持不变,该反应达到平衡状态,B正确。起始加入SO2和O2的物质的量之比为2∶1,与其化学计量数之比相等,则二者的物质的量之比始终等于2∶1,C错误。O2的消耗速率与SO3的消耗速率之比为1∶2,该反应达到平衡状态,D错误。
(2)由图可知,曲线R2代表的反应比曲线R1代表的反应先达到平衡状态。A项,若R表示压强,改变压强,平衡不移动,N2
的体积分数不变,与图像不符合。B项,若R表示温度,该反应的ΔH<0,升高温度,平衡逆向移动,N2的体积分数减小,与图像符合。C项,若R表示催化剂,使用催化剂,只能改变反应速率,但平衡不移动,N2的体积分数不变,与图像不符合。
(3)①由表中数据可知,未达到平衡之前,相同时间内,T2℃时CO的变化量大于T1℃时,则T2℃时化学反应速率快,而温度越高,反应速率越快,故有T1
查看更多