- 2021-04-13 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】山东省济宁市泗水县2019-2020学年高一上学期期中考试试题
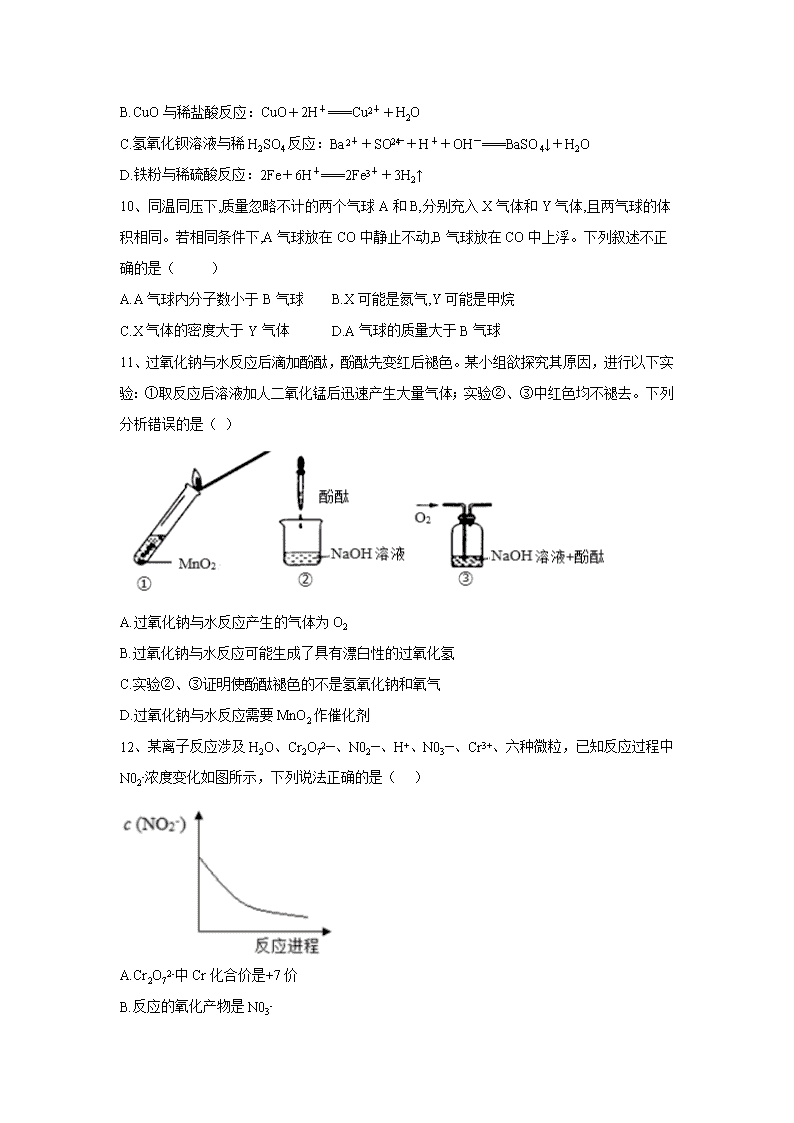
山东省济宁市泗水县2019-2020学年高一上学期期中考试试题 说明: 1、本试题分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷48分,第Ⅱ卷52分,共100分,考试时间90分钟。 2、请考生将第Ⅰ卷选择题的正确选项用2B铅笔涂写在答题卡上,第Ⅱ卷的答案用黑色的中性笔填写在答题卡的制定位置上。 可能用到的相对原子质量:H-1 He-4 C-12 N-14 O-16 Ne-20 Na-23 Mg-24 Al-27 P-31 S-32 Cl-35.5 Ar-40 K-39 Ca-40 Fe-56 Cu-64 第Ⅰ卷 选择题(共48分) 一、选择题 (本题包括16小题,每小题3分,共48分,每小题只有一个选项符合题意) 1、分类方法在化学学科的发展中起到了非常重要的作用,下列5种分类标准中合理的有( ) ①根据分散系是否具有丁达尔现象,将分散系分为溶液、胶体和浊液 ②根据反应中是否有电子的转移,将化学反应分为氧化还原反应和非氧化还原反应 ③根据酸分子能电离出的氢离子个数将酸分为一元酸、二元酸等 ④根据氧化物中是否含有金属元素,将氧化物分为酸性氧化物和碱性氧化物 ⑤根据物质在水溶液里或熔融状态下能否导电,将化合物分为电解质和非电解质 A.5种 B.4种 C.3种 D.2种 2、下列说法不正确的是:( ) A.配制一定物质的量浓度的溶液时,容量瓶是否干燥对配制结果无影响 B.在进行钠与水反应的实验时,多余的钠需要放回原试剂瓶中 C.丁达尔效应是由于胶体粒子对光的散射形成的 D.已知钠与水反应比钠与乙醇反应更剧烈,所以两种电解质的活泼性:水大于乙醇 3、下列关于钠及其化合物的叙述错误的是 ( ) A.取用金属钠时,所需用品一般有小刀、镊子、滤纸、玻璃片 B.金属钠与Ca(HCO3)2溶液反应时,既有白色沉淀又有气体逸出 C.生理盐水的质量分数为0.9%,与人体的血液中含量相同,它的溶质是NaCl D.Na2O2与酸反应生成盐和水,所以Na2O2是碱性氧化物 4、在新制氯水中存在多种分子和离子,下列实验现象和结论一致且正确的是( ) A.溶液呈黄绿色,且有刺激性气味,说明有Cl2存在 B.加入有色布条,有色布条褪色,说明有Cl2存在 C.加入盐酸酸化的AgNO3溶液,产生白色沉淀,说明有Cl–存在 D.加入NaOH溶液,氯水黄绿色消失,说明有HClO存在 5、磁流体是一种新型的功能材料,它既具有液体的流动性又具有固体磁性材料的磁性。在一定条件下,将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的NaOH溶液,可得到分散质粒子大小在36~55nm之间的黑色磁流体。下列说法中正确的是( ) A.所得的分散系属于悬浊液 B.所得的分散系中分散质为Fe2O3 C.用光束照射该分散系能产生丁达尔效应 D.分散系为胶体,分散质粒子大小即Fe(OH)3分子直径 6、 2018年11月13日第26届国际计量大会对国际单位制进行修改。新的摩尔规定,1摩尔物质包括阿伏伽德罗常数(NA)个基本单元,下列关于阿伏加德罗常数的说法正确的是( ) A.18 g水中含有的氢原子数目为NA B.1 mol氩气分子所含的原子数目为2NA C.53 g碳酸钠中含有的钠离子数为0.5NA D.0.5 mol硝酸中含有的氧原子数为1.5NA 7、下列说法中错误的是( ) A.从1L1mol·L-1的NaCl溶液中取出10mL,其浓度仍是1mol·L-1 B. 10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% C.0.5L 2mol·L-1BaCl2溶液中,Ba2+和Cl-总数为1.806×1024 D.制备0.5L 10mol·L-1的盐酸,需要氯化氢气体112L(标准状况) 8、实验室配制500 mL 0.2 mol·L-1的Na2CO3溶液,下列说法错误的是( ) A.称量时,若将Na2CO3固体置于托盘天平右盘,将导致所配溶液浓度偏小 B.将Na2CO3固体置于烧杯中溶解,冷却后转移到容量瓶中 C.定容摇匀后发现液面低于刻度线,应再滴加蒸馏水至刻度线 D.将配制好的Na2CO3溶液转移至带橡胶塞的试剂瓶中 9、 下列反应的离子方程式书写正确的是( ) A.往碳酸镁中滴加稀盐酸:CO+2H+===H2O+CO2↑ B.CuO与稀盐酸反应:CuO+2H+===Cu2++H2O C.氢氧化钡溶液与稀H2SO4反应:Ba2++SO+H++OH-===BaSO4↓+H2O D.铁粉与稀硫酸反应:2Fe+6H+===2Fe3++3H2↑ 10、同温同压下,质量忽略不计的两个气球A和B,分别充入X气体和Y气体,且两气球的体积相同。若相同条件下,A气球放在CO中静止不动,B气球放在CO中上浮。下列叙述不正确的是( ) A.A气球内分子数小于B气球 B.X可能是氮气,Y可能是甲烷 C.X气体的密度大于Y气体 D.A气球的质量大于B气球 11、过氧化钠与水反应后滴加酚酞,酚酞先变红后褪色。某小组欲探究其原因,进行以下实验:①取反应后溶液加人二氧化锰后迅速产生大量气体;实验②、③中红色均不褪去。下列分析错误的是( ) A.过氧化钠与水反应产生的气体为O2 B.过氧化钠与水反应可能生成了具有漂白性的过氧化氢 C.实验②、③证明使酚酞褪色的不是氢氧化钠和氧气 D.过氧化钠与水反应需要MnO2作催化剂 12、某离子反应涉及H2O、Cr2O72—、N02—、H+、N03—、Cr3+、六种微粒,已知反应过程中N02-浓度变化如图所示,下列说法正确的是( ) A.Cr2O72-中Cr化合价是+7价 B.反应的氧化产物是N03- C.消耗1mol氧化剂,转移电子3mol D.随着反应的进行,溶液中的H+浓度增大 13、欲配制下列四种无色透明的酸性溶液,其中能配制成功的是( ) A.K+、Mg2+、Cl-、CO32- B.Ca2+、NO3-、Na+、CO32- C.MnO4-、K+、SO42-、Na+ D.NH4+、NO3-、Cl-、Al3+ 14、某溶液中含有较大量的Cl-、CO32-、OH- 3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序中,正确的是( ) ①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液 A.④②①②③ B.①②④②③ C.①②③②④ D.④②③②① 15、某溶液中仅含有H+、Al3+、Cl-、SO42-四种离子,其中H+的浓度为0.5 mol·L-1, Cl-的浓度为0.2 mol·L-1,Al3+的浓度为0.1 mol·L-1,则SO42-的浓度是( ) A.0.15 mol·L-1 B.0.25 mol·L-1 C.0.3 mol·L-1 D.0.4 mol·L-1 16、在焊接铜器时可用NH4Cl溶液除去铜器表面的氧化铜以便焊接,其反应为:CuO+NH4Cl → Cu+CuCl2+N2↑+H2O(未配平)。下列说法正确的是( ) A.反应中被氧化和被还原的元素分别为Cu和N B.该反应中被还原的CuO占参与反应CuO的 C.反应中产生0.2 mol气体时,转移0.6 mol电子 D.反应中氧化剂和还原剂的物质的量之比为3∶2 第Ⅱ卷 非选择题(共52分) 二、非选择题(本题包括5小题,共52分) 17.(12分)下图中,反应①为常温下的反应,A、C、D中均含有氯元素,且A中氯元素的化合价介于C和D中氯元素的化合价之间,E在常温下为无色无味的液体,F是淡黄色固体,G为常见的无色气体。请据图回答下列问题: (1) G 、A的化学式分别为___ _____、____ ____。 (2)写出反应①的化学方程式:__________________________________________ __。 (3)写出反应②的化学方程式:________________________。 (4)已知A是一种重要的化工原料,在工农业生产和生活中有着重要的应用。请根据所学知识回答下列问题。 ①将A通入紫色石蕊溶液中,观察到的现象是________________________。请写出A与水反应的化学方程式:_________________________。 ②A可以制漂白粉,漂白粉在空气时间长了会失效,失效的原因是 _______________________________________(用化学方程式表示)。 18.(8分)碳酸钠俗称纯碱,是重要的化工原料,在医药、冶金、化工、食品等领域被广泛使用。某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如图1 已知:几种盐的溶解度 NaCl 溶解度时) 36.0 21.7 9.6 37.2 (1)①写出装置Ⅰ中反应的化学方程式 。②操作①的名称是 。 (2)写出装置II中发生反应的化学方程式 。 (3) 该流程中可循环利用的物质是 。 检验用该纯碱配制的溶液中含有Cl-的方法是 。 19.(14分)“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“洁霸”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO、1000 mL、密度 1.192 g·cm−3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题: (1)该“84消毒液”的物质的量浓度为________mol·L−1。 (2)该同学取100 mL“洁霸”牌“84消毒液”稀释后用于消毒(假设稀释后溶液密度为1 g·cm−3 ),稀释后的溶液中c(Na+)=________mol·L−1。 (3)一瓶“洁霸”牌“84消毒液”能吸收空气中________L的CO2(标准状况)而变质。(已知:CO2+2NaClO+H2O=Na2CO3+2HClO) (4)该同学参阅“洁霸”牌“84消毒液”的配方,欲用NaClO固体配制480 mL、0.2 mol·L−1 NaClO的消毒液。 ①需要的玻璃仪器_______________________。 ②利用购买的商品NaClO来配制可能导致结果_______(填“偏大,偏小,无影响”)。 ③需要称量的NaClO固体质量为____________克。 20.(12分)Na2O2具有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能发生反应。为了验证此推测结果,该同学设计并进行了如图所示实验。 Ⅰ.实验探究 (1)图A是制取氢气的装置,从图中所给仪器中选择一部分组装成一套能随开随停的发生装置,选择的仪器是________(填编号)。 (2)装置A中用粗锌和稀盐酸制取氢气,B装置的名称是 ;里面所盛放的试剂是______,其作用是______ _。 (3)下面是实验过程中的重要操作,正确的顺序是________(填序号)。 A.加热至Na2O2逐渐熔化,反应一段时间 B.用小试管收集气体并检验其纯度 C.打开K1、K2,通入氢气 D.停止加热,充分冷却,关闭K1、K2 (4)实验过程中观察到淡黄色粉末慢慢变成白色固体,无水硫酸铜未变蓝色。由此可推出Na2O2与H2反应的化学方程式为____________________。 Ⅱ.数据处理 实验结束后,该同学欲测定C装置硬质玻璃管内白色固体中未反应完的Na2O2含量。其操作流程如下: ①测定过程中需要的仪器除固定、夹持仪器外,还有电子天平、烧杯、酒精灯、蒸发皿和________,操作2的名称是________。 ②在转移溶液时,若溶液转移不完全,则测得的Na2O2质量分数________(填“偏大”“偏小”或“不变”)。 21.(6分) ClO2是一种消毒、杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得: 2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O试回答下列问题。 (1)该反应中氧化产物的化学式是________;被还原的元素是________。 (2)若反应共产生了4.48L气体(标准状况),则反应转移电子的物质的量为________mol,消耗还原剂的物质的量为________mol。 (3)标准状况下44.8mL的ClO2气体恰好能与50mL0.1mol/L的Na2SO3溶液完全反应,生成Na2SO4,氯元素在产物中的化合价为________;此过程说明ClO2具有________(填“氧化”或“还原”)性。 【参考答案】 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 C D D A C D B C B A D B D A C D 17、(1)O2 ; Cl2 (每空各1分) (2)Cl2 + 2NaOH ==== NaCl + NaClO + H2O (2分) (3)2Na2O2 + 2H2O === 4NaOH + O2 ↑ (2分) (4)①紫色试液先变红色,后又褪色 (2分) Cl2+ H2O === HCl + HClO (2分) ② Ca(ClO)2 + CO2 + H2O === CaCO3 + 2HClO (1分) 2HClO 2HCl + O2 ↑ (1分) 18、(1)①NaCl + CO2 + NH3 + H2O === NaHCO3 ↓ + NH4Cl (2分) ②过滤 (1分) (2)2NaHCO3 ==== Na2CO3 + CO2 ↑+ H2O (2分) (3) CO2 NaCl (1分,答错或少答不得分) 向待测液中先加稀硝酸,待无现象后,再滴加硝酸银溶液,若产生白色沉淀,则证明溶液中含有Cl- 。 (2分) 19、(1)4 (2)0.04 (3) 44.8 (每空各2分) (4) ① 500ml容量瓶,烧杯,玻璃棒,胶头滴管 (填对一种得1分,填错不扣分) ② 偏低 ③149 (每空各2分) 20、Ⅰ (1) acde (2分) (2)干燥管 ; 碱石灰 ; 吸收氢气中的水和HCl气体 (每空1分) (3)CBAD (2分) (4)Na2O2 + H2 2NaOH (2分) Ⅱ ① 玻璃棒 ; 蒸发结晶 ② 偏小 (每空1分) 21、(每空1分) (1) CO2 Cl (或“氯”) (2) 0.1 0.05 (3) -1 氧化查看更多