- 2021-04-13 发布 |
- 37.5 KB |
- 19页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
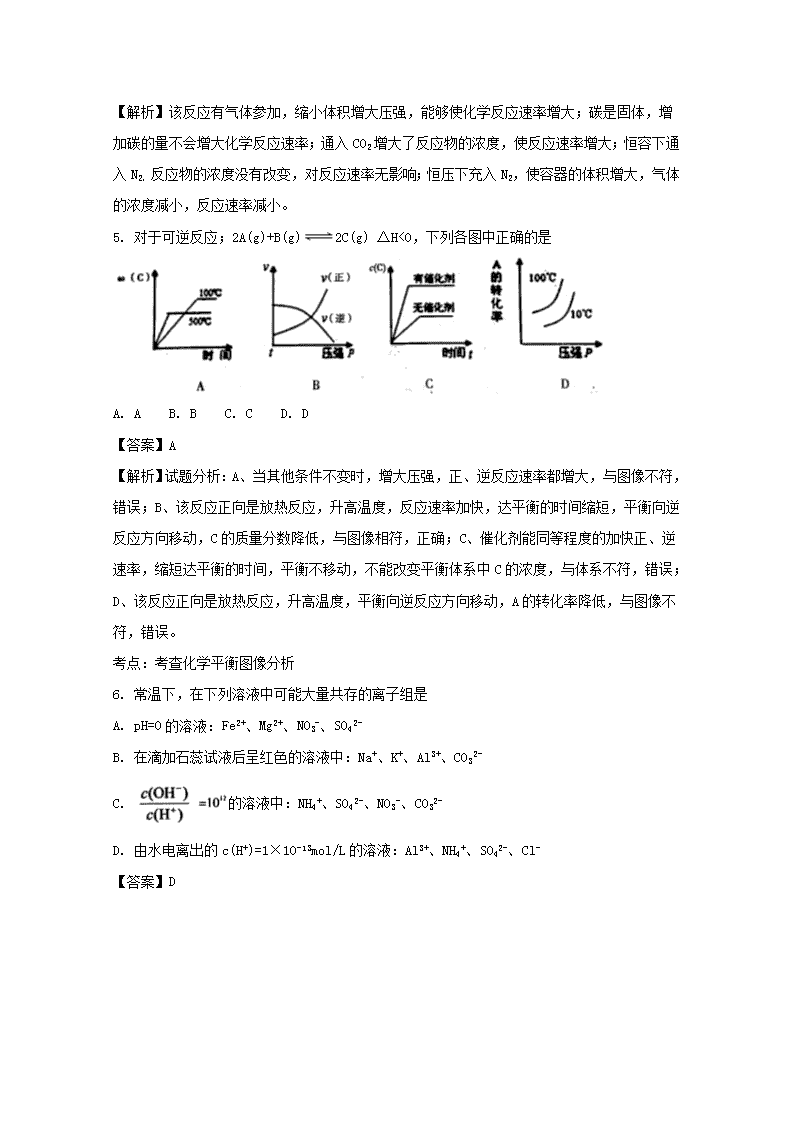
2017-2018学年河南省三门峡市高二上学期期末考试化学试题 解析版
河南省三门峡市2017-2018学年高二上学期期末考试化学试题 可能用到的相对原子质量:H:l C:12 N:14 O:16 Fe:56 S:32 Cu:64 Mn:55 Zn:65 Ni:59 第I卷 一、选择题(本题包含18小题;每题3分,共54分。每小题只有—个选项符合愿意。) 1. 下列说法正确的是 A. CaCO3难溶于水,是弱电解质 B. 明矾水解形成的Al(OH)3胶体能杀菌消毒,可用于水的净化 C. 催化剂能改变化学反应的平衡转化率 D. 反应SO2(g)+2H2S(g)=3S(s)+2H2O(l)在常温下能自发进行,则该反应的△H<0 【答案】D .................. 2. 依据图判断,下列说法不正确的是 A. 1molH2(g)与molO2(g)所具有的总能量比1molH2O(g)所具有的总能量高 B. H2O(g)生成H2O(1)时,断键吸收的能城小于成键放出的能量 C. 2molH(g)与lmnlO(g)生成lmolH2O(g)所放出的热量是bkJ D. 液态水分解的热化学方程式为:2H2O(1)=2 H2(g)+O2(g)AH=2(b+c-a) kJ/mol 【答案】B 【解析】A.氢气的燃烧为放热反应,则反应物总能量大于生成物总能量,A正确;B.H2O(g)生成H2O(l),为物理变化,不存在化学键的断裂和形成,B错误;C.形成化学键放出能量,由图象可知2 mol H(g)与1 mol O(g)生成1 molH2O(g)所放出的热量是b kJ,C正确;D.液态水分解吸收能量,由图象可知液态水分解的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=2(b+c﹣a)kJ•mol﹣1,D正确,答案选B。 点睛:注意掌握反应热的计算方法和依据:(1)根据热化学方程式计算:反应热与反应物各物质的物质的量成正比。(2)根据反应物和生成物的总能量计算:ΔH=E生成物-E反应物。(3)依据反应物化学键断裂与生成物化学键形成过程中的能量变化计算:ΔH=反应物的化学键断裂吸收的能量-生成物的化学键形成释放的能量。(4)根据盖斯定律的计算。 3. 下列关于说法正确的是 A. HCl和NaOH反应的中和热为57.3kJ/mol,H2SO4和Ba(OH)2反应的中和热也为57.3kJ/mol B. 已知C2H5OH(l)的燃烧热是1366.8kUmol,则C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)反应的△H=-1366.8kJ/mol C. 一定温度和压强下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放出热量19.3kJ.则其热化学方程式为N2(g)+3H2(g)2NH3(g) △H=-38.6 kJ/mol D. 一定条件下2SO2(g)+O2(g)2SO3(g)△H1 2SO2(g)+O2(g)2SO3(l)△H2则△H1>△H2 【答案】D 【解析】A项,H2SO4和Ba(OH)2反应,除包括氢离子与氢氧根离子反应生成水外,还包括钡离子与硫酸根离子的反应,所以反应热包括中和反应和硫酸根离子与钡离子反应的反应热,故A错误;B项,已知C2H5OH(l)的燃烧热是1366.8kJ/mol,则C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)反应的△H=-1366.8kJ/mol,故B错误;C项,N2和H2的反应为可逆反应,不能进行完全,所以N2(g)+3H2(g)2NH3(g)的△H≠-38.6kJ/mol,故C错误;D项,等物质的量的SO3(g)比SO3(l)的能量高,所以生成2molSO3(g)时放出的热量少,焓变大,即0>△H1>△H2,故D正确。 4. 在C(s)+CO2(g)2CO(g)的反应中,现采取下列措施: ①缩小体积,增大压强 ②增加碳的量 ③通入CO2,④恒容下充入N2 ⑤恒压下充入N2 其中能够使反应速率增大的措施是 A. ①④ B. ②③⑤ C. ①③ D. ①②④ 【答案】C 【解析】该反应有气体参加,缩小体积增大压强,能够使化学反应速率增大;碳是固体,增加碳的量不会增大化学反应速率;通入CO2增大了反应物的浓度,使反应速率增大;恒容下通入N2,反应物的浓度没有改变,对反应速率无影响;恒压下充入N2,使容器的体积增大,气体的浓度减小,反应速率减小。 5. 对于可逆反应;2A(g)+B(g)2C(g) △H<0,下列各图中正确的是 A. A B. B C. C D. D 【答案】A 【解析】试题分析:A、当其他条件不变时,增大压强,正、逆反应速率都增大,与图像不符,错误;B、该反应正向是放热反应,升高温度,反应速率加快,达平衡的时间缩短,平衡向逆反应方向移动,C的质量分数降低,与图像相符,正确;C、催化剂能同等程度的加快正、逆速率,缩短达平衡的时间,平衡不移动,不能改变平衡体系中C的浓度,与体系不符,错误;D、该反应正向是放热反应,升高温度,平衡向逆反应方向移动,A的转化率降低,与图像不符,错误。 考点:考查化学平衡图像分析 6. 常温下,在下列溶液中可能大量共存的离子组是 A. pH=0的溶液:Fe2+、Mg2+、NO3-、SO42- B. 在滴加石蕊试液后呈红色的溶液中:Na+、K+、Al3+、CO32- C. 的溶液中:NH4+、SO42-、NO3-、CO32- D. 由水电离出的c(H+)=1×10-13mol/L的溶液:Al3+、NH4+、SO42-、Cl- 【答案】D 点睛:本题考查离子共存问题,掌握常见离子的性质,明确离子之间发生的反应是解题关键,解决此类题目时主要考虑复分解反应、氧化还原反应、络合反应、双水解反应等,本题特别要注意题目的隐含条件,例如本题中四个选项都隐含着对溶液酸碱性的限制条件,A项隐含着氢离子,则涉及氧化还原反应,容易出错;D项应从影响水电离的因素考虑溶液的酸碱性。 7. 设NA为阿伏加德罗常数的值.下列说法不正确的是 A. 1molCl2通入水中,HClO、Cl-、ClO-粒子数之和等于2NA B. 9.2gNO2和N2O4的混合物中含氮原子数目为0.2NA C. 含0.1molNH4HSO4的溶液中,阳离子数目略大于0.2NA D. 某密闭容器中有2molSO2和1molO2,在一定条件下充分反应,转移的电子数小于4NA 【答案】A 【解析】A项,1molCl2含有2molCl,通入水中所得含氯粒子有Cl2、HClO、Cl-、ClO-,所以HClO、Cl-、ClO-粒子数之和小于2NA,故A错误;B项,NO2和N2O4的最简式相同,9.2gNO2和N2O4的混合物中含氮原子数目等于9.2gNO2中所含氮原子数目,即为:9.2g÷46g/mol×1×NA=0.2NA,故B正确;C项,含0.1molNH4HSO4的溶液中,SO42-的物质的量为0.1mol,根据电荷守恒:n(NH4+)+n(H+)=n(OH-)+2n(SO42-),溶液中的阳离子的物质的量略大于0.2mol,即阳离子数目略大于0.2NA,故C正确;D项,SO2和O2的反应为可逆反应,0.2molSO2和0.1molO2在一定条件下充分反应,生成三氧化硫的物质的量小于0.2mol,所以转移的电子小于0.4mol,转移的电子数小于0.4NA,故D正确。 点睛:NA的有关问题是考试的热点,由于它和物质的量、物质的质量、气体的体积等多个物理量联系,并且可以涉及氧化还原反应、离子反应、水溶液、物质构成等重要知识,历来都受到命题人的关注。解决有关NA计算型题目,要特别注意题目的陷阱,例如A项中1molCl2通入水中并不会与水全部反应;B项中NO2和N2O4 的最简式相同,无论怎么混合,只要质量一定含氮原子数目就确定;D项要注意可逆反应不能进行完全。 8. 下列有关实验的说法正确的是 A. 图A中测定锌粒与1mol/L稀硫酸的反应速率,只需测定注射器中收集氢气的体积 B. 图B装置中进行50mL0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液发生中和反应放出热量的测定,使温度计温度升高的热量就是中和反应生成1mol水的热量 C. 图C酸碱中和滴定中,可以在滴定过程中用少量水冲洗锥形瓶内壁 D. 图D滴定管中液面位置如图所示,则此时的读数为26.50mL 【答案】C 【解析】A项,若只测定注射器中收集氢气的体积,不知道时间,无法计算反应速率,故A错误;B项,50mL0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液发生中和反应生成0.025mol水,使温度计升高到最高温度的热量就是该中和反应生成0.025mol水的热量,故B错误;C项,用少量水冲洗锥形瓶内壁不影响溶质的物质的量,可以使残留在内壁上的待测液溶质与标准液充分反应减小误差,故C正确;D项,滴定管的0刻度在上方,自下而上刻度逐渐减小,读数应为25.50mL,故D错误。 9. 关于下列装置说法正确的是 A. 装置①中,盐桥(含有琼胶的KCl饱和溶液)中的K+移向ZnSO4溶液 B. 装置②工作一段时间后,a极附近溶液的pH减小 C. 可以用装置③在铁上镀铜,d极为铜 D. 装置④中发生铁的吸氧腐蚀 【答案】C 【解析】A项,装置①为原电池,Zn为负极、Cu为正极,原电池中阳离子向正极移动,所以K+移向CuSO4 溶液,故A错误;B项,装置②为电解池,a极与电源的负极相连是阴极,水中的氢离子放电,产生氢氧根离子,所以工作一段时间后,a极附近溶液的pH增大,故B错误;C项,装置③为电解池,d极与电源的正极相连是阳极,铁上镀铜时,铜为阳极,所以d极为铜,故C正确;D项,Zn比Fe更活泼,构成原电池时,活泼金属Zn是负极,Fe不反应,故D错误。 10. 锌-空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH-+2H2O=2Zn(OH)42-,下列说法正确的是 A. 放电时,负极反应为Zn+4OH--2e-= Zn(OH)42- B. 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况) C. 充电时,电解质溶液中K+向阳极移动 D. 充电时,电解质溶液中c(OH-)逐渐减小 【答案】A 【解析】A项,放电时,Zn为负极发生氧化反应,碱性电解质溶液,所以反应式为:Zn+4OH--2e-=Zn(OH)42-,故A正确;B项,放电时,正极反应为:O2+2H2O+4e-=4OH-,每转移4mol电子,消耗标准状况下22.4L氧气,故B错误;C项,充电时阳离子向阴极移动,故C错误;D项,充电时,电解总反应为:2Zn(OH)42-=2Zn+O2+4OH-+2H2O,电解质溶液中c(OH-)逐渐增大,故D错误。 点睛:本题考查原电池和电解池的工作原理,①注意区分原电池与电解池装置:原电池中存在自发的氧化还原反应,电解池中一般会与电源相连,锌-空气燃料电池放电时作为原电池,充电时作为电解池;②正确判断正负极、阴阳极:作原电池时的正极即为作电解池时的阳极,作原电池时的负极即为作电解池时的阴极;③注意电极反应式的书写及电子转移的计算:书写电极反应式要考虑溶液酸碱性,要根据得失电子守恒进行有关计算;④若已知电池总反应,可根据化合价的变化判断有关反应,遵循氧化还原反应原理。 11. 下列事实不能用勒夏特列原理解释的是 A. 开启啤酒瓶后,瓶中马上泛起大量泡沫 B. 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 C. 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 D. 对于2HI(g)H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 【答案】D 【解析】A项,啤酒瓶中存在平衡H2O+CO2H2CO3 ,打开啤酒瓶时,泛起大量泡沫,是因为压强降低,平衡向生成二氧化碳方向移动,可以用勒夏特列原理解释,故A正确;B项,合成氨反应为放热反应,降低温度平衡正向移动,可提高氨的产率,能用勒夏特列原理解释,故B正确;C项,工业上生产硫酸存在平衡2SO2+O22SO3,使用过量的空气,增大氧气的浓度,平衡正向移动,可以提高二氧化硫的利用率,能用勒夏特列原理解释,故C正确;D项,因为反应2HI(g)H2(g)+I2(g)是气体分子数不变的反应,缩小容器体积,平衡不移动,颜色变深是由体积变小使I2浓度增大引起的,不能用勒夏特利原理解释,故D错误。 点睛:本题考查勒夏特列原理的使用条件,化学平衡移动原理又称勒夏特列原理,使用勒夏特列原理分析问题的前提必须是可逆反应且存在平衡移动,否则不能用勒夏特列原理解释,例如题中A、B、C三项都涉及改变条件时可逆反应的平衡移动问题,而D项改变条件平衡不移动。 12. 已知在100℃的温度下,水的离子积Kw=1×10-12,本题涉及的溶液,其温度均为100℃,下列说法中正确的是 A. 0.001mol/L的硫酸溶液,pH=2 B. 0.001mol/L的氢氧化钠溶液pH=9 C. 0.005mol/L的硫酸溶液与0.01mol/L的氢氧化钠溶液等体积混合,混合溶液的pH为6,溶液显酸性 D. 完全中和pH=3的硫酸溶液50mL,需要pH=11的NaOH溶液50mL 【答案】B 【解析】100℃的温度下,水的离子积KW=1×10-12,所以该温度下中性溶液中pH=6,A项,0.001mol/L的硫酸溶液中,c(H+)=0.001mol/L×2=0.002mol/L=2×10-3mol/L,所以pH=-lgc(H+)=lg(2×10-3)=3-lg2≠2,故A错误;B项,0.001mol/L的氢氧化钠溶液,c(H+)=KW/c(OH-)=mol/L=1×10-9mol/L,所以pH=9,故B正确;C项,0.005mol/L的硫酸溶液与0.01mol/L的氢氧化钠溶液等体积混合,恰好完全反应,混合溶液的pH为6,溶液显中性,故C错误;D项,pH=3的硫酸中,c(H+)=10-3mol/L,pH=11的NaOH溶液中c(OH-)=0.1mol/L,中和pH=3的硫酸溶液50mL,需要pH=11的NaOH溶液0.5mL,故D错误。 点睛:本题考查pH的有关计算,①酸性溶液可根据pH=-lgc(H+)直接计算;②注意碱性溶液中氢氧根离子浓度和pH的换算为易错点,在已知中100℃的温度下,水的离子积KW=1×10-12,所以该温度下的中性溶液中pH=6、pH<6为酸性溶液,pH>6的为碱性溶液;③强酸和强碱恰好反应时,溶液呈中性,pH=6。 13. 在容积为2L的恒容密闭容器中发生反应xA(g)+ yB(g) zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系;则下列结论正确的是 A. 图II所知反应xA(g)+yB(g) zC(g) △H<0,且a=2 B. 200℃时,该反应的平衡常数为25 C. 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol/(L•min) D. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大 【答案】B 【解析】A项,由图II可知:升高温度,平衡时C的体积分数增大,说明升高温度化学平衡向正反应方向移动,又因为升高温度,化学平衡向吸热方向移动,所以正反应为吸热反应,△H>0;根据图Ⅰ数据可知该反应的化学方程式为2A+BC,只有当两种反应物按方程式的计量数之比加入时,达到平衡时生成物C的体积分数才最高,所以a=2,综上分析,A错误。B项,由图Ⅰ可得,200℃,平衡时c(A)=0.4mol÷2L=0.2mol/L,c(B)=c(C)=0.2mol÷2L=0.1mol/L,由前面的分析化学方程式为2A+BC,所以200℃时,该反应的平衡常数为:K==25,故B正确。C项,200℃时,反应从开始到平衡的平均速率v(B)=(0.4-0.2)mol÷2L÷5min=0.02mol/(L•min),故C错误。D项,当外界条件由200℃降温到100℃,平衡常数K一定变化,原平衡一定被破坏,正逆反应速率均减小,故D错误。 14. 25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是 A. NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO32-)+c(OH-) B. 0.1mol/L醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后的溶液中:c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) C. 物质的量浓度相等的①NH4Cl、②(NH4)2SO4、③NH4Al(SO4)2三种溶液中,c(NH4+)由大到小的顺序为③>②>① D. 浓度均为0.1mol/L的①NH4Cl、②NaOH溶液、③Na2CO3溶液、④NaHCO3溶液,pH的大小顺序;②>④>③>① 【答案】A 【解析】A项,NaHCO3溶液中,存在电荷守恒:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),存在物料守恒:c(Na+)=c(H2CO3)+c(CO32-)+c(HCO3-),两式相减得:c(H+)+c(H2CO3)=c(CO32-)+c(OH-),故A正确;B项,0.1mol/L醋酸钠溶液20mL与0.1mol/L盐酸10mL混合,所得溶液中溶质为NaCl、CH3COONa、CH3COOH物质的量之比为1:1:1,CH3COOH的电离程度大于CH3COO-的水解程度,电离是微弱的,所以c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),故B错误;C项,物质的量浓度相等的①NH4Cl、②(NH4)2SO4、③NH4Al(SO4)2三种溶液,③中NH4+与Al3+水解相互抑制,所以③中c(NH4+)大于①中c(NH4+),又因为NH4+水解是微弱的,所以②中c(NH4+)最大,则c(NH4+)由大到小的顺序为②>③>①,故C错误;D项,①NH4Cl中NH4+水解使溶液显酸性,②NaOH溶液、③Na2CO3溶液、④NaHCO3溶液都是显碱性的,同浓度碳酸根离子水解程度大于碳酸氢根离子水解程度,③Na2CO3溶液碱性强于④NaHCO3溶液,又因为水解是微弱的,所以②NaOH溶液碱性最强,则pH的大小顺序:②>③>④>①,故D错误。 15. 对于平衡体系:aA(g)+bB(g)cC(g)+dD(g) △H<0,下列判断其中不正确的是 A. 若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.45倍,则a+b查看更多